2. 复旦大学生命科学学院, 上海 200438
2. School of Life Sciences, Fudan University, Shanghai 200438, China
当单克隆抗体(单抗,mAb)处在水相体系中,通常会产生带电极性氨基酸。它们与溶液中的物质产生分子间相互作用,表面残基会发生多种化学或酶修饰,从而使得单抗变成一种带有轻微静电差异的电荷异质性混合物[1-3]。在生物制药行业中,离子交换色谱(ion-exchange chromatography,IEC)作为治疗性单抗产品电荷异质性分析的“金标准”被广泛应用[2, 4-7]。
传统的盐梯度IEC方法是产品特异性的,对于不同的抗体需要开发不同的方法[8],对于需要同时开发多个品种的企业或检测机构工作意味着负荷高、通量低、效率差等问题,并且分离度往往无法令人满意[9]。基因泰克公司于2009年发表了采用pH梯度进行IEC分析的第一篇报道[10],经过改进和进一步发展,该方法已经很好地替代传统的盐梯度分离方法[11]。pH梯度的IEC分析相较于传统盐梯度IEC分析的分离度更好,具备平台化分析的能力—即可用同一方法检测不同抗体;此外,pH梯度的IEC分析方法对样品基质的耐受性很强[12],且这种方法的良好分离并不主要受制于色谱柱长度,因此可通过使用更短色谱柱获得更高通量。
根据2015年2月28日国家食品药品监督管理总局发布的《生物类似药研发与评价技术指导原则(试行)》中关于“研究中应尽可能使用敏感的、先进的分析技术和方法检测候选药与参照药之间可能存在的差异”的要求,本研究利用pH梯度IEC方法对贝伐珠单抗、曲妥珠单抗、利妥昔单抗这3种已被广泛研究和开发的抗体进行了初步分析,并与美国药典(USP)各论中记载的盐梯度方法进行比较。然后以贝伐珠单抗为例,研究了进一步提高分析通量的思路与方法,并进行方法学验证。
1 仪器、供试品和材料 1.1 仪器高效液相色谱系统采用Waters Acuity Arc液相色谱系统。
1.2 供试品mAb1、mAb2和mAb3为上海复旦张江生物医药股份有限公司经由中国仓鼠卵巢细胞(CHO)所表达的单克隆抗体,这些单抗的等电点(pI)采用Beckman Coulter公司的cIEF试剂盒并参考标准操作规程进行测定。贝伐珠单抗(Bevacizumab,商品名Avastin®,批号H0144)、曲妥珠单抗(Trastuzumab,商品名Herceptin®,批号N3661)、利妥昔单抗(Rituximab,商品名Rituxan®,批号H0151)均购自Roche公司。
1.3 材料羧肽酶B(Carboxypeptidase B,CpB)购自Roche公司;三羟甲基氨基甲烷、咪唑、哌嗪、磷酸钠、磷酸、氯化钠、MES、氢氧化钠均购自Sigma公司;色谱柱为Thermo公司弱阳离子色谱柱ProPacTM WCX-10(10 mm,4 mm×250 mm)。
2 方法 2.1 样品处理用10 mmol·L-1磷酸钠缓冲液(pH 6.6)将不同MAb分别稀释至1 mg·mL-1,然后按照CpB与样品质量比例1:20加入CpB(5 mg·mL-1)进行酶切,37 ℃孵育2 h。
2.2 液相色谱条件 2.2.1 平台化pH梯度方法采用三元流动相,其中流动相A为4 mmol·L-1 Tris、4 mmol·L-1咪唑、4 mmol·L-1哌嗪水溶液,用盐酸溶液调pH至5.0,流动相B为4 mmol·L-1 Tris、4 mmol·L-1咪唑、4 mmol·L-1哌嗪水溶液,流动相C为500 mmol·L-1氯化钠水溶液,分离梯度为0 min,0%流动相B和0%流动相C;2 min,0%流动相B和0%流动相C;60 min,96.8%流动相B和3.2%流动相C;64 min,96.8%流动相B和3.2%流动相C;65 min,0%流动相B和0%流动相C;72 min,0%流动相B和0%流动相C,流速1 mL·min-1,色谱柱温度25 ℃,样品室温控2~8 ℃,进样体积40 μL。经过初次实验后,可根据单抗pI值的不同,提高起始流动相B和流动相C的比例以提高通量,原则是单位时间内流动相变化速率恒定。
2.2.2 贝伐珠单抗盐梯度检测方法参考USP,流动相A为10 mmol·L-1磷酸钠水溶液,用磷酸调pH至6.6,流动相B为10 mmol·L-1磷酸钠,0.1 mol·L-1氯化钠水溶液,用磷酸调pH至6.6,分离梯度为在50 min内流动相B由30%~70%,流速0.8 mL·min-1,色谱柱温度25℃,样品室温控8 ℃,进样体积40 μL,分离方法总长75 min,色谱柱为4.6 mm×100 mm;packing L53 (可选Tosoh,TSKgel CM-STAT)。
2.2.3 曲妥珠单抗盐梯度检测方法参考USP,流动相A为10 mmol·L-1磷酸钠水溶液,用氢氧化钠溶液调pH至7.5,流动相B为10 mmol·L-1磷酸钠,0.1 mol·L-1氯化钠水溶液,用氢氧化钠溶液调pH至7.5,分离梯度为在38 min内流动相B由0~30%,流速0.8 mL·min-1,色谱柱温度45 ℃,样品室温控8 ℃,进样体积40 μL,分离方法总长55 min,色谱柱为4.6 mm×100 mm;packing L53 (可选Tosoh,TSKgel CM-STAT)。
2.2.4 利妥昔单抗盐梯度检测方法参考USP,流动相A为20 mmol·L-1 MES水溶液,用氢氧化钠溶液调pH至6.0,流动相B为20 mmol·L-1 MES,0.4mol·L-1氯化钠水溶液,用氢氧化钠溶液调pH至6.0,分离梯度为在85 min内流动相B由17%~45%,流速0.7 mL·min-1,色谱柱温度30 ℃,样品室温控5 ℃,进样体积40 μL,分离方法总长115 min,色谱柱为4.0 mm×25 cm;packing L53 (可选Dionex,Pro Pac WCX-10)。
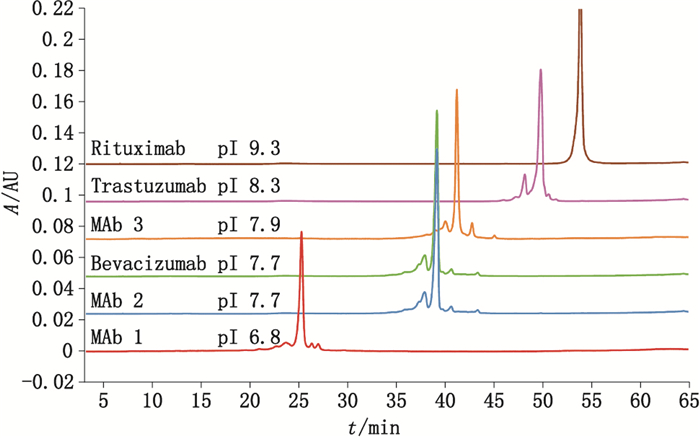
3 结果 3.1 平台化pH梯度分离结果如图 1所示,用pH梯度分析单抗的电荷异质性时,采用完全相同的条件(色谱柱、流动相、分离梯度)可以对pI显著不同的单抗的电荷异质性进行分析,且具有良好的分离度,酸性峰、碱性峰与主峰得到了良好的分离,基线平稳。
|
图 1 6种不同pI单抗pH梯度分离结果 Figure 1 The charge heterogeneity profiles of 6 MAbs with different pI values acquired by pH-IEC method |
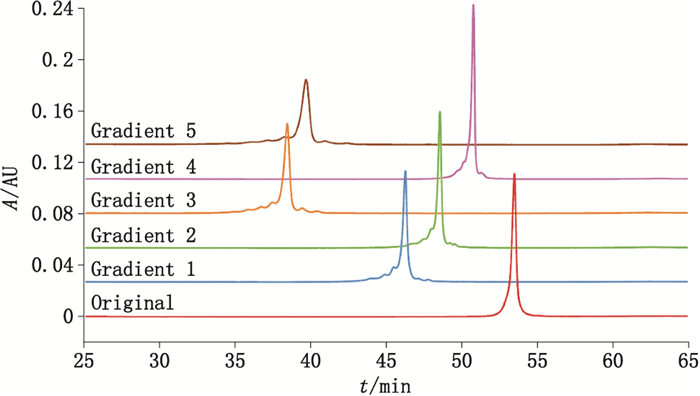
值得注意的是,pI大于9的单克隆抗体的电荷异质性分析往往较难[10],可以看出通用型方法对于利妥昔单抗(pI 9.3)的分离也较差。可以利用四元泵的特性,将4个流路放入不同的母液中,自动混合出预期的流动相比例(此时流动相A为40 mmol·L-1Tris、40 mmol·L-1咪唑、40 mmol·L-1哌嗪水溶液,用盐酸溶液调pH至5.0;流动相B为40 mmol·L-1 Tris、40 mmol·L-1咪唑、40 mmol·L-1哌嗪水溶液;流动相C为500 mmol·L-1氯化钠水溶液;流动相D为纯水),仅改变梯度即可改善酸碱区与主峰的分离(梯度条件见表 1,分离图谱见图 2),优化后的梯度条件3获得了最佳的分离效果,显示出本方法良好的拓展性。
|
|
表 1 利妥昔单抗优化分离液相条件 Table 1 LC conditions for improving rituximab separation |
|
图 2 利妥昔单抗分离梯度优化 Figure 2 Improving pH-IEC gradient of rituximab |
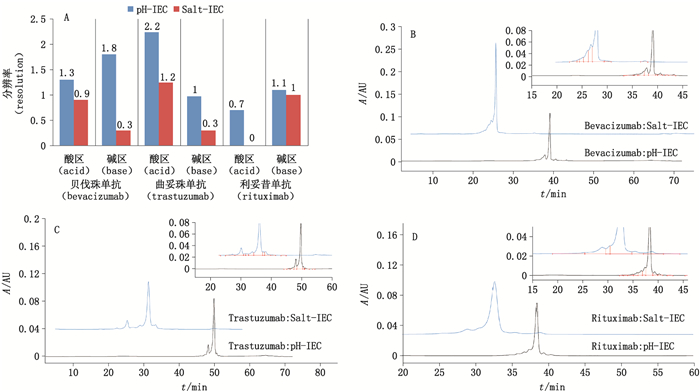
采用传统盐梯度分析时,不同单抗的分析需要配制不同的流动相、使用不同的色谱柱,较为费时费力,对于需要开发、检测多个品种的实验室,极大地降低了工作效率,并且分离度往往难以令人满意。用USP各论中记载的盐梯度方法相应地对贝伐珠单抗、曲妥珠单抗和利妥昔单抗进行分离,酸性峰、碱性峰与主峰的分离度明显低于pH-IEC方法。分离结果与图谱比对见表 2和图3。此处描述的分离度指主峰与其最接近的酸性峰之间的分离度、主峰与其最接近的碱性峰之间的分离度,在批放行检验、稳定性考察、工艺优化检测中一般不考虑各酸性峰间、各碱性峰间的分离度。
|
|
表 2 pH梯度与盐梯度分离结果对比 Table 2 Comparisonof the separation results between pH gradient and salt gradient methods |
|
A.分离度汇总(resolution summary)B.贝伐珠单抗(bevacizumab)C.曲妥珠单抗(trastuzumab)D.利妥昔单抗(rituximab) 图 3 3种单抗pH-IEC与Salt-IEC分离方法比较 Figure 3 Resolution comparison between pH-IEC and Salt-IEC methods towards three MAbs |
MAb 2是贝伐珠单抗的生物类似药,针对这一品种我们照“2.2.1”中所述对方法进行优化,每一针分离时间由原先的72 min缩短至46 min,与原方法相比,通量提高了约40%,并对该方法进行了方法学验证。
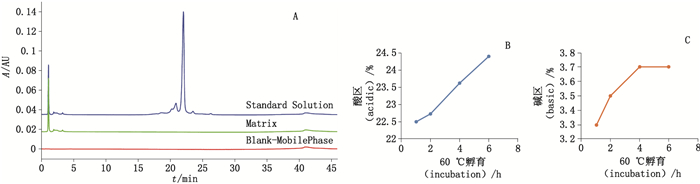
3.3.1 专属性取流动相A作为空白样品(blank-mobile phase),将制剂缓冲液与蛋白样品同步前处理,分别制成基质样品(matrix)和标准样品(standard solution)。如图 4所示,流动相、基质溶液的色谱图在积分窗口内无任何色谱峰,供试品显示有明显的酸区、主峰和碱区,经高温破坏后可观察到酸区杂质和碱区杂质均有趋势性增加。
|
A.流动相、基质溶液、供试品叠加图(chromatogram of the mobile phase,the matrix solution and the standard solution)B.高温破坏实验酸区变化(acidic variants during heat treatment)C.高温破坏实验碱区变化(basic variants during heat treatment) 图 4 贝伐珠单抗生物类似药pH-IEC方法学验证—专属性 Figure 4 Method validation of pH-IEC for bevacizumab biosimilar-specificity |
重复性试验中制备6份样品,每个样品进样3次,共18针数据进行统计分析。结果显示主峰保留时间重复性良好,RSD为0.12%,酸区、主峰、碱区百分比峰面积RSD分别为1.5%、0.44%、1.6%,中间精密度实验由其他实验者同法制备样品,与原实验者数据统计分析。结果显示酸区、主峰、碱区百分比峰面积RSD分别为1.6%、0.47%、1.8%。结果见表 3、4。
|
|
表 3 贝伐珠单抗生物类似药pH-IEC方法学验证—精密度:重复性结果表(n=18) Table 3 Results of method validation for bevacizumab biosimilar—precision:repeatability |
|
|
表 4 贝伐珠单抗生物类似药pH-IEC方法学验证—精密度:中间精密度结果表 Table 4 Results of method validation for bevacizumab biosimilar—precision:intermediate |
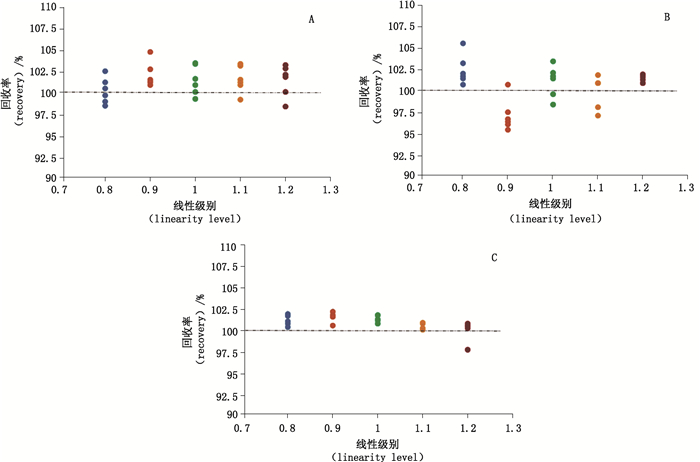
设定5个不同浓度(80%、90%、100%、110%、120%),进样后计算每个浓度下的酸区面积、主峰面积、碱区面积,与标准浓度进样的结果进行比对。通过计算回收率,统计分析准确度。如图 5所示,酸区6次进样的平均回收率在5个不同级别分别为102.4%、97.1%、101.1%、100.0%、101.4%,主峰6次进样的平均回收率在5个不同级别分别为101.3%、101.6%、101.3%、100.5%、100.1%,碱区6次进样的平均回收率在5个不同级别分别为100.3%、102.1%、101.5%、101.6%、101.5%,且各组数据的RSD均小于2%;酸区所有数据回收率的总体平均值为100.4%,主峰所有数据回收率的总体平均值为101.0%,碱区所有数据回收率的总体平均值为101.4%,RSD均小于2%。
|
A.酸区回收率(recovery of acidic variants)B.主峰回收率(recovery of main peak)C.碱区回收率(recovery of basic variants) 图 5 贝伐珠单抗生物类似药pH-IEC方法学验证—准确度 Figure 5 Method validation of pH-IEC for Bevacizumab biosimilar—Accuracy |
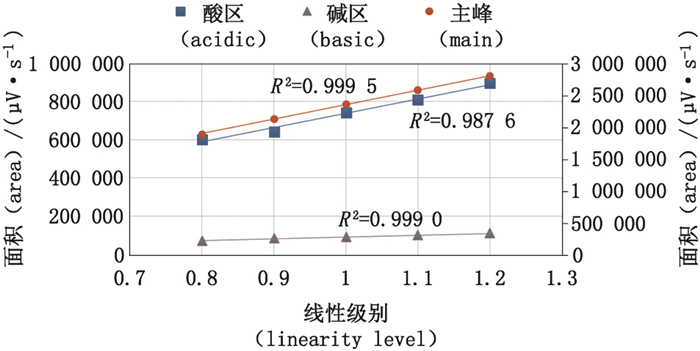
本方法将供试品稀释1 mg·mL-1进行检测。由于检测浓度较低,因此无论对于批放行检验样品或工艺过程样品均可通过简单的稀释达到,使得本方法在单抗产品的阳离子色谱法分析中适用性很强,该方法线性与范围验证与本文中涉及的3个抗体的USP各论中均一致。设定5个线性级别(80%、90%、100%、110%、120%,蛋白质含量分别对应0.8、0.9、1.0、1.1、1.2 mg·mL-1)进行检测,分别对酸区、主峰、碱区的峰面积与样品蛋白含量进行回归分析。如图 6所示,在检测范围80%~120%内,酸区、主峰、碱区峰面积均与样品蛋白含量呈线性关系,线性相关系数R2分别为0.987 6、0.999 5、0.999 0。
|
图 6 贝伐珠单抗生物类似药pH-IEC方法学验证—线性与范围 Figure 6 Method validation of pH-IEC for bevacizumab biosimilar—linearity and range |
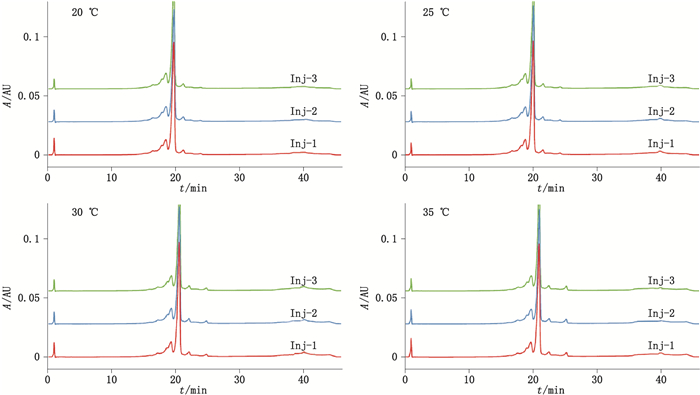
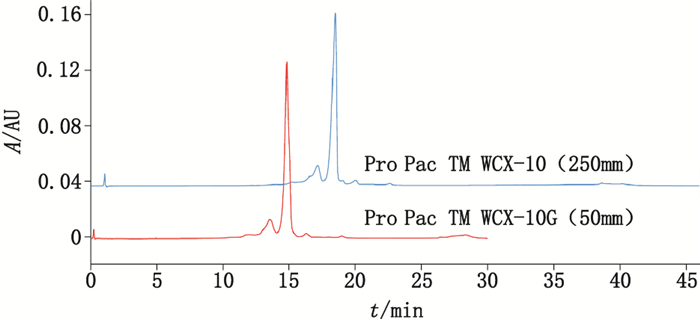
分别向供试品中添加0、50、100、150、200和250 mmol·L-1的氯化钠后进行检测,具体数据见表 5。结果显示方法对基质的耐受性很强,即使供试品缓冲液中存在高浓度的盐也不影响蛋白质在色谱柱上的保留和洗脱,不同浓度氯化钠添加的供试品酸区、主峰、碱区的百分比峰面积RSD分别为0.8%、0.3%、2.0%;将色谱柱温度设置在20~35 ℃,如图 7和表 6所示,方法对温度的耐受性良好,不同色谱柱温度仅影响绝对保留时间,结果显示在该温度范围内主峰的保留时间RSD均为0.1%,所有供试品酸区、主峰、碱区的百分比峰面积的总体RSD分别为2.3%、0.7%、5.3%;ProPacTM WCX-10色谱柱长25 cm,该系列同时提供一根5 cm的预柱,如图 8所示,在pH-IEC模式下选用短色谱柱可以进一步提高通量,同时对分离度无明显影响,因此更加适用于需要快速检测的研发早期筛选评价阶段。
|
|
表 5 贝伐珠单抗生物类似药pH-IEC方法学验证—耐用性:基质效应结果表 Table 5 Results of method validation for bevacizumab biosimilar-robustness:matrix effect |
|
图 7 贝伐珠单抗生物类似药pH-IEC方法学验证—耐用性:色谱柱温度 Figure 7 Method validation of pH-IEC for bevacizumab biosimilar—robustness:column temperature |
|
|
表 6 贝伐珠单抗生物类似药pH-IEC方法学验证—耐用性:色谱柱温度结果表 Table 6 Resultsofmethod validation for bevacizumab biosimilar—robustness:column temperature |
|
图 8 贝伐珠单抗生物类似药pH-IEC方法学验证—耐用性:短色谱柱 Figure 8 Method validation of pH-IEC for bevacizumab biosimilar— robustness:shorter column |
目前,在生物技术药物分析实验室中,对于单克隆抗体的电荷异质性分析工作除采用高效液相色谱法之外,通常还有等电聚焦(IEF)、毛细管等电聚焦(cIEF)、镜像毛细管电泳(iCE)等手段[13-14],但上述方法相比于HPLC法仍然存在一些劣势,如分辨率不足(IEF),溶液配制烦琐、通量较低(cIEF),设备昂贵、功能单一(iCE)等问题。阳离子交换色谱法仍然是mAb开发和放行检验中的首选电荷异质性分析方法[15]。
本研究中采用的pH梯度IEC方法具有方法平台化、分离度好、通量高、耐用性强(供试品体系耐受高浓度盐,离子强度0~250 mmol·L-1NaCl、色谱柱温度范围广、可在不影响分离度的情况下用短色谱柱提高通量)等优势。在治疗性单抗产品的早期筛选阶段,对于来源多样、基质情况复杂的不同细胞株亚克隆表达的单抗,采用pH-IEC方法能够省去大量前处理步骤或大大节约前处理时间,在高通量方法的帮助下一次性对数十个甚至上百个样品进行分析;在单抗的批放行检验或复核检验中,采用pH-IEC方法能够用完全相同的条件对不同等电点(pI)的单抗进行分离,对本研究中的6个不同的单抗均可实现良好分离,此外我们还将收录于美国药典(USP)的3种单抗—贝伐珠单抗、曲妥珠单抗、利妥昔单抗与其各论中记载的盐梯度分离方法进行比较,结果显示3种单抗的主峰与酸区、碱区的分离度均有改善,贝伐珠单抗分离度分别提高了44%和500%;曲妥珠单抗分离度分别提高了83%和233%;利妥昔单抗酸区分离度由无法给出提高到0.7,碱区分离度提高了10%。应用这种方法,缩短了检验时间,加速了检验流程,且分离度较盐梯度方法更佳,提高了检测结果的准确程度。
该方法还可按照单位时间内流动相变化速率恒定的原则,根据单抗pI值的不同,提高起始流动相B和流动相C的比例,进一步提高通量,在本研究中对贝伐珠单抗的检测方法进行优化,使得每一针分离时间由原先的72 min缩短至46 min,与原方法相比通量约提高了40%,并对该方法进行了方法学验证。验证结果显示方法专属性良好,经高温破坏后,可观察到酸区杂质和碱区杂质均有趋势性增加;精密度良好,在重复性试验中主峰保留时间RSD为0.12%,在中间精密度试验中酸区、主峰、碱区百分比峰面积RSD均小于2%;准确度良好,酸区、主峰、碱区在5个不同浓度级别中回收率总体平均值分别为100.4%、101.0%、101.4%;线性良好,在蛋白含量0.8~1.2 mg·mL-1范围内,酸区、主峰、碱区的峰面积与样品蛋白含量呈线性关系,主峰与碱区线性相关系数R2均大于0.999,酸区R2为0.988;耐用性良好,当流动相pH、色谱柱温度在一定范围内波动时,或将供试品和流动相放置几天,酸区、碱区和主峰的百分比峰面积含量测定结果重复性良好,RSD均小于3%。
综上所述,对于有开发、检测多个抗体品种需求的实验室,pH梯度IEC方法无论在研发初期还是批放行检验中都能够有效降低人力、物力和时间成本。该方法良好的潜力使其正逐渐替代传统的盐梯度IEC方法。对于研发企业来说,采用更先进的分析方法,也遵循了《生物类似药研发与评价技术指导原则》中关于State of the Art的分析精神。
| [1] |
PONNIAH G, KITA A, NOWAK C, et al. Characterization of the acidic species of a monoclonal antibody using weak cation exchange chromatography and LC-MS[J]. Anal Chem, 2015, 87(17): 9084. DOI:10.1021/acs.analchem.5b02385 |
| [2] |
BECK A, WAGNERROUSSET E, AYOUB D, et al. Characterization of therapeutic antibodies and related products[J]. Anal Chem, 2013, 85(2): 715. DOI:10.1021/ac3032355 |
| [3] |
HARRIS R J, KABAKOFF B, MACCHI FD, et al. Identification of multiple sources of charge heterogeneity in a recombinant antibody[J]. J Chromatogr B Biomed Sci Appl, 2001, 752(2): 233. DOI:10.1016/S0378-4347(00)00548-X |
| [4] |
于传飞, 王文波, 刘春雨, 等. 离子交换色谱对抗VEGFR2单抗的电荷异质性分析[J]. 微生物学免疫学进展, 2014, 42(5): 17. YU CF, WANG WB, LIU CY, et al. Analysis of charge heterogeneity for anti-VEGFR2 monoclonal antibody by CEX-HPLC[J]. Prog Microbiol Immuno, 2014, 42(5): 17. |
| [5] |
BECK A, DIEMER H, AYOUB D, et al. Analytical characterization of biosimilar antibodies and Fc-fusion proteins[J]. TrAC Trends Anal Chem, 2013, 48: 81. DOI:10.1016/j.trac.2013.02.014 |
| [6] |
STOLL D R, HARMES DC, DANFORTH J, et al. Direct identification of rituximab main isoforms and subunit analysis by online selective comprehensive two-dimensional liquid chromatography-mass spectrometry[J]. Anal Chem, 2015, 87(16): 8307. DOI:10.1021/acs.analchem.5b01578 |
| [7] |
GANDHI S, REN D, XIAO G, et al. Elucidation of degradants in acidic peak of cation exchange chromatography in an IgG1 monoclonal antibody formed on long-term storage in a liquid formulation[J]. Pharm Res, 2012, 29(1): 209. DOI:10.1007/s11095-011-0536-0 |
| [8] |
FEKETE S, BECK A, FEKETE J, et al. Method development for the separation of monoclonal antibody charge variants in cation exchange chromatography, Part I:salt gradient approach[J]. J Pharm Biomed Anal, 2015, 102(3): 33. |
| [9] |
FEKETE S, BECK A, FEKETE J, et al. Method development for the separation of monoclonal antibody charge variants in cation exchange chromatography, Part Ⅱ:pH gradient approach[J]. J Pharm Biomed Anal, 2015, 102: 282. DOI:10.1016/j.jpba.2014.09.032 |
| [10] |
ZHANG L, PATAPOFF T, FARNAN D, et al. Improving pH gradient cation-exchange chromatography of monoclonal antibodies by controlling ionic strength[J]. J Chromatogr A, 2013, 1272(1): 56. |
| [11] |
FARNAN D, MORENO GT. Multiproduct high-resolution monoclonal antibody charge variant separations by pH gradient ion-exchange chromatography[J]. Anal Chem, 2009, 81(21): 8846. DOI:10.1021/ac901408j |
| [12] |
REA JC, MORENO GT, LOU Y, et al. Validation of a pH gradient-based ion-exchange chromatography method for high-resolution monoclonal antibody charge variant separations[J]. J Pharm Biomed Anal, 2011, 54(2): 317. DOI:10.1016/j.jpba.2010.08.030 |
| [13] |
于传飞, 郭玮, 王兰, 等. 成像毛细管等点聚焦电泳法对单克隆抗体制品的电荷异质性分析[J]. 药物分析杂志, 2014, 34(7): 1212. YU CF, GUO W, WANG L, et al. Charge heterogeneity analysis of monoclonal antibody products with imaging capillary isoelectric focusing electrophoresis[J]. Chin J Pharm Anal, 2014, 34(7): 1212. |
| [14] |
于传飞, 王兰, 张峰, 等. 重组人源化抗DR5单克隆抗体质控方法的建立[J]. 中国生物制品学杂志, 2014, 27(9): 1168. YU CF, WANG L, ZHANG F, et al. Development of a method for quality control of recombinant humanized anti-DR5 monoclonal antibody[J]. Chin J Biol, 2014, 27(9): 1168. |
| [15] |
DU Y, WALSH A, EHRICK R, et al. Chromatographic analysis of the acidic and basic species of recombinant monoclonal antibodies[J]. MAbs, 2012, 4(5): 578. DOI:10.4161/mabs.21328 |
 2018, Vol. 38
2018, Vol. 38 
