2. 中国食品药品检定研究院, 北京 102629;
3. 福建中医药大学, 福州 350122;
4. 关节动力安达(天津)生物科技有限公司, 天津 300308
2. National Institutes for Food and Drug Control, Beijing 102629, China;
3. Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China;
4. Arthro-Anda Tianjin Biological Technology Co., Ltd., Tianjin 300308, China
骨关节炎(osteoarthritis)是一种骨骼退行性疾病,最主要的特点是软骨细胞死亡和由于软骨细胞外基质(extracellular matrix)合成代谢与分解代谢之间的不平衡而导致的软骨组织进行性丢失,严重影响患者的关节功能和降低生活质量[1]。目前我国骨关节炎患者估计有1亿人以上,且随人口老年化的发展,患者人数不断上升。然而,骨关节炎具体的致病机理还不明确。目前的治疗手段主要有药物治疗、人工关节置换手术以及自体软骨细胞移植。药物治疗常用非甾体类抗炎药,长期服用会引起不良反应;人工关节置换不能真正模拟并替代复杂的人体关节结构;软骨细胞自身增殖分化能力弱,使软骨细胞再生技术的发展受到了一定的限制[2]。关节软骨是骨关节的重要组成部分,是一种特殊分化的结缔组织,由软骨细胞(5%~10%)、水(65%~80%)、胶原、大分子负极亲水性的蛋白多糖(蛋白聚糖、透明质酸)、小分子糖蛋白(如纤连蛋白、软骨寡聚蛋白等)组成[3]。其中软骨细胞是软骨组成的单一细胞,为终末分化细胞,由于其再生能力弱,具有自身修复能力较差且损伤后不易愈合的特点[4]。胶原和蛋白多糖是软骨细胞外基质的重要组成部分,其中Ⅱ型胶原是关节软骨的主要胶原成分,占总胶原量的90%~95%,糖胺多糖占软骨聚集蛋白聚糖(蛋白聚糖,aggrecan)分子量的80%~90%。骨性关节炎是骨伤科临床治疗的难题之一,久治难愈且易复发,目前尚无能有效阻止该病进展的治疗药物与方法。近年来有大量的采用中医药治疗骨关节炎及骨损伤的临床报道,治疗目标以活血化瘀和补益肝肾为主。
丹参注射液主要成分为丹参素、原儿茶醛、迷迭香酸、丹酚酸B等,有活血化瘀功效,临床上常用来治疗心血管疾病,也有辅助治疗骨关节炎的疗法,治疗多采用关节腔内注射的方法[5-8]。丹参注射液治疗骨关节炎的机理多基于临床和动物体内以及动物软骨细胞的体外研究,针对人关节软骨细胞的研究文献报道较少。有研究显示:丹参加玻璃酸钠关节内注射,能明显降低兔膝关节软骨的细胞凋亡率,减缓膝关节软骨的退变,对软骨起保护作用。丹参注射液可通过调节软骨细胞的合成代谢、降低分解代谢,促进软骨细胞蛋白多糖合成,从而促进软骨细胞的增殖[9]。丹参的有效成分丹参酮(IIA)还能抑制软骨细胞增殖,该研究者用4种不同浓度丹参酮(IIA)干预软骨细胞培养,用MTT(methylthiazole tetrazolium)法检测各组细胞的增殖情况,结果发现,丹参酮(IIA)可明显抑制软骨细胞的增殖,且抑制程度与丹参酮(IIA)的浓度呈正相关[10]。但也有研究发现,丹参注射液对于体外软骨细胞的增殖和蛋白合成无明显影响。因此丹参注射液对骨及软骨细胞的具体作用机制未完全阐明,特别在分子生物学水平[11]。
体外原代软骨细胞是研究正常软骨细胞生物学特性及骨关节炎发病机制的重要手段,同时也是软骨组织工程的基础。为了研究丹参注射液治疗骨关节炎作用机理,本实验用人的原代关节软骨细胞进行体外培养,观察丹参注射液对软骨细胞的增殖、Ⅰ型胶原、Ⅱ型胶原和糖胺多糖(glycosaminoglycan,GAG)的影响,从而分析丹参注射液对人原代软骨细胞的生物学效应。
1 材料与仪器 1.1 材料软骨细胞:培养至第7天的原代人关节软骨细胞,由关节动力安达(天津)生物科技有限公司提供。
试剂:丹参注射液(上海新亚药业高邮有限公司,salvia miltiorrhiza injection,SMI,批号:160828-1,丹参原药材:1.5 g·mL-1。主要成分:丹参素钠:1.4 mg·mL-1;原儿茶醛:0.33 mg·mL-1;迷迭香酸:0.15 mg·mL-1;丹酚酸B:0.10 mg·mL-1);MTT试剂盒(碧云天生物技术);细胞糖胺多糖定量检测试剂盒(上海拓旸生物技术有限公司);逆转录试剂盒“Super Script Ⅲ First-Strand”(Invitrogen公司);荧光PCR试剂“SYBR Premix E x Taq Ⅱ”(TakaRa公司);TRIZOL(ambion公司);胰酶、胎牛血清、细胞培养液(GIBCO公司);Human COL1α1(Collagen Type Ⅰ Alpha 1)Enzyme-Linked ImmunoSorbent(ELISA)Kit、Human COL2α1(Collagen Type Ⅱ Alpha 1)ELISA Kit(Elabscience,武汉伊莱瑞特生物科技股份有限公司)。
PCR引物合成:委托生工生物工程(上海)完成。
1.2 仪器二氧化碳培养箱(赛默飞BB150)、生物分光光度计(eppendorf,Biophotometer BBP237)、酶标仪(Molecular devices Spectramax M5)、实时荧光定量PCR仪(Roche LightCycler 96)、离心机(北京鼎昊源科技有限公司,CC6)、倒置显微镜(OLYMPUS CKX41)。
2 方法 2.1 MTT实验原代人关节软骨细胞,用10%胎牛血清、90% Dulbecco’s modified eagle medium(DMEM)/F12(1:1)配制培养液,置5% CO2、37 ℃培养箱内培养。在细胞传至第3代,以2.65×106个·mL-1将细胞接种于96孔板,每孔200 μL(n=3)。培养24 h后,更换培养液。对照组为不加丹参注射液的正常培养液。以丹参原药材1.5 g制成1 mL丹参注射液的丹参原药材计算给药浓度。实验组设立6组,浓度分别为0.5、1.0、2.0、4.0、8.0、16.0 mg·mL-1,每组设5个复孔。培养细胞第3天至90%左右时,吸去培养液,用PBS漂洗2次,加100 μL不含药培养液,MTT试剂(5 g·L-1)10 μL,培养4 h,吸去培养液,加150 μL DMSO(Dimethyl sulfoxide),摇床振荡10 min,酶标仪560 nm处测OD值。
2.2 荧光定量RT-PCR细胞培养至第3代,以5.0×104个·mL-1接种至6孔板,每孔2 mL(n=3),培养24 h后,去除培养液,实验组为含丹参注射液4组,对照组为正常培养液。培养细胞至第3天,去除上清,每孔用1 mL TRIZOL收取细胞,提取总RNA(按TRIZOL试剂盒说明操作)。各组分别以1μg RNA进行cDNA合成(用invitrogen试剂盒中First-Strand cDNA Synthesis的说明操作)。用TakaRa公司SYBR Premix E x Taq Ⅱ Kit的试剂进行荧光定量检测(PCR引物序列见表 1),反应体系为:cDNA模板2 μL,Premix10 μL,上游引物0.2 μL,下游引物0.2 μL,不含核酸酶(RNase-free)水7.6 μL,总反应体系20 μL。反应程序:95 ℃预变性(preincubation)30 s;三步法扩增:95 ℃ for 10 s,57 ℃ for 20 s,72 ℃ for 10 s,循环数40;溶解(Melting)95 ℃ for 10 s,65 ℃ for 60 s,97 ℃ for 1 s。GAPDH(glyceraldehyde-3-phosphate dehydrogenase)作为内参基因,用2-△△t法计算目的基因的相对表达量。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 The primers used for real-time PCR |
细胞培养至第3代,以5.3×104个·mL-1接种至6孔板,每孔2 mL(n=3),分实验组4组和对照组,培养至24 h,实验组加入相应浓度的给药培养液,对照组为正常培养液。培养至3 d,每孔取200 μL上清。待测样品检测前于1 000×g离心20 min,以除去杂质及细胞碎片。按相应ELISA试剂盒的操作步骤检测Ⅰ、Ⅱ型胶原蛋白含量。
2.4 糖胺多糖的检测细胞培养至第3代,以5.0×104个·mL-1接种至6孔板,每孔2 mL(n=3),培养24 h后,去除培养液,实验组为含丹参注射液4组,对照组为正常培养液。培养至第6天时,收取细胞检测总糖胺多糖的含量,按照二甲基亚甲基蓝(DMMB)比色法定量检测试剂盒说明操作。
2.5 统计学分析采用SPSS 20.0统计学软件分析,数据以平均值±标准偏差(mean±SD)表示。经过方差齐性检验,组间差异采用单因素方差分析(one-way ANOVA)中LSD进行两两比较检验。设定P < 0.05差异有统计学意义。
3 结果 3.1 软骨的细胞形态观察在倒置显微镜下观察,培养第7天的原代人关节软骨细胞密集处呈圆形,胞体丰满,胞质均匀,折光率高且互相连接成“铺石路”样外观(图 1-A)。培养至第3代时细胞呈多角形,细胞有折光,边缘有突起,体积变大(图 1-B)。

|
A.原代细胞(primary cells)B.第3代细胞(the third passage cells) 图 1 人关节软骨细胞形态(放大倍数×100) Figure 1 Morphology of human articular chondrocyte(magnification×100, bar=100 µm) |
MTT实验结果(表 2、图 2)显示,与对照组相比各浓度的丹参注射液组对软骨细胞有一定的抑制作用,其中0.5 mg·mL-1与对照组相比无明显差异,其余各组与对照组相比呈现显著的抑制作用(P < 0.05,P < 0.01),且从8.0mg·mL-1开始相对增殖率开始明显降低,随着各组的浓度增加,抑制作用呈现了一定的量效关系,可能8.0、16.0 mg·mL-1的丹参注射液对人软骨细胞显示了一定的细胞毒性。
|
|
表 2 软骨细胞增值活性 Table 2 The proliferation activity of chondrocytes |

|
图 2 丹参注射液对软骨细胞增殖的作用 Figure 2 The effect of SMI on cell proliferation of chondrocytes |
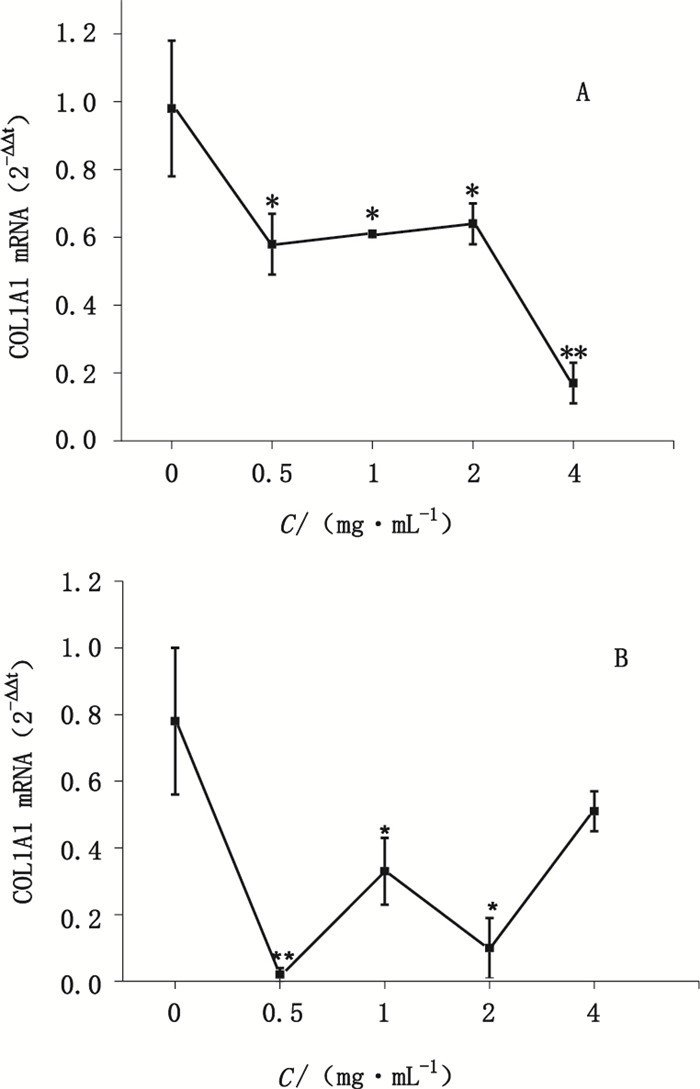
各组软骨细胞Ⅰ、Ⅱ型胶原和内参基因(GAPDH)的溶解曲线峰单一(资料未提供),说明引物的特异性较好。荧光定量RT-PCR法检测Ⅰ、Ⅱ型胶原mRNA表达,其结果显示,与对照组相比不同浓度的丹参注射液均显著降低了细胞Ⅰ、Ⅱ型胶原的表达量。其中,Ⅰ型胶原mRNA显示了一定的量-效关系;Ⅱ型胶原mRNA表达量在各丹参注射液不同浓度的组间相比差异较大,4.0 mg·mL-1组表达量最高,与对照组没有显著差异(见表 3、图 3)。
|
|
表 3 丹参注射液处理后细胞mRNA表达 Table 3 mRNA expression level of the cells afterSMI administration |
|
图 3 丹参注射液对Ⅰ型(A)、Ⅱ型(B)胶原mRNA表达的影响 Figure 3 The effect of SMI on the mRNA expression level of collagen type Ⅰ(A)/ Ⅱ(B) |
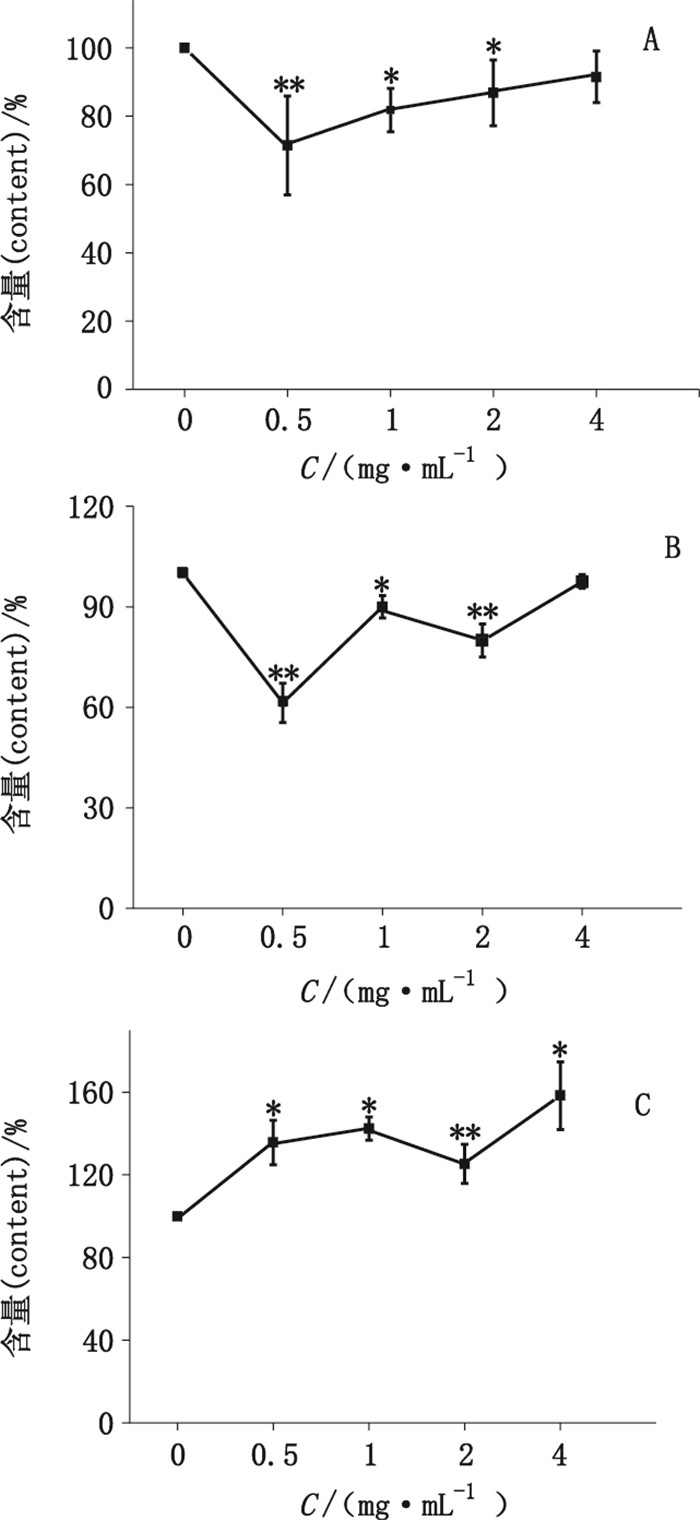
检测结果(表 4、图 4)显示:与对照组相比,0.5、1.0、2.0 mg·mL-1的丹参注射液组对Ⅰ、Ⅱ型胶原蛋白含量有一定的抑制作用(P < 0.05,P < 0.01),而4.0 mg·mL-1组与对照组之间无显著差异。细胞糖胺多糖检测结果显示除2.0 mg·mL-1组以外,其余各组与对照组相比有显著差异(P < 0.05,P < 0.01),0.5、1.0、4.0 mg·mL-1的丹参注射液组与对照组相比一定程度上促进了软骨细胞糖胺多糖含量,且有一定的剂量关系。
|
|
表 4 丹参注射液对软骨细胞Ⅰ、Ⅱ型胶原蛋白和糖胺多糖含量的影响 Table 4 The effect of SMI on the content of collagen type Ⅰ/ Ⅱ and GAG |
|
A.Ⅰ型胶原的含量(the relative content of collagen type Ⅰ)B.Ⅱ型胶原的含量(the relative content of collagen type Ⅱ)C.糖胺多糖含量(the relative content of GAG) 图 4 丹参注射液对Ⅰ、Ⅱ型胶原蛋白和糖胺多糖的影响 Figure 4 The effect of SMI on collagen type Ⅰ/ Ⅱ and GAG |
本实验研究利用人的原代关节软骨细胞进行体外培养,观察了不同浓度丹参注射液对人关节软骨细胞增殖和分化的影响。实验结果显示丹参注射液轻度抑制软骨细胞的增殖,且与丹参注射液浓度呈正相关。原代软骨细胞体外培养时的显著问题是细胞虽然能够增殖,可以实现体外扩增,但同时会导致细胞迅速脱分化,失去形成软骨的功能。丹参注射液能够抑制原代软骨细胞的增殖,预示其可能会一定程度上减缓或阻止原代软骨细胞的脱分化现象。丹参注射液降低了原代软骨细胞的Ⅰ型胶原mRNA表达,显示了抑制软骨细胞脱分化的作用。由于人原代软骨细胞资源短缺,本研究中实验重复样本数目偏少,导致结果有一定的变异。另外,由于只有一个时间点(丹参注射液作用于细胞72 h),未能显示出作用不同时间的变化。但Ⅰ型胶原mRNA表达量呈现一定的量-效关系,总的趋势性仍可说明一定的问题。在蛋白质水平,Ⅰ型胶原蛋白的表达量在低浓度(≤2.0 mg·mL-1)组呈现轻度下降,尤其在最低浓度组下降明显;而高浓度组变化不显著,提示可能低浓度的丹参注射液对抑制和减缓软骨细胞脱分化有一定的作用。本次试验中由于细胞资源短缺的限制,mRNA检测用细胞和蛋白质检测用细胞在原代时就是来源于同一供体的2瓶细胞,分别传代培养到第三代用于实验,因此,虽然是同一供体,同一代次,但不是同一批次的细胞。丹参注射液内成分较多,体外对软骨细胞的具体作用还不明确。这些可能是导致在mRNA水平和蛋白质水平检测结果的一致性上不是很吻合的原因。但是,与对照组相比,丹参注射液组Ⅰ型胶原蛋白的mRNA和蛋白质含量整体都是降低的,这些结果至少可以提示丹参注射液对抑制和减缓软骨细胞脱分化有一定的作用。
由于原代软骨细胞体外单层细胞培养时脱分化现象严重,在传至第三代时Ⅱ型胶原mRNA的表达已降至很低水平(对照组的CT值平均值为32),因此导致药物的短期作用也很难使其恢复功能,同时带来试验测定的变异很大。本试验研究中,Ⅱ型胶原mRNA的表达与对照组相比似有下降趋势,但由于细胞脱分化程度各群体(不同培养孔)间可能会存在较大差异,以及整体表达量极低的原因,导致实验结果的各浓度间没有显示规律性变化。同时,用ELISA方法检测Ⅱ型胶原蛋白含量的结果发现,高浓度组(4.0 mg·mL-1)与对照组相比无明显差异,而低浓度各组均低于对照组,各浓度间没有显示规律性变化,与mRNA的表达同样的原因相同。为了进一步确认其是否有促分化作用,本研究用RT-PCR的方法对TNFα和Caspase3 mRNA进行了补充检测,结果发现对照组的TNFα和Caspase3 mRNA的CT值大部分大于35(数据未提供),说明这2个因子的表达极低,与Ⅱ型胶原蛋白一样,说明体外严重的脱分化很难恢复。
本实验中糖胺多糖的检测结果显示,与对照组相比,各浓度组糖胺多糖含量均有显著的增高,而且具有一定的剂量-效应关系。这一结果提示了丹参注射液对原代软骨细胞分化具有一定的促进作用。
人体关节软骨主要由软骨细胞和细胞外基质组成。细胞外基质对软骨功能的建立发挥核心的作用,比如软骨机械功能。Ⅱ型胶原和糖胺多糖是软骨基质的主要成分,也一直是评估软骨再生能力和软骨细胞功能的标志性成分[12-13]。体外培养软骨细胞的糖胺多糖含量一般能达到体内水平,而Ⅱ型胶原含量一般比体内的要低的多[14-15]。这也是本实验结果中Ⅱ型胶原含量没有规律性变化,而糖胺多糖含量增加的原因。本研究实验结果表明,在体外单层细胞培养条件下,丹参注射液抑制了第3代原代软骨细胞增殖和Ⅰ型胶原的表达,在一定浓度范围内能促进糖胺多糖的含量,显示了抑制软骨细胞脱分化和促进软骨细胞分化的生物效应。本研究是局限于单细胞层原代软骨细胞培养下观察的结果,为了更科学地推测丹参注射液临床应用的作用机制,基于三维(3D)原代软骨细胞培养模型的研究是必要的。
| [1] |
ALMONTE-BECERRIL M, NAVARRO-GARCIA F, GONZALEZ-ROBLES A, et al. Cell death of chondrocytes isa combination between apoptosis and autophagy during the pathogenesis of osteoarthritis withinan experimental model[J]. Apoptosis, 2010, 15: 631. DOI:10.1007/s10495-010-0458-z |
| [2] |
徐敬, 赵建宁, 徐海栋, 等. 关节软骨损伤修复研究进展[J]. 临床与病理杂志, 2015, 35(3): 455. XU J, ZHAO JN, XU HD, et al. Progress of researches in the treatment of articular cartilage injury[J]. J Clin Pathol Res, 2015, 35(3): 455. DOI:10.3978/j.issn.2095-6959.2015.03.024 |
| [3] |
BENTLEY G, MINAS T. Treating joint damage in young people[J]. BMJ, 2000, 320(7249): 1585. DOI:10.1136/bmj.320.7249.1585 |
| [4] |
BRITTBERG M, LINDAHL A, NILSSON A, et al. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation[J]. N Engl J Med, 1994, 331(14): 889. DOI:10.1056/NEJM199410063311401 |
| [5] |
王桂蓉. 丹参注射液的药理作用与临床研究进展[J]. 现代医药卫生, 2006, 22(10): 1473. WANG GR. Progress of research in clinic and pharmacological effect of salvia miltiorrhiza injection[J]. Mod Med Health, 2006, 22(10): 1473. DOI:10.3969/j.issn.1009-5519.2006.10.033 |
| [6] |
李耿, 史载祥, 杨洪军, 等. 丹参类注射剂中主要成分含量的比较分析[J]. 中国药房, 2009, 237(3): 207. LI G, SHI ZX, YANG HJ, et al. Comparative analysis on the major constituents in Radix Salviae Miltiorrhizae injectable preparations[J]. China Pharm, 2009, 237(3): 207. |
| [7] |
王运彩. 膝关节腔注射丹参注射液合中药导入治疗膝骨关节炎的临床观察[D]. 黑龙江: 黑龙江中医药大学, 2014 WANG YC. Clinical Observation on Knee Joint Cavity Injection of Danshen Injection Combined with Traditional Chinese Medicine in Treatment of Osteoarthritis of The Knee[D]. Heilongjiang: Heilongjiang University of Chinese Medicine, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10228-1014250959.htm |
| [8] |
邓物鲜. 丹参注射液关节腔内注射治疗骨性关节炎55例临床观察[J]. 中医药导报, 2006, 12(1): 47. DENG WX. Clinical observation on treating osteoarthritis by injecting Danshen injection into articular cavity[J]. Guiding J TCM, 2006, 12(1): 47. |
| [9] |
段戡, 袁长深, 刘宇翔, 等. 丹参加玻璃酸钠预防性关节内注射对兔膝关节软骨退行性变的影响[J]. 时珍国医国药, 2012, 23(1): 77. DUAN K, YUAN CS, LIU YX, et al. Effects of preventive intra-articular injection of Radix Salvias Miltiorrhizae and sodium hyaluronate on cartilage degeneration of osteoarthritis in rabbit knee jionts[J]. Lishizhen Med Mater Med Res, 2012, 23(1): 77. |
| [10] |
宋奕, 丁道芳, 李玲慧, 等. 丹参酮Ⅱ A对大鼠原代软骨细胞增殖的影响[J]. 上海中医药大学学报, 2013, 27(5): 73. SONG Y, DING DF, LI LH, et al. Effect of tanshinone Ⅱ A on proliferation of rat's chondrocytes in Vitro[J]. Shanghai Univ Tradit Chin Med, 2013, 27(5): 73. |
| [11] |
邵敏, 牛维, 黄杰文. 补肾活血中药促进体外培养软骨细胞增殖和蛋白质合成的作用[J]. 中国临床康复, 2006, 10(19): 50. SHAO M, NIU W, HUANG JW. Role of bushen huoxue prescription in promoting proliferation and protein synthesis of chondrocytes cultured in vitro[J]. Chin J Clin Rehabil, 2006, 10(19): 50. DOI:10.3321/j.issn:1673-8225.2006.19.021 |
| [12] |
POOLE AR, NELSON F, DAHLBERG L, et al. Proteolysis of the collagen fibric in osteoarthritis[J]. Biochem Soc Symp, 2003, 70: 115. DOI:10.1042/bss0700115 |
| [13] |
HENROTIN Y, ADDISON S, KRAUS V, et al. Type Ⅱ collagen makers in osteoarthritis:what do they indicate[J]. Curr Opin Rheumatol, 2007, 19(5): 444. DOI:10.1097/BOR.0b013e32829fb3b5 |
| [14] |
MAHMOUDIFAR N, DORAN PM. Chondrogenesis and cartilage tissue engineering:the longer road to technology development[J]. Trends Biotechnol, 2012, 30(3): 166. DOI:10.1016/j.tibtech.2011.09.002 |
| [15] |
DUNKELMAN NS, ZIMBER MP, LEBARON RG, et al. Cartilage production by rabbit articular chondrocytes on polyglycolic acid scaffolds in a closed bioreactor system[J]. Biotechnol Bioeng, 1995, 46(4): 299. DOI:10.1002/(ISSN)1097-0290 |
 2018, Vol. 38
2018, Vol. 38 
