芫花为瑞香科植物芫花Daphne genkwa Sieb. et Zucc.的干燥花蕾,别名南芫花、芫花条、药鱼草等,主产于安徽、江苏、浙江、四川、山东、福建和湖北等地。中国药典(2015年版一部)中记载芫花为常用中药,具泻水逐饮、解毒功效,用于治疗水肿胀满、胸腹积水、痰饮积聚、气逆咳喘、二便不利等病症[1];黄芫花为瑞香科荛花属植物河朔荛花Wikstroemia chamaedaphne Meisn.的干燥花蕾,与芫花相似而略小,是芫花的伪品,分布于陕西、甘肃、河南以及河北等地,具泻下逐水、通便功效[2],近年来多用于治疗传染性肝炎、精神病、癫痈等,还可用于引产[3]。文献记载,黄芫花与芫花中均含有二萜原酸酯、黄酮、木质素、甾醇等成分[4-9]。市场上有用黄芫花作芫花药用,由于两者功效不尽相同,不能混淆使用。因此,寻找芫花和黄芫花的差异性,提高用药安全性显得尤为重要。
中药特征图谱能鉴别中药材真伪并且可反映中药的质量,目前已成为中药质量评价和控制研究的有效手段,与多组分含量测定相结合的方法和模式已成为中药质量评价与控制的主要发展方向[10-13]。中国药典(2015年版一部)未收载黄芫花,也未列出芫花特征图谱标准。本研究采用HPLC-UV法建立芫花和黄芫花的特征图谱,可用于两者的鉴别;应用LC-MS/MS方法同时测定不同产地的11批芫花与16批黄芫花中的13种黄酮和3种酚酸类成分的含量,比较芫花与黄芫花化学成分和含量的差异,以期为芫花和黄芫花药材的质量控制提供技术支持,进而为临床应用提供科学依据[14-16]。
1 仪器与试药 1.1 仪器DIONEX UltiMate 3000高效液相色谱仪;Agilent 1200高效液相色谱仪,配有在线脱气机、四元泵、自动进样器(Agilent公司);3200QTRAPTM三重四极杆线性离子阱质谱仪,配有ESI离子源(美国AB公司);Analyst 1.5.2 software数据系统(AB公司);SCQ-200超声波清洗器(100 W,25 kHz;上海声谱超声波设备厂);BP211D型十万分之一电子天平(Sartorius公司)。HPLC色谱柱:Diamonsil C18柱(十八烷基硅烷键合硅胶,4.6 mm×250 mm,5 μm;北京迪马科技有限公司);HPLC-MS色谱柱:Agilent Zorbax SB C18柱(十八烷基硅烷键合硅胶,150 mm×4.6 mm,5 μm;Agilent公司)。
1.2 试药对照品:原儿茶酸(批号15011309)、咖啡酸(批号15062510)、牡荆素(批号16012213)、异牡荆素(批号15081627)、木犀草苷(批号15091317)、槲皮苷(批号15052816)均购自上海士峰生物科技有限公司;芹菜素(批号101129)、柚皮素(批号FY11290618)、木犀草素(批号101127)均购自上海融禾医药科技有限公司;芫花素(批号121638)购自北京白灵威科技有限公司;山柰酚(批号100861-200405)、槲皮素(批号100080-200707)、芦丁(批号100080-200707)均购自中国食品药品检定研究院;羟基芫花素(批号201507092)购自上海展舒化学科技有限公司;绿原酸(批号20121117)购自上海源叶生物科技有限公司;橙皮苷(批号FY11290618)购自南通飞宇生物有限公司。所有对照品的纯度均大于98%。
甲醇、乙腈为色谱纯(J.T. Baker公司);水为纯净水(杭州娃哈哈集团有限公司);甲酸为色谱纯(Dikma公司);乙醇为分析纯(国药集团化学试剂有限公司)。
不同产地芫花和黄芫花样品来源见表 1,所有药材由河北省邯郸市药品检验所
|
|
表 1 黄芫花与芫花药材样品来源 Table 1 Sources of Flos Wikstroemiae Chamaedaphnis and Flos Genkwa |
色谱柱:Diamonsil C18(4.6 mm× 250 mm,5 μm);流动相:乙腈(A)-0.1%甲酸水(B),梯度洗脱(0~10 min,20%A→25%A;10~11 min,25%A→40%A;11~32 min,40%A→60%A,32~34 min,60%A);流速:0.7 mL·min-1;检测波长:350 nm;柱温:30 ℃;进样量:20 μL。
2.1.2 混合对照品溶液的制备取木犀草素、芹菜素、羟基芫花素和芫花素的对照品适量,加甲醇配成一定浓度的混合对照品溶液,作为芫花特征图谱的对照品溶液。取木犀草苷、木犀草素的对照品适量,加甲醇配成一定浓度的混合对照品溶液,作为黄芫花特征图谱的对照品溶液。
2.1.3 供试品溶液的制备取药材粉末(过3号筛)约1 g,置具塞锥形瓶中,精密加入70%乙醇25 mL,密塞,摇匀,超声(100 W,25 kHz)30 min,过滤。摇匀,0.22 μm微孔滤膜滤过,收集续滤液,作为供试品溶液。
2.1.4 精密度考察取同一批号(YH-SX-001)芫花供试品溶液和同一批号(HYH-HB-002)黄芫花供试品溶液,分别按“2.1.1”项下色谱条件连续进样测定6次,记录色谱图。芫花以峰4(芹菜素)为参照峰,计算各特征峰相对保留时间的RSD范围为0.05%~0.20%,相对峰面积的RSD范围为2.3%~3.8%。黄芫花以峰1(木犀草苷)为参照峰,计算各特征峰相对保留时间的RSD范围为0.06%~0.17%,相对峰面积的RSD范围为1.75%~2.63%。结果表明,该方法的精密度良好。
2.1.5 稳定性考察取同一批号(YH-SX-001)芫花供试品溶液和同一批号(HYH-HB-002)黄芫花供试品溶液,分别按“2.1.1”项下色谱条件于0、2、4、8、12和24 h进样。芫花以峰4(芹菜素)为参照峰,计算各特征峰相对保留时间的RSD范围为0.08%~0.31%,相对峰面积的RSD范围为2.9%~4.0%。黄芫花以峰1(木犀草苷)为参照峰,计算各特征峰相对保留时间的RSD范围为0.09%~0.56%,相对峰面积的RSD范围为2.3%~2.5%。结果表明,供试品溶液在24 h内稳定性良好。
2.1.6 重复性考察取同一批号(YH-SX-001)芫花药材和同一批号(HYH-HB-002)黄芫花药材各6份,分别按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进样测定,记录色谱图。芫花以峰4(芹菜素)为参照峰,计算各特征峰相对保留时间的RSD范围为0.07%~0.24%,相对峰面积的RSD范围为0.64%~3.3%。黄芫花以峰1(木犀草苷)为参照峰,计算各特征峰相对保留时间的RSD范围为0.16%~0.86%,相对峰面积的RSD范围为2.2%~3.9%。结果表明,该方法的重复性良好。
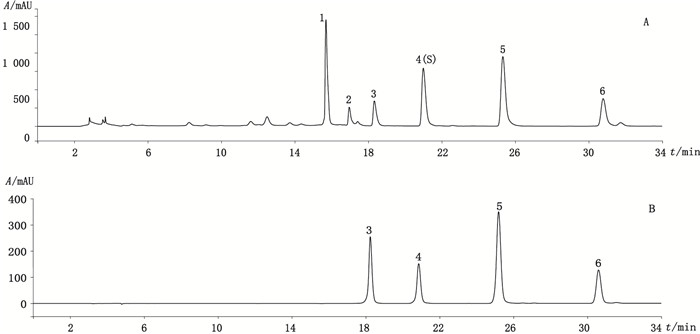
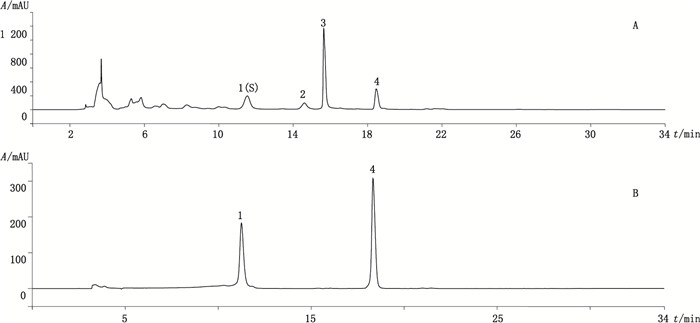
2.1.7 特征图谱的建立取10批芫花和13批黄芫花的供试品溶液,按“2.1.1”项下色谱条件进行测定,记录色谱图。选择不同批次样品共有的且响应较高的峰作为特征指纹峰,最终选择了6个峰作为芫花药材的特征峰,选择了4个峰作为黄芫花药材的特征峰。其中木犀草素峰为芫花和黄芫花特征图谱的共有峰。芫花以峰4(芹菜素)为S峰,计算其余5个峰的相对保留时间,其相对保留时间应在规定值的±5%之内[17],规定值为0.74(峰1)、0.80(峰2)、0.87(峰3)、1.20(峰5)、1.46(峰6);黄芫花以峰1(木犀草苷)为S峰,计算峰2~4的相对保留时间,其相对保留时间应在规定值的±5%之内,规定值为1.27(峰2)、1.35(峰3)、1.60(峰4)。
2.1.8 特征图谱测定结果对10批芫花进行特征图谱测定,相对保留时间和相对峰面积测定结果见表 2。13批黄芫花特征图谱的相对保留时间和相对峰面积测定结果见表 3。特征峰相对保留时间未见明显偏差,均符合规定限度。芫花的特征图谱和对照品溶液的色谱图见图 1,黄芫花的特征图谱和对照品溶液的色谱图见图 2。
|
|
表 2 10批芫花样品特征图谱测定结果 Table 2 The determination results of characteristic peaks for 10 batches of Flos Genkwa |
|
|
表 3 13批黄芫花样品特征图谱测定结果 Table 3 The determination results of characteristic peaks for 13 batches of Flos Wikstroemiae Chamaedaphnis |
|
3.木犀草素(luteolin)4.芹菜素(apigenin)5.羟基芫花素(hydroxygenkwanin)6.芫花素(genkwanin) HPLC characteristic chromatogram of Flos Genkwa (A) and chromatogram of reference substances (B) 图 1 芫花HPLC特征图谱(A)和对照品色谱图(B) |
|
1.木犀草苷(luteoloside)4.木犀草素(luteolin) 图 2 黄芫花HPLC特征图谱(A)和对照品色谱图(B) Figure 2 HPLC characteristic chromatogram of Flos Wikstroemiae Chamaedaphnis (A) and chromatogram of reference substances (B) |
色谱柱:Agilent C18柱(150 mm×4.6 mm,5 μm);流动相:甲醇(A)-0.1%甲酸水(B),梯度洗脱(0~7 min,30%A→70%A;7~13 min,70%A→90%A;13~15 min,90%A);流速:0.8 mL·min-1;柱温:30 ℃;进样量:10 μL。
离子源:电喷雾离子化源(ESI-);采用多反应离子监测(MRM)进行定量分析;检测模式:负离子模式;源喷射电压(IS):-4.5 kV;雾化温度:650 ℃;雾化气(GS1,N2)压力:414 kPa;辅助气(GS2,N2)压力:448 kPa;气帘气(N2)压力:207 kPa。接口加热,全程通入氮气,MRM模式定量。
2.2.2 混合对照品溶液的制备分别精密称取原儿茶酸、咖啡酸、芹菜素、柚皮素、芫花素、木犀草素、山柰酚、羟基芫花素、槲皮素、绿原酸、牡荆素、异牡荆素、木犀草苷、槲皮苷、芦丁和橙皮苷共16种对照品适量,加甲醇溶解并配制成一定浓度的储备液。分别精密吸取上述储备液适量,用甲醇配制成混合对照品溶液;其中各对照品浓度分别为原儿茶酸9.00 μg·mL-1,咖啡酸11.90 μg·mL-1,芹菜素10.80 μg·mL-1,柚皮素0.63 μg·mL-1,芫花素3.1 μg·mL-1,木犀草素57.00 μg·mL-1,山柰酚4.50 μg·mL-1,羟基芫花素1.15 μg·mL-1,槲皮素9.44 μg·mL-1,绿原酸118.80 μg·mL-1,牡荆素11.40 μg·mL-1,异牡荆素14.85 μg·mL-1,木犀草苷47.00 μg·mL-1,槲皮苷0.65 μg·mL-1,芦丁1.92 μg·mL-1,橙皮苷0.68 μg·mL-1。
2.2.3 供试品溶液的制备将16批芫花与11批黄芫花药材粉碎,过50目筛,备用。取药材粉末约1.0 g,精密称定,置50 mL具塞锥形瓶中,精密加入70%乙醇30 mL,超声提取30 min;取出,放冷,用70%乙醇补足减失的量,振摇,混匀,静置;用0.22 μm微孔滤膜过滤,取续滤液即得。
2.2.4 线性关系、定量限和检测限精密量取“2.2.2”项下混合对照品溶液适量,采用倍数稀释法,用甲醇分别逐级稀释得到不同浓度梯度的系列标准溶液,按“2.2.1”项下色谱条件进行分析,记录峰面积。以浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,并进行线性回归,得回归方程。将混合对照品溶液逐步稀释并进行测定,分别以信噪比S/N=10和S/N=3时各对照品的浓度作为定量限(LOQ)和检测限(LOD)。实验结果表明16种待测组分线性关系良好,r≥0.997 6。各被测组分回归方程、线性范围、定量限及检测限见表 4。
|
|
表 4 16种成分的质谱数据、回归方程、相关系数、线性范围、定量限和检测限 Table 4 HPLC-ESI-MSn data, regression equations, correlation coefficients, linear ranges, LODs and LOQs of the sixteen components |
仪器精密度:精密吸取“2.2.2”项下混合对照品溶液10 μL,按“2.2.1”项下色谱条件连续进样6次,测定各组分峰面积,RSD均小于2.63%。
日内精密度:取同一批(HYH-SX-001)样品粉末6份,精密称定,按“2.2.3”项下方法平行制备供试品溶液,在“2.2.1”项色谱条件下测定16种成分含量,RSD均小于3.4%。
日间精密度:按日内精密度的测定方法连续测定3 d,RSD均小于4.4%。
实验结果表明本法精密度良好。
2.2.6 稳定性精密吸取同一批(HYH-SX-001)样品的供试品溶液10 μL,按“2.2.1”项下色谱条件,分别于0、4、8、12、24 h进样测定,测定各被测组分峰面积。实验结果显示,原儿茶酸、咖啡酸、芹菜素、柚皮素、芫花素、木犀草素、山柰酚、羟基芫花素、槲皮素、绿原酸、牡荆素、异牡荆素、木犀草苷、槲皮苷、芦丁、橙皮苷峰面积的RSD分别为3.4%、2.2%、1.2%、1.5%、2.1%、2.6%、3.2%、4.2%、3.2%、2.0%、3.7%、4.1%、2.8%、1.5%、2.4%、3.4%,均小于4.2%,表明供试品溶液在室温下放置24 h稳定性良好。
2.2.7 加样回收率精密称取同一批(HYH-SX-001)样品粉末9份,每份约0.5 g,分别加入低、中、高3种浓度的混合对照品溶液,每个浓度按“2.2.3”项下方法平行制备供试溶液3份,在“2.2.1”项色谱条件下测定被测成分的量并计算其回收率。平均加样回收率为94.2%~103.8%,RSD为0.96%~4.5%,表明该方法准确、可靠。
2.2.8 样品测定结果取11批芫花与16批黄芫花样品,按照“2.2.3”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进样测定,采用标准曲线法计算样品中13种黄酮和3种酚酸的含量。结果见表 5。所测16种成分中,芫花中没有检测出橙皮苷,其余成分在2种药材中均含有,但除木犀草素和山柰酚外,其余成分含量差异较大。利用SPSS中的非参数秩和检验,发现2种药材中有13个成分有显著性差异(P < 0.05);除橙皮苷外,差异最大的是羟基芫花素,两者含量相差468倍,芫花素次之,为288倍,其次是异牡荆素、木犀草苷、槲皮素、柚皮素、芹菜素、牡荆素、槲皮苷、原儿茶酸、绿原酸和咖啡酸。
|
|
表 5 16种化学成分在样品中的含量(μg·g-1) Table 5 Contents of the 16 chemical components in samples |
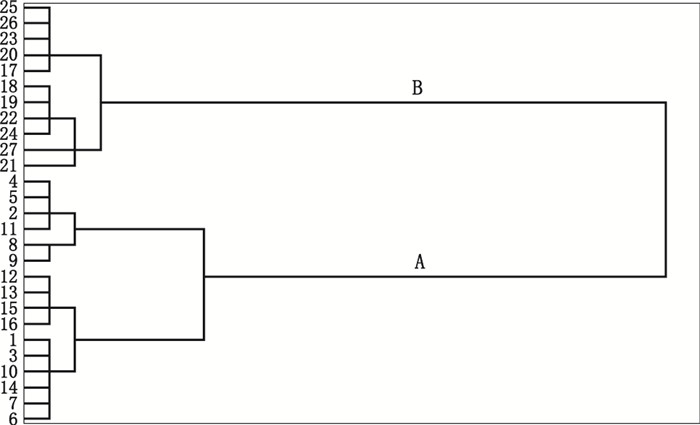
为了直观地区分黄芫花及芫花,本研究利用聚类分析中的组间平均距离,采用SPSS中的Hierarchical Cluster过程,基于测定的16种成分,对27批药材进行聚类分析。聚类分析结果见图 3。27批药材被分为2类,黄芫花(样品1~16)为A类,芫花(样品17~27)为B类。由此可见,聚类分析能将芫花和黄芫花准确地区分[18]。
|
图 3 组间连接法对27批黄芫花(A)与芫花(B)样品的聚类分析 Figure 3 Clustering analysis of 27 batches of Flos Wikstroemiae Chamaedaphnis (A)and Flos Genkwa(B) using the "average linkage between groups" method |
取同一批(HYH-SX-001)药材,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进样测定,分别考察0.7、0.8和0.9 mL·min-1 3种流速。结果表明,在0.7 mL·min-1的流速下样品中共有峰的分离度较好。
3.1.2 不同流动相pH考察取同一批(HYH-SX-001)药材,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进样测定,分别考察乙腈-0.05%甲酸水、乙腈-0.1%甲酸水、乙腈-0.2%甲酸水3种不同的流动相。结果表明,分别采用3种流动相,样品中共有峰分离效果均良好,出于对色谱柱的保护,选择乙腈-0.1%甲酸水作为流动相。
3.2 含量测定提取条件的优化提取溶剂的考察:分别以50%甲醇、70%甲醇、100%甲醇以及50%乙醇、70%乙醇和无水乙醇为提取媒介,制备供试品溶液,结果表明70%乙醇提取效率良好。
提取时间的考察:考察了提取时间为20、30、45和60 min对待测成分的提取效果,结果表明超声提取30 min时提取效率最高,故选择超声提取30 min。
3.3 含量测定液相色谱条件的优化试验中考察了不同种类流动相(甲醇-水,乙腈-水)及不同型号的色谱柱[Diamonsil C18(150 mm×4.6 mm,5 μm)、Agilent Zorbax SB C18(150 mm×4.6 mm,5 μm)和Sapphire C18(150 mm×4.6 mm,5 μm)]。同时分别考察了电解质(如甲酸、乙酸等)对测定结果的影响。结果表明“2.2.1”项下的液相色谱条件效果最佳。
试验中发现含原酸的样品和对照品溶液均出现2个色谱峰,与文献[19]报道一致,由于化学结构中有双键,存在着顺反异构,当在紫外灯或空气中放置较长时间,顺反异构体彼此相互转化,最终达到一定的平衡。因此,绿原酸的峰面积应该是2个色谱峰面积的和。
4 小结本研究建立的特征图谱可鉴别区分芫花和黄芫花药材,通过特征图谱整体图形、共有特征峰、相对保留时间等参数,可对药材进行定性鉴定,有利于全面控制药材品质[20]。此外,HPLC-MS法同时测定不同产地的11批芫花与16批黄芫花中的13种黄酮和3种酚酸类成分的含量,并通过聚类分析看出不同来源的芫花和黄芫花的所含成分基本相同,但各成分含量差异较大。特征图谱和含量测定方法的建立为全面控制芫花和黄芫花的质量提供了科学依据[21]。
| [1] |
中国药典2015年版. 一部[S]. 2015: 159 ChP 2015. Vol Ⅰ[S]. 2015: 159 |
| [2] |
李慧博, 徐丽霞, 刘来正, 等. 黄芫花药材标准修订的基础研究[J]. 山西中医学院学报, 2013, 14(4): 67. LI HB, XU LX, LIU LZ, et al. Basic study on revision of medical material quality of standard of Wikstroemiae Chamaedaphnis Flos[J]. J Shanxi Univ Tradit Chin Med, 2013, 14(4): 67. |
| [3] |
中国药典1977年版. 一部[S]. 1977: 514 ChP 1977. Vol Ⅰ[S]. 1977: 514 |
| [4] |
孙倩, 武洁, 李菲菲, 等. 芫花化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2014, 31(2): 94. SUN Q, WU J, LI FF, et al. Isolation and identification of chemical constituents from Daphne genkwa Sieb.et Zucc[J]. J Shenyang Pharm Univ, 2014, 31(2): 94. |
| [5] |
郭洁如. 两种荛花属药用植物化学成分和生物活性研究[D]. 武汉: 华中科技大学, 2012 GUO JR. Study on the Chemical Constituents and Biological Activities of Two Wikstroemia Medicinal Plants[D]. Wuhan: Huazhong University of Science and Technology, 2012 http://www.docin.com/p-850015367.html |
| [6] |
邵泽艳, 赵娜夏, 夏广萍, 等. 芫花醋酸乙酯部位的化学成分研究[J]. 现代药物与临床, 2013, 44(4): 397. SHAO ZY, ZHAO NX, XIA GP, et al. Chemical constituents in ethyl acetate fraction from Daphne genkwa[J]. Drugs Clin, 2013, 44(4): 397. |
| [7] |
羡冀, 徐扬, 罗显峰, 等. 芫花花蕾中甾醇类化合物的分离与鉴定[J]. 沈阳药科大学学报, 2014, 31(5): 347. XIAN J, XU Y, LUO XF, et al. Isolation and identification of the sterols from the flower buds of Daphne genkwa Sieb.et Zucc[J]. J Shenyang Pharm Univ, 2014, 31(5): 347. |
| [8] |
康少文, 于永芳, 魏清波, 等. 黄芫花中期引产有效成分的研究[J]. 中草药, 1984, 1(4): 5. KANG SW, YU YF, WEI QB, et al. Study on the effective components on Wikstroemia chamaedaphne in induction of labor in second trimester[J]. China Tradit Herb Drugs, 1984, 1(4): 5. |
| [9] |
ZHAN ZJ, FAN CQ, DING J, et al. Novel diterpenoids with potent inhibitory activity against endothelium cell HMEC and cytotoxic activities from awell-known TCM plant Daphne genkwa[J]. Bioorgan Med Chem, 2005, 13(1): 645. |
| [10] |
罗云, 郝伟伟, 王洁, 等. 高效液相色谱法测定六味地黄浓缩丸特征图谱及4种主要成分的含量[J]. 中国医院药学杂志, 2012, 32(10): 748. LUO Y, HAO WW, WANG J, et al. Simultaneous determination of specific chromatogram and four main components of Liuwei Dihuang concentrated pills by HPLC[J]. Chin Hosp Pharm J, 2012, 32(10): 748. |
| [11] |
SHU ZH, LI XQ, RAHMAN K, et al. Chemical fingerprint and quantitative analysis for the quality evaluation of Vitex negundo seeds by reversed-phase high-performance liquid chromatography coupled with hierarchical clustering analysis[J]. J Sep Sci, 2016, 39: 279. DOI:10.1002/jssc.v39.2 |
| [12] |
LI YR, YANG K, SHI QY, et al. Development of a method using high-performance liquid chromatographic fingerprint and multi-ingredients quantitative analysis for the quality control of Yangxinshi tablets[J]. J Sep Sci, 2015, 38: 2989. DOI:10.1002/jssc.v38.17 |
| [13] |
胡晓茹, 杨思广, 戴忠, 等. 葛根芩连片特征图谱及含量测定方法研究[J]. 药物分析杂志, 2014, 34(9): 1590. HU XR, YANG SG, DAI Z, et al. Study on characteristic fingerprints and quantitative analysis of Gegen Qinlian tablets[J]. Chin J Pharm Anal, 2014, 34(9): 1590. |
| [14] |
车晓彦, 伍丕娥, 周娟, 等. 麦冬药材TLC及HPLC特征图谱研究[J]. 药物分析杂志, 2012, 32(12): 2262. CHE XY, WU PE, ZHOU J, et al. Studies on TLC and HPLC characteristic chromatograms of Ophiopogonis Radix[J]. Chin J Pharm Anal, 2012, 32(12): 2262. |
| [15] |
王二兵. 祖师麻药材HPLC特征图谱[J]. 化工时刊, 2014, 28(11): 1. WANG EB. Characteristic spectrum of Zushima by HPLC[J]. Chem Ind Times, 2014, 28(11): 1. DOI:10.3969/j.issn.1002-154X.2014.11.001 |
| [16] |
许玲玲, 安睿, 王新宏, 等. 液质联用技术在中药分析中的应用[J]. 中成药, 2006, 28(2): 239. XU LL, AN R, WANG XH, et al. The applicaiton of liqud chromatography coupled with high resolution mass spectrometry techonlogy on analysis of Chinese herbs[J]. Chin Tradit Pat Med, 2006, 28(2): 239. |
| [17] |
颜美秋, 陈素红, 吕圭源, 等. 铁皮石斛HPLC特征图谱研究[J]. 中国中药杂志, 2013, 38(4): 516. YAN MQ, CHEN SH, LÜ GY, et al. HPLC specific chromatogram of Dendrobium officinale[J]. China J Chin Mater Med, 2013, 38(4): 516. |
| [18] |
马培, 许利嘉, 刘延泽, 等. 虎杖药材UPLC特征图谱研究[J]. 中国实验方剂学杂志, 2012, 18(2): 72. MA P, XU LJ, LIU YZ, et al. Studies on the UPLC fingerprint and quality evaluation of crude drug of Polygonum cuspidatum[J]. Chin J Exp Tradit Med Form, 2012, 18(2): 72. |
| [19] |
CLIFFORD MN, KIRKPATRICK J, KUHNERT N, et al. LC-MSn analysis of the cisisomers of chlorogenic acids[J]. Food Chem, 2008, 106: 479. |
| [20] |
陈志辉, 罗明, 魏刚, 等. 不同产地金钗石斛HPLC特征图谱的比较[J]. 广东药学院学报, 2014, 30(6): 1. CHEN ZH, LUO M, WEI G, et al. Comparative study on the HPLC characteristic spectrum of Dendrobium nobile Lindl.from different regions[J]. J Guangdong Pharm Univ, 2014, 30(6): 1. |
| [21] |
QIAO CF, HAN QB, SONG JZ, et al. Chemical fingerprint and quantitative analysis of Fructus Psoraleae by high-performance liquid chromatography[J]. J Sep Sci, 2007, 30: 813. DOI:10.1002/(ISSN)1615-9314 |
 2018, Vol. 38
2018, Vol. 38 
