2. 漳州卫生职业学院, 漳州 363000
2. Zhangzhou Health Vocational College, Zhangzhou, 363000, China
细梗香草(Lysimachia capillipes Hemsl.)为报春花科珍珠菜属植物细梗香草的干燥全草,具有祛风除湿、行气止痛、解毒之功效,民间主治感冒咳嗽、风湿痹痛、脘腹胀痛等[1]。近年来,国内外学者主要对细梗香草的活性成分进行研究,根据文献报道,细梗香草主要含有皂苷和黄酮类成分,其中细梗香草皂苷B和C为主要的皂苷类成分,含量占总皂苷的70%以上[2-4]。研究表明这2个皂苷具有显著的抗肿瘤作用,对非小细胞肺癌H460、乳腺癌MCF-7、卵巢癌SK-OV-3等肿瘤细胞株显示较强的抑制作用[5-9]。本课题组在前期大量研究的基础上,对细梗香草的化学成分进行分离纯化,得到了细梗香草皂苷B和C单体,为细梗香草药材的质量检测提供了对照品。细梗香草主要分布于福建、浙江、江西等地,以福建龙岩地区品质为上乘,为福建省特色药材之一,近年来在福建龙岩各地开展规范化种植研究,目前龙岩地区细梗香草种植规模已达2 000多亩,选育了3个优良品种。但龙岩不同地区和不同采收期细梗香草中皂苷类成分含量有所差异,选择合适的采收地区及采收期,是控制细梗香草药材质量的前提条件。龙岩地处福建省西部,地势东高西低,北高南低,不同地势其郁闭度、坡向、坡位等都会影响细梗香草活性成分的含量。基于此,本文采用HPLC-ELSD法,对龙岩不同地区和不同采收期的细梗香草中细梗香草皂苷B和C进行含量测定,为确定细梗香草适宜的生长环境和合理的采收季节提供科学依据。
1 仪器与试药 1.1 仪器ADVENTURER电子分析天平(万分之一),METTLER TOLEDO电子分析天平(十万分之一),Milli-Q超纯水机,Agilent -1260高效液相色谱仪(美国安捷伦科技有限公司),Alltech ELSD-3300ES蒸发光散射检测器(美国奥泰公司)。慧德易SP ODS-AQ C18分析柱(十八烷基硅烷键合硅胶,250 mm×4.6 mm,5 μm;北京慧德易公司)。
1.2 试药对照品细梗香草皂苷B(C58H96O24,批号20150318,自制,纯度99.72%);细梗香草皂苷C(C57H94O24,批号20150318,自制,纯度98.97%)。乙腈(美国Sigma)为色谱纯,其他试剂为分析纯。
细梗香草药材来源于福建省龙岩,经福建中医药大学中药鉴定室车苏容老师鉴定为报春花科珍珠菜属植物细梗香草(Lysimachia capillipes Hemsl.)。
2 方法与结果 2.1 色谱条件色谱柱:慧德易SP ODS-AQ C18分析柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.3%醋酸水(47:53);流速:1.0 mL·min-1;柱温40 ℃;进样体积:20 μL。
ELSD参数:漂移管温度90 ℃;载气流速1.0 L·min-1,增益值:4。
2.2 对照品溶液的制备 2.2.1 对照品储备液分别精密称取细梗香草皂苷B和C的对照品适量,置10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得单个对照品储备液(细梗香草皂苷B和C质量浓度分别为1.014 mg·mL-1、1.047 mg·mL-1)。再分别精密吸取细梗香草皂苷B和C对照品储备液5 mL和3 mL,置10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得混合对照品储备液。
2.2.2 混合对照品溶液精密吸取混合对照品储备液1 mL置10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得混合对照品溶液。
2.3 供试品溶液的制备精密称取细梗香草粉末(过3号筛)1.0 g,置250 mL圆底烧瓶中,加入70%乙醇水加热回流提取3次,每次50 mL,每次1 h,合并提取液浓缩,蒸干,残渣加甲醇溶解,移至100 mL量瓶中,稀释至刻度,摇匀,再精密吸取5 mL,置25 mL量瓶中,加甲醇稀释至刻度,摇匀,滤过,滤液作为供试品溶液。
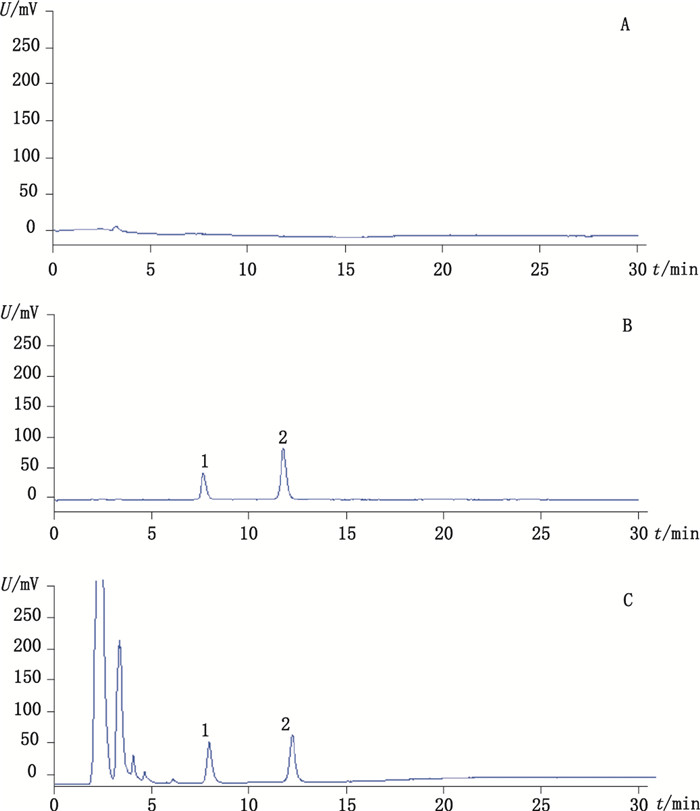
2.4 系统适用性试验取空白溶剂、混合对照品溶液、供试品溶液,按“2.1”项下色谱条件,进样20 μL,记录色谱图,见图 1。结果表明,在该色谱条件下,理论塔板数按细梗香草皂苷C计算不低于5 000,细梗香草皂苷B与细梗香草皂苷C分离度大于1.5,其测定不受其他组分干扰。
|
1.细梗香草皂苷C(capilliposide C)2.细梗香草皂苷B(capilliposide B) 图 1 空白溶剂(A)、混合对照品(B)及供试品(C)HPLC色谱图 Figure 1 HPLC chromatograms of blank solvent(A), mixed reference substances (B) and sample(C) |
将混合对照品溶液逐步稀释后进样测定,以色谱图中信噪比S/N≈3时的进样量为检测下限,S/N≈10时的进样量为定量下限。结果表明,细梗香草皂苷B和C的检测下限分别为0.101 1、0.074 58 μg,定量下限分别为0.202 2、0.248 6 μg。
2.6 线性关系的考察精密吸取“2.2.1”项下的混合对照品储备液(细梗香草皂苷B和C质量浓度分别为0.507 mg·mL-1和0.3141 mg·mL-1)适量,用甲醇依次稀释成系列浓度的混合对照品溶液,按“2.1”项下色谱条件进样,记录色谱峰面积。以峰面积的对数值(lgA)为纵坐标(Y),以进样量的对数值(lgm)为横坐标(X)进行线性回归,结果细梗香草皂苷B和C的回归方程分别为:
Y=1.427 22X+1.798 70 r=0.999 7
Y=1.457 50X+1.739 84 r=0.999 7
细梗香草皂苷B和C的进样量分别在0.20~ 10.08μg和0.24~6.10 μg范围内线性关系良好。
2.7 精密度试验取“2.2.2”项下混合对照品溶液,按“2.1”项下色谱条件,连续进样6次,记录色谱峰面积,计算细梗香草皂苷B和C峰面积的RSD分别为2.3%、1.9%。由结果可知,仪器的精密度良好。
2.8 重复性试验取同一批细梗香草药材(批号20150728),按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样,计算细梗香草皂苷B和C含量的平均值(n=6)分别为2.29%、2.03%,RSD分别为0.98%、2.0%。由结果可知,该方法的重复性良好。
2.9 稳定性试验取同一供试品溶液,按“2.1”下色谱条件,分别于0、2、4、6、8、10、12、24 h进样测定,计算细梗香草皂苷B和C峰面积的RSD(n=8)分别为1.4%、2.7%。由结果可知,该供试品溶液中细梗香草皂苷B和C在24 h内稳定。
2.10 加样回收率试验精密称取已知含量的细梗香草药材(批号20150728,细梗香草皂苷B和C分别为2.31%和2.09%)约0.5 g,9份,3份为1组,按80%、100%、120% 3个水平分别精密加入混合对照品溶液,按“2.3”项下方法制备高、中、低3个浓度的溶液,按“2.1”项下色谱条件下进样测定,计算平均回收率和RSD。结果见表 1。细梗香草皂苷B和C的平均回收率(n=9)分别为96.1%、96.7%。
|
|
表 1 细梗香草皂苷B和细梗香草皂苷C的加样回收率实验结果(n=9) Table 1 Recoveries of capiiliposide B and capiiliposide C |
分别精密称取龙岩不同地区不同采收期样品约1.0 g,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,结果见表 2。
|
|
表 2 不同地区不同采收期样品含量测定结果(n=3) Table 2 Determination result of the sample in different collecting times |
由表 2可见,龙岩5个产区的细梗香草总皂苷均呈现相同的变化趋势,先增大后减小,再增大后减小的变化趋势,其中7月份采收的细梗香草药材的皂苷含量均较高。为了分析5个产地细梗香草总皂苷含量差异,挑选含量最高的7月份做显著性分析,结果见表 3。
|
|
表 3 不同产地细梗香草总皂苷显著性分析(n=3) Table 3 The significance analysis of the total saponins of Lysimachia capillipes from different habitats |
由表 3可知,长汀的总皂苷含量最高,显著高于其他地区(p < 0.05),武平、长汀与新罗、连城、永定之间存在显著性差异(p < 0.05),武平与长汀之间存在显著性差异(p < 0.05),新罗、连城、永定之间不存在显著性差异。
3 讨论 3.1 检测器的选择实验前期,采用紫外-可见分光光度仪进行全波长扫描,紫外吸收很弱,且存在末端吸收,经过香草醛-冰醋酸-高氯酸法显色后进行测定,样品存在其他成分干扰问题,不能准确测定。蒸发光散射检测器(ELSD)是通用型检测器,广泛应用于无紫外吸收或紫外吸收弱的物质,本文采用蒸发光散射检测器,基线平稳,干扰物质少,能简便、准确地测定细梗香草中细梗香草皂苷B、C的含量。
3.2 色谱条件的优化参考相关文献,在应弘梅等[10]研究的色谱条件下,细梗香草皂苷B、C的色谱峰保留时间均在15 min之后,不利于大批量样品的快速分析。本文通过对不同比例的甲醇-水、乙腈-水及乙腈-0.3%醋酸水溶液等流动相进行比较,采用乙腈-0.3%醋酸水溶液(47:53)作为流动相时,分离效果良好,不存在拖尾现象,且细梗香草皂苷B、C的色谱峰出峰时间明显缩短,有利于大批量样品的快速、准确测定,故选择乙腈-0.3%醋酸水溶液(47:53)作为流动相。
3.3 ELSD参数的优化本文在查阅相关文献[10, 13-15]的基础上,对漂移管温度和载气流速进行优化,选择漂移管温度为90 ℃,载气流速为1.0 L·min-1时,能够改善色谱峰峰形,同时分离度良好,且不受杂质干扰。
3.4 提取溶剂的确定预试验选择了水及30%、50%、70%、80%、95%乙醇水作为提取溶剂。结果表明,70%乙醇水进行加热回流提取,2个皂苷类化合物的含量均达最大,因此,选择70%乙醇水作为最佳提取溶剂。
3.5 小结细梗香草为一年生植物,花期为6~7月份,果期为8~10月份[1]。目前,关于细梗香草药材的采收期未见相关报道,本课题组采集了规范化种植基地龙岩不同县不同时期的细梗香草药材,并以皂苷含量为指标进行考察,在取样地点上更规范化。结果表明,龙岩不同县不同采收期细梗香草药材中皂苷含量差别较大,其含量一年内经历2次明显的上升和下降过程,整体变化趋势基本一致。6月份至7月份为细梗香草的开花时期,皂苷含量迅速增加,于7月份达到了最大值;8月份至9月份,进入种子形成期,皂苷含量急剧降低;10月份,种子开始成熟,皂苷含量缓慢增加并累积,到11月份含量再次达到最大值,之后植物开始枯萎,皂苷含量缓慢降低。龙岩不同地区皂苷含量差别也较大,以推广基地龙岩长汀的总皂苷含量最高,这可能跟其生态环境有关,具体因素有待进一步研究。因此,龙岩作为细梗香草规范化种植产地,适宜在7月份和11月份进行药材采收工作。
| [1] |
国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999, 5356. State Administration of Traditional "Chinese Materia Medica" Editorial. Chinese Materia Medica[M]. Shanghai: Shanghai Science and Technology Publishers, 1999, 5356. |
| [2] |
田景奎. 珍珠菜属两种药用植物化学成分的研究[D]. 北京: 中国协和医科大学, 2002 TIAN JK. Studies on the Chemical Constituents of Two Medicinal Plants of Lysimachia Genus[D]. Beijing: Peking Union Medical College, 2002 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y460613 |
| [3] |
田景奎, 邹忠梅, 徐丽珍, 等. 细梗香草化学成分的研究[J]. 中国药学杂志, 2006, 41(3): 171. TIAN JK, ZOU ZM, XU LZ, et al. Studies on chemical constituents of Lysimachia capillipes[J]. Chin Pharm J, 2006, 41(3): 171. |
| [4] |
LIANG B, ZHANG L, TIAN J, et al. Isolation and characterization of two new saponins from Lysimachia capillipes[J]. Carbohydr Res, 2006, 341(14): 2444. DOI:10.1016/j.carres.2006.06.020 |
| [5] |
徐燕, 荣语媚, 刘小保. 细梗香草总皂苷的抗肿瘤活性研究[J]. 中国药理学通报, 2012, 28(4): 545. XU Y, RONG YM, LIU XB. The antitumor activity study of saponins from Lysimachia capillipes[J]. Chin Pharmacol Bull, 2012, 28(4): 545. |
| [6] |
FEI ZH, WU K, CHEN YL, et al. Capilliposide isolated from Lysimachia capillipes Hemsl.induces ROS generation, cell cycle arrest, and apoptosis in human nonsmall cell lung cancer cell lines[J]. Evid Based Complement Alternat Med, 2014(2): 497. |
| [7] |
TIAN JK, XU LZ, ZOU ZM, et al. Three novel triterpenoid saponins from Lysimachia capillipes and their cytotoxic activities[J]. Chem Pharm Bull, 2006, 54(4): 567. DOI:10.1248/cpb.54.567 |
| [8] |
花永虹, 胡巧英, 朴永锋, 等. 细梗香草皂甙对鼻咽癌CNE-2细胞的体外抗瘤作用[J]. 中国肿瘤, 2014, 23(7): 597. HUA YH, HU QY, PIAO YF, et al. The antitumor effect of capilliposide on nasopharyngeal cancer cell line CNE-2 in vitro[J]. China Cancer, 2014, 23(7): 597. DOI:10.11735/j.issn.1004-0242.2014.07.A013 |
| [9] |
程忠哲. 细梗香草两个主要抗肿瘤活性皂苷成分的药代动力学研究[D]. 武汉: 华中科技大学, 2015 CHENG ZZ. The Metabolism and Pharmacokinetics of Capilliposide B and Capilliposide C in Lysimachia capillipes Hemsl. Extract[D]. Wuhan: Huazhong University of Science and Technology, 2015 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D731750 |
| [10] |
应弘梅, 戚中杰, 郭达伟, 等. HPLC-ELSD测定细梗香草皂苷B与皂苷C的含量[J]. 中国药学杂志, 2011, 46(9): 704. YING HM, QI ZJ, GUO DW, et al. Quantitative determination of capiiliposide B and capilliposide C in Lysimachia capillipes by HPLC-ELSD[J]. Chin Pharm J, 2011, 46(9): 704. |
| [11] |
潘馨, 衷林清, 周楚楚, 等. HPLC同时测定草珊瑚中9个有效成分的含量[J]. 药物分析杂志, 2017, 37(7): 1207. PAN X, ZHONG LQ, ZHOU CC, et al. Simultaneous determination of nine effective components in Sarcandra glabra by HPLC[J]. Chin J Pharm Anal, 2017, 37(7): 1207. |
| [12] |
刘丽娜, 查俊, 李勇军, 等. HPLC-ELSD测定吉祥草中皂苷A的含量[J]. 中国实验方剂学杂志, 2012, 18(17): 112. LIU LN, ZHA J, LI YJ, et al. Determination of saponin A in Reineckia carnea by HPLC-ELSD[J]. Chin J Exp Tradit Med Form, 2012, 18(17): 112. DOI:10.3969/j.issn.1005-9903.2012.17.033 |
| [13] |
曹广尚, 杨培民, 王新凤, 等. HPLC测定白花蛇舌草不同采收期及不同部位中异高山黄芩素含量[J]. 中国实验方剂学杂志, 2014, 20(17): 49. CAO GS, YANG PM, WANG XF, et al. Determination of isoscutellarein in different parts of Hedyotidis diffusa in different harvest times by HPLC[J]. Chin J Exp Tradit Med Form, 2014, 20(17): 49. |
| [14] |
黄亮辉, 苏琪, 张新新, 等. 不同采收期的紫苏叶和白苏叶中迷迭香酸的含量测定[J]. 药物分析杂志, 2012, 32(10): 1753. HUANG LH, SU Q, ZHANG XX, et al. Determination of rosmarinic acid in leaf of Perilla frutescens (L.) Britt.var.typica (Makino) Makino and Perilla frutescens (L.) Britt.var.acuta (Thunb.) Kudo at different harvest time points[J]. Chin J Pharm Anal, 2012, 32(10): 1753. |
| [15] |
孟庆艳, 刘圆, 孔星芸, 等. 不同采收期大花罗布麻叶中总黄酮的含量测定[J]. 中国实验方剂学杂志, 2010, 16(15): 50. MENG QY, LIU Y, KONG XY, et al. Determination of flavonoid of Poacyzuan hendersonii leaves from different harvest times[J]. Chin J Exp Tradit Med Form, 2010, 16(15): 50. DOI:10.3969/j.issn.1005-9903.2010.15.014 |
 2018, Vol. 38
2018, Vol. 38 
