2. 贵州省黔南州食品药品检验所, 都匀 558000
2. Qiannan Institute for Food and Drug Control, Duyun 558000, China
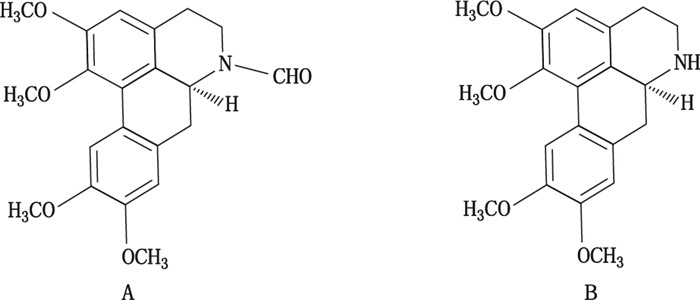
草乌叶是历版中国药典一部收载品种,蒙古族习用药材,毛茛科乌头属北乌头(Aconitum kusnezoffii Reichb.)的干燥叶,具清热、解毒、止痛功能,用于热病发热,泄泻腹痛,头痛、牙痛[1-8]。北乌头分布于山西、河北、内蒙古和东北三省,其块根为草乌,具有祛风除湿、温经止痛的功能[9]。中国药典标准草乌叶项下缺少含量测定等项目,近30年未进行修订。草乌和草乌叶中主要含有生物碱类成分,草乌中含量测定有一些报道[10-15],但草乌叶的含量测定方面报道较少,辛杨等[16]采用HPLC法测定草乌叶中新乌头碱、乌头碱和次乌头碱的含量。现有含量测定报道的测定指标均为二萜类生物碱成分,然而阿朴啡类生物碱N-醛基去甲海罂粟碱和去甲海罂粟碱(结构式见图 1)也是草乌叶主要活性成分之一,该类型生物碱具有抗炎、止痛的作用[17-19]。本文建立高效液相色谱法测定草乌叶中2个阿朴啡类生物碱N-醛基去甲海罂粟碱和去甲海罂粟碱含量,为草乌叶质量标准提高提供科学依据。
|
图 1 N-醛基去甲海罂粟碱(A)与去甲海罂粟碱(B)结构式 Figure 1 The structures of N-formylnorglaucine(A)and norglaucine(B) |
1260型液相色谱仪(安捷伦公司),二极管阵列检测器(安捷伦公司),QUINTIX313-1CN型万分之一电子天平(Sartorius公司),MSE125S型十万分之一电子天平(Sartorius公司),KQ-300DV型超声波清洗器(江苏昆山市超声仪器有限公司),Milli-Q去离子水发生器(密理博公司)。
1.2 试药N-醛基去甲海罂粟碱和去甲海罂粟碱的对照品为本实验室自制,经HPLC-DAD(面积归一化法)检测纯度均大于98.0%。甲醇和乙腈为色谱纯,由Fisher公司提供;醋酸铵、氨水、异丙醇和乙酸乙酯为分析纯,由国药集团化学试剂有限公司提供;水为Milli-Q纯化水。
1.3 样品药材样品均来自实地采集,经中国食品药品检定研究院民族药室郑健研究员鉴定为毛茛科乌头属植物北乌头Aconitum kusnezoffii Reichb.的干燥叶。
2 方法与结果 2.1 色谱条件色谱柱:Waters XBridge C18色谱柱(4.6 mm×250 mm,5 μm),乙腈(A)-40 mmol·L-1醋酸铵水溶液(氨水调pH至10.5)(B)(33:67)为流动相,流速1.0 mL·min-1,检测波长为302 nm,柱温30 ℃,进样量10 μL。
2.2 溶液的制备 2.2.1 混合对照品溶液取N-醛基去甲海罂粟碱对照品9.25 mg和去甲海罂粟碱对照品9.83 mg,置10 mL量瓶中,用甲醇溶解并定稀释至刻度,摇匀,即得单一成分对照品储备液;分别取各对照品储备液1 mL置同一个10 mL量瓶中,加甲醇配制成上述2种成分浓度分别为92.5和98.3 μg·mL-1的混合溶液,即得。
2.2.2 供试品溶液取本品粉末(过四号筛)约2 g,精密称定,置具塞锥形瓶中,加氨试液3 mL,精密加入异丙醇-乙酸乙酯(1:1)混合溶液50 mL,称量,超声处理(功率300 W,频率50 kHz;水温在60 ℃以下)30 min,放冷,再称量,用异丙醇-乙酸乙酯(1:1)混合溶液补足减失的量,摇匀,滤过。精密量取续滤液25 mL,60 ℃以下减压回收溶剂至干,残渣用甲醇溶解至10 mL量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
2.3 方法学验证 2.3.1 线性关系考察精密吸取各对照品储备液0.1、0.2、0.5、1.0、2.0、5.0 mL,分别置6个10 mL量瓶中,加甲醇定容至刻度,摇匀,即得各系列浓度的混标溶液。分别精密吸取各系列浓度混合对照品溶液10 μL,注入液相色谱仪,测定峰面积,以各对照品质量浓度(μg·mL-1)为横坐标,以峰面积为纵坐标,进行线性回归,得到N-醛基去甲海罂粟碱和去甲海罂粟碱的回归方程(n=6):
Y=263.5X+1.86 r=0.999 9
Y=201.5X-0.53 r=0.999 9
结果表明,N-醛基去甲海罂粟碱质量浓度在9.25~462.5 μg·mL-1范围内,去甲海罂粟碱质量浓度在9.83~491.5 μg·mL-1范围内线性关系良好。
2.3.2 精密度和稳定性试验精密吸取“2.2.1”项下混合对照品溶液10 μL,连续进样6次,记录峰面积,计算N-醛基去甲海罂粟碱和去甲海罂粟碱峰面积的RSD(n=6)分别为0.24%和0.18%,表明仪器精密度良好。
2.3.3 稳定性试验取同一份供试品溶液(1号样品),分别于0、2、4、8、12、24 h进样测定,记录峰面积,计算N-醛基去甲海罂粟碱和去甲海罂粟碱峰面积的RSD(n=6)分别为0.72%和0.83%,结果表明供试品溶液在24 h内稳定。
2.3.4 重复性试验取样品(1号样品)粉末6份,分别按照“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,记录峰面积,计算含量。结果样品中N-醛基去甲海罂粟碱和去甲海罂粟碱的平均含量分别为0.177%和0.385%,RSD(n=6)分别为1.4%和1.7%,表明该方法重复性良好。
2.3.5 回收率试验取已知含量草乌叶样品(1号样品)粉末6份,每份约1 g,置具塞锥形瓶中,精密加入各对照品溶液(N-醛基去甲海罂粟碱185.0 μg·mL-1和去甲海罂粟碱393.2 μg·mL-1)各1 mL,分别按照“2.2.2”项下方法制备供试溶液,按“2.1”项下色谱条件测定,记录峰面积,计算回收率,结果见表 1。
|
|
表 1 加样回收率试验结果(n=6) Table 1 Recoveries of the two alkaloids |
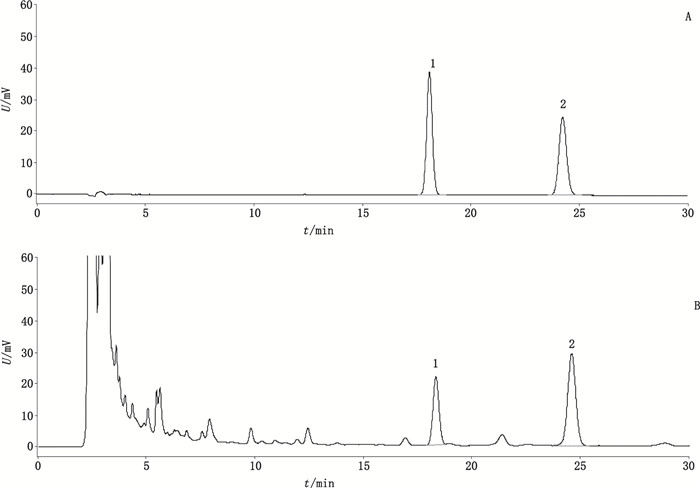
每个样品取2份,分别按“2.2.2”项下方法制备供试品溶液。精密吸取各供试品溶液10 μL,按“2.1”项下色谱条件进行测定,用外标法计算含量,结果见表 2,色谱图见图 2。
|
|
表 2 草乌叶中N-醛基去甲海罂粟碱和去甲海罂粟碱的含量(mg·g-1) Table 2 Contents of N-formylnorglaucine and norglaucine of Aconiti Kusnezoffii Folium |
|
1. N-醛基去甲海罂粟碱(N-formylnorglaucine)2.去甲海罂粟碱(norglaucine) 图 2 混合对照品(A)及草乌叶药材(B)HPLC色谱图 Figure 2 HPLC chromatograms of mixed reference substances (A) and Aconiti Kusnezoffii Folium (B) |
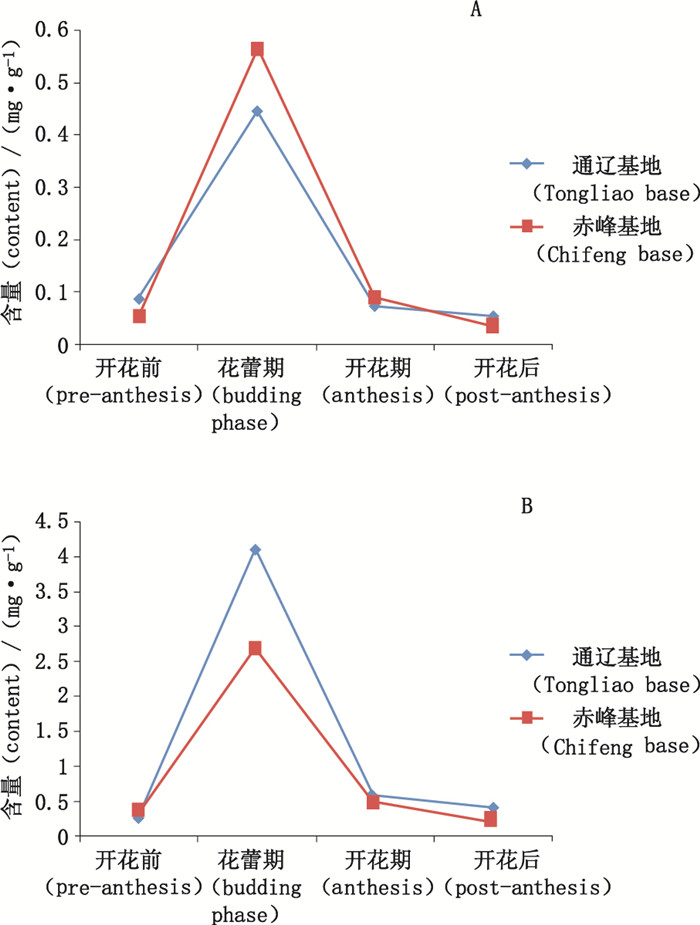
对内蒙古通辽和赤峰草乌叶种植基地药材进行采收期考察,每个基地于开花前、花蕾期、开花期和开花后各采集1批次,含量测定方法同“2.4”项下,结果见表 3。不同采收期2个化合物的含量动态变化见图 3。
|
|
表 3 不同采收期草乌叶中N-醛基去甲海罂粟碱和去甲海罂粟碱的含量(mg·g-1) Table 3 Contents of N-formylnorglaucine and norglaucineof Aconiti Kusnezoffii Folium in different harvest periods |
|
图 3 不同采收期草乌叶中N-醛基去甲海罂粟碱(A)和去甲海罂粟碱(B)的含量动态变化图 Figure 3 Contents of N-formylnorglaucine (A) and norglaucine (B)of Aconiti Kusnezoffii Folium in different harvest periods |
本课题组研究发现,N-醛基去甲海罂粟碱和去甲海罂粟碱是草乌叶药材中含量较高的化学成分,这些化合物均属于阿朴啡类生物碱,并且文献报道,该类化合物具有止痛、抗炎等作用,是草乌叶主要活性成分。因此,本研究选择N-醛基去甲海罂粟碱和去甲海罂粟碱作为测定指标。
3.2 色谱条件的选择N-醛基去甲海罂粟碱和去甲海罂粟碱均为生物碱成分,流动相需要加碱性试剂调节使其为分子状态,防止色谱峰拖尾,色谱柱选择pH适用范围为1~12的Waters XBridge C18柱。本文通过二极管阵列检测器进行全波长扫描(190~400 nm),结果302 nm时2个化学成分均有较大吸收,且杂质成分干扰少,故选择302 nm作为检测波长。流动相优选时分别考察了乙腈-醋酸铵水溶液和乙腈-三乙胺水溶液等流动相系统,最终选择乙腈-40 mmol·L-1醋酸铵水溶液(氨水调pH至10.5)(33:67)为流动相,供试品溶液中2个化学成分分离度好,保留时间合适,故最终确定此流动相。
3.3 含量测定由表 2可见,12批草乌叶中均含有N-醛基去甲海罂粟碱和去甲海罂粟碱,去甲海罂粟碱的含量全部高于N-醛基去甲海罂粟碱的含量,两者含量比值在2~10倍,该比值具有一定的鉴别意义。不同批次之间各成分含量有一定差异,12批药材中N-醛基去甲海罂粟碱含量范围为0.071~0.388 mg·g-1,平均含量为0.197 mg·g-1;去甲海罂粟碱含量范围为0.320~2.49 mg·g-1,平均含量为1.14 mg·g-1。不同采收期的含量测定结果初步表明,采收时间对草乌叶中N-醛基去甲海罂粟碱和去甲海罂粟碱的含量均有显著影响,随着采收期的推迟,2个成分的含量均呈先增后减的趋势,采收过早或过晚都会明显降低各药效成分的含量,花蕾期的草乌叶中N-醛基去甲海罂粟碱和去甲海罂粟碱的含量均为最高,确定最佳采收期为花蕾期,这和中国药典中规定的“夏季叶茂盛花未开时采收”的结果基本一致。表 2中部分批次2个成分含量较低,可能由于采收时未严格掌握采收时间所致。
3.4 小结本试验建立了草乌叶中N-醛基去甲海罂粟碱和去甲海罂粟碱的含量测定方法,为草乌叶的质量控制提供了参考。同时,探讨了草乌叶不同采收期对2个成分含量的影响,初步阐明了中国药典中该药材采收季节的规定的内涵,为研究探讨草乌叶药材的品质,指导其科学采收提供基础研究资料。
| [1] |
中国药典2015年版. 一部[S]. 2015: 237 ChP 2015. Vol Ⅰ[S]. 2015: 237 |
| [2] |
中国药典2010年版. 一部[S]. 2010: 221 ChP 2010. Vol Ⅰ[S]. 2010: 221 |
| [3] |
中国药典2005年版. 一部[S]. 2005: 164 ChP 2005. Vol Ⅰ[S]. 2005: 164 |
| [4] |
中国药典2000年版. 一部[S]. 2000: 190 ChP 2000. Vol Ⅰ[S]. 2000: 190 |
| [5] |
中国药典1995年版. 一部[S]. 1995: 212 ChP 1995. Vol Ⅰ[S]. 1995: 212 |
| [6] |
中国药典1990年版. 一部[S]. 1990: 313 ChP 1990. Vol Ⅰ[S]. 1990: 313 |
| [7] |
中国药典1985年版. 一部[S]. 1985: 206 ChP 1985. Vol Ⅰ[S]. 1985: 206 |
| [8] |
中国药典1977年版. 一部[S]. 1977: 387 ChP 1977. Vol Ⅰ[S]. 1977: 387 |
| [9] |
中国科学院中国植物志编辑委员会. 中国植物志[M]. 第27卷. 北京: 科学出版, 1979, 269. Editorial Committee of Flora of China. Flora of China[M]. Vol 27. Beijing: Science Press, 1979, 269. |
| [10] |
乌力吉特古斯, 白学良, 阿拉坦松布尔, 等. 蒙药草乌叶化学成分及临床研究进展[J]. 中草药, 2006, 37(3): 472. WU-Li-Ji-te-gu-si, BAI XL, ALATANSUMBER, et al. Research progress of chemical constituents and clinical applications of Mongolia medicine Aconiti Kusnezoffii Folium[J]. Chin Tradit Herb Drugs, 2006, 37(3): 472. |
| [11] |
于海兰, 贾世山. 蒙药草乌叶中一个新二萜生物碱[J]. 药学学报, 2000, 35(3): 232. YU HL, JIA SS. A norterpenoids alkaloid, beiwucine from the leaves of Aconitum kusnezoffii Reichb.as Mongolia medicine[J]. Acta Pharm Sin, 2000, 35(3): 232. |
| [12] |
图雅, 张贵君, 王淑敏, 等. 草乌叶及其煎煮液中生物碱类药效组分的电喷雾串联质谱研究[J]. 中国中药杂志, 2008, 33(7): 789. TU Y, ZHANG GJ, WANG SM, et al. Study on active components alignment of alkaloids in extractive of Folium Aconiti Kusnezoffii by ESI-MS[J]. China J Chin Mater Med, 2008, 33(7): 789. |
| [13] |
赵英永, 崔秀明, 戴云, 等. 高效液相色谱法测定草乌类药用植物活性成分含量[J]. 中国药学杂志, 2007, 42(11): 815. ZHAO YY, CUI XM, DAI Y, et al. Determination of active ingredients in Radix Aconiti Kusnezoffii by HPLC[J]. Chin Pharm J, 2007, 42(11): 815. DOI:10.3321/j.issn:1001-2494.2007.11.005 |
| [14] |
郑杭生, 冯年平. 中药饮片制川乌、制草乌中乌头碱、次乌头碱的HPLC测定[J]. 药物分析杂志, 2005, 25(1): 34. ZHENG HS, FENG NP. HPLC determination of mesaconitine and hypaconitine in prepared Chuanwu and Caowu[J]. Chin J Pharm Anal, 2005, 25(1): 34. |
| [15] |
赵英永, 崔秀明, 张文斌, 等. RP-HPLC法测定草乌中乌头碱、中乌头碱和次乌头碱[J]. 中草药, 2006, 37(6): 940. ZHAO YY, CUI XM, ZHANG WB, et al. Determination of aconitine, mesaconitine and hypaconitine in Radix Aconiti Kusnezoffii by RP-HPLC[J]. Chin Tradit Herb Drugs, 2006, 37(6): 940. |
| [16] |
辛杨, 王淑敏, 刘志强, 等. 高效液相色谱法测定草乌叶中新乌头碱、乌头碱和次乌头碱[J]. 国外医药·植物药分册, 2008, 23(4): 170. XIN Y, WANG SM, LIU ZQ, et al. Determination of mesaconitine, aconitine, and hypaconitine in leaves of Aconitum kusnezoffii by HPLC[J]. World Phytomed, 2008, 23(4): 170. |
| [17] |
GYURKOVSKA V, PHILIPOV S, KOSTOVA N, et al. Acetylated derivative of glaucine inhibits joint inflammation in collagenase-induced arthritis[J]. Immunopharmacol Immunotoxicol, 2015, 37(1): 56. DOI:10.3109/08923973.2014.972414 |
| [18] |
REMICHKOVA M, DIMITROVA P, PHILIPOV S, et al. Toll-like receptor-mediated anti-inflammatory action of glaucine and oxoglaucine[J]. Fitoterapia, 2009, 80(7): 411. DOI:10.1016/j.fitote.2009.05.016 |
| [19] |
NISHIYAMA Y, MORIYASU M, ICHIMARU M, et al. Antinociceptive effects of the extracts of Xylopia parviflora bark and its alkaloidal components in experimental animals[J]. J Nat Med, 2010, 64(1): 9. DOI:10.1007/s11418-009-0356-2 |
 2018, Vol. 38
2018, Vol. 38 
