3H和14C等放射性标记药物广泛应用于新药研究和药物残留分析等领域,是用来阐明药物代谢和处置过程的完美工具,它还可用来解决生物化学研究[1],揭示生物合成途径[2],酶促反应机制研究[3-4],阐明有机反应机制[5-8]和环境科学领域研究。它是利用放射性核素3H和14C作为示踪剂,对研究对象进行标记并示踪检测的微量定性定量分析方法,有着极强的定位示踪能力和极低的检测限。放射性同位素与自然界存在的相应普通元素及其化合物之间有着相同的化学性质和生物学特性,但具有不同的核物理性质[9]——放射性。因此,用放射性同位素作为标记物,制成含有放射性同位素的标记化合物分子,代替相应的未标记化合物,利用放射性同位素不断地放出特征射线的核物理性质,用放射性检测仪器设备随时示踪目标化合物(target compounds)在体内或体外的分布位置、数量及其代谢变化等处置特性。放射性标记示踪方法一直用于预测药物在体内处置研究。常用的放射性同位素包括14C、3H、32P、35S、125I、131I等,测量仪器设备各有不同,14C、3H,32P可用液体闪烁计数仪(liquid scintillation counter,LSC),35S可用气体正比计数仪(gas proportional counter),125I可用低能光子光谱(low energy photon spectroscopy),131I可用高纯锗探测器(HPGe detector)检测[10]。最常用于新药临床及化合物在体内命运研究的标记物是14C,它广泛存在于有机化合物中(大部分有机化合物分子都有C原子),与其他放射性元素相比而言,分子中形成的化学键稳定,更加安全,半衰期更长,可获得更高的放射性比活度;另一种常用标记物3H,其特点是易于化学合成,价格相对低廉,易得,在国内有很多企业和研究单位都具有氚化合成设备和技术能力。如今随着小型正电子发射断层扫描(positron emission tomography,PET)仪器的发展,利用11C、13N、15O、18F等放射性核素进行毒药物动力学[机体对外源化学物的吸收、分布、代谢及排泄过程(ADME)]研究的实例也日渐增多[11]。
新药研究所需放射性标记药物的合成过程受到多种因素的影响,如放射性同位素的来源、放射性标记药物的规格及其检测手段。放射性标记化合物的规格包括放射性同位素种类、放射性剂量(放射性活度)、放射性比活度(比活度)、化合物分子结构中的标记位置、化学纯度和放射性化学纯度(放化纯度)、给药量、给药方式、给药剂型及目标化合物的用途等诸多因素[12]。而放射性同位素来源可能还要受用药期限、财务计划、实验室功能和仪器设备、法规和实验室规章制度、放射性标记起始化合物、未标记起始原料(unlabeled starting material)、中间体、标准物质、合成工艺相关产物等的配备、处置和保存条件等诸多因素的限制。
随着放射性检测仪器设备的更新换代,放射性标记合成技术和检测手段有了长足的进步。但在国内生命科学飞速发展的今天,其原材料却严重依赖国外试剂、药品供应者。同时存在标记合成研究方法落后,现代检测确证手段的应用普及率较低,交流不深入等问题。本文将阐述3H和14C标记药物的化学合成方法及其制备策略,随后重点探讨3H和14C标记药物的质量控制,并以3H和14C标记药物为例,说明放射性标记药物的最新确证和检测技术手段,为新药研究和药物残留研究者提供参考。
1 3H、14C标记药物的制备策略放射性标记化合物的制备方法主要有非合成方法和化学合成方法2种[9]。非合成方法主要有同位素交换法、生物合成法,其他还有热原子反冲标记法(hot atom recoil labeling method)、加速离子标记法(accelerated ion labeling method)、辐射合成法(radiation synthesis method)等。非合成法一般具有操作简便的优点,并适用于制备有些氚标记化合物,缺点是氚在标记化合物分子上的具体位置通常无法预先确知,且所获得的氚标记化合物的比活度较低,放射性杂质的含量较高,影响示踪研究的检测限、准确度和体内外分布位置的确定。但非合成法标记的放射性药物可解决新药开发过程中的临床前和临床研究早期部分机理问题[13]。
化学合成法的优点是放射性标记化合物的比活度和放化纯度高,标记位置容易确定,因而是目前制备放射性核素标记化合物最主要的方法,缺点是制备过程复杂,步骤多,流程长,成本高。放射性化学合成法与普通化学合成有很多不同之处:首先在选用原料方面,一般化学合成可方便地选用各种原料及中间体,而放射性标记化合物只能选用简单的放射性前导物(precursor),如14C类主要是从反应堆里直接得到的原料Ba14CO3等,3H类主要有氚气(3H2)、氚水(3H2O)、硼氚化钠(NaBH33H~NaB3H4)、氚化铝锂(LiAlH33H~LiAl3H4)等[4],因而合成方法受到原料的严格限制;其次,在设计合成路线时,除了考虑简便、快速外,还要尽量使放射性原料在最后步骤中加入,以提高放射性原料的利用率;另外,制备高比活度标记化合物时,往往需专门的微量合成装置及分离纯化技术,并避免高温高压等剧烈反应,以减少放射性沾染可能性。放射性标记化合物的制备过程需要经过合成工艺研究(确定合成路线和反应条件,根据路线和条件配备试剂和药物),微量合成改造等步骤,随后才利用通过合成工艺研究和微量改造获得的数据和操作经验,严格按照放射性反应操作规程,完全遵循微量改造步骤和操作方法,一次性制备放射性标记化合物。以下主要讨论放射性化学合成方法。
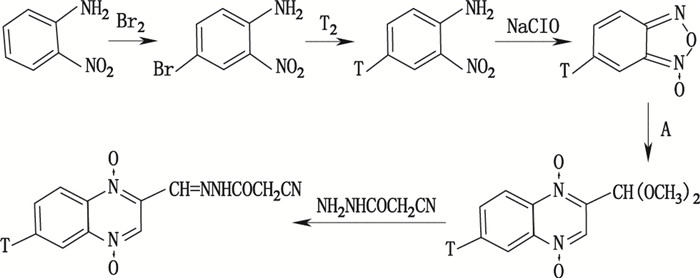
1.1 确定合成路线和反应条件根据放射性标记药物的用途、用量、现有实验条件等诸多因素,参考原料药物合成工艺,设计合适的放射性合成工艺路线。选择合成路线时要求操作步骤少,时间短,并力求在合成的最后阶段引入放射性标记原子,并进一步优化反应条件,提高产率。确定一个较为合理的放射性药物的制备路线和反应条件,应结合前人的研究成果、现有的相关文献报道和专利,更应该遵循制备放射性化合物的基本原则。例如,斯琴朝克图(2011年)[14]在探索制备氚标记动物促生长药物喹赛多(CYX)的合成路线时,先后设计并尝试了3种不同的合成路线。最终根据实验室条件和随后进行的示踪试验要求,选择了合成路线Ⅰ(见图 1)作为最终标记合成路线。其反应收率高,步骤少,操作简单,放射性废物少。而且,经过未标记CYX稀释后获得的6-[3H]-CYX比活度高达39.94 mCi·mmoL-1,如果有必要其比活度还可提高10倍以上。
|
图 1 6-[3H]-CYX合成路线Ⅰ(A:CH3COCH(OCH3)2) Figure 1 Synthesis route(Ⅰ)of 6-[3H]-CYX (A:CH3COCH(OCH3)2) |
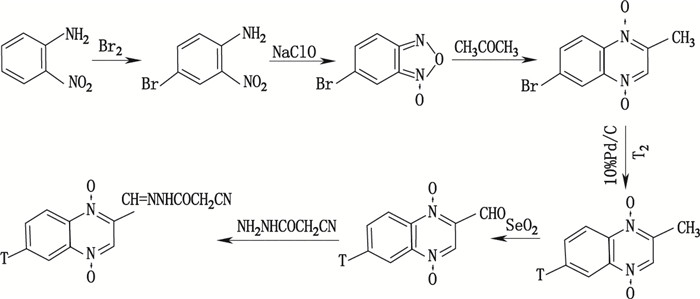
合成路线Ⅱ(见图 2)的设计原则除反应步骤简便、快速外,要尽量使放射性原料在最后步骤中加入,以提高放射性原料的利用率。本合成路线共设计6步反应,将氚原子引入步骤设计在化学性质被认为比较稳定的6-Br-2-甲基喹噁啉上。在具体实施合成反应过程中,前3步反应比较顺利,获得了较高纯度的6-Br-2-甲基喹噁啉。但用氚气催化氚化6-Br-2-甲基喹噁啉反应时受阻,无法顺利引入氚原子,未能获得目标化合物6-[3H]-2-甲基喹噁啉。此后,氚化反应步骤推至前一步化合物4-Br-苯并呋咱(Br-BFO)上,但同样未能成功脱溴氚化。多次尝试无法达到预期目标的情况下放弃此合成路线。
|
图 2 氚标记CYX合成路线Ⅱ(T=3H) Figure 2 Synthetic route (Ⅱ) of tritium labeled CYX (T=3H) |
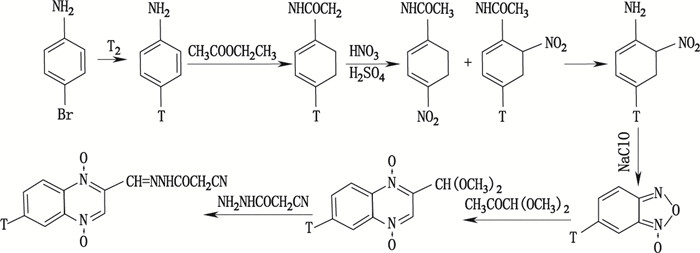
合成路线Ⅲ(见图 3)设计的前提是合成路线Ⅰ受阻,在氚化4-Br-2-硝基苯胺(4-Br-ONA)时其硝基还原始终比脱溴更快,无法获得目标化合物4-[3H]-ONA。暂时无法达到最终目的的情况下,将氚化反应往前推一步,在结构更简单、化学性质更稳定的对溴苯胺上进行氚化,避开硝基还原。然后保护氨基,硝化4-[3H]-苯胺,水解脱保护,再利用ONA的升华性质水蒸气蒸馏方法分离纯化[3H]-ONA。此后的步骤与合成路线Ⅰ相同,成功获得了目标化合物6-[3H]-CYX。但此合成路线步骤多,流程长,收率低(2%~5%),在解决合成路线Ⅰ遇到的困难后被放弃。
|
图 3 氚标记CYX合成路线Ⅲ(T=3H) Figure 3 Synthetic route (Ⅲ) of tritium labeled CYX (T=3H) |
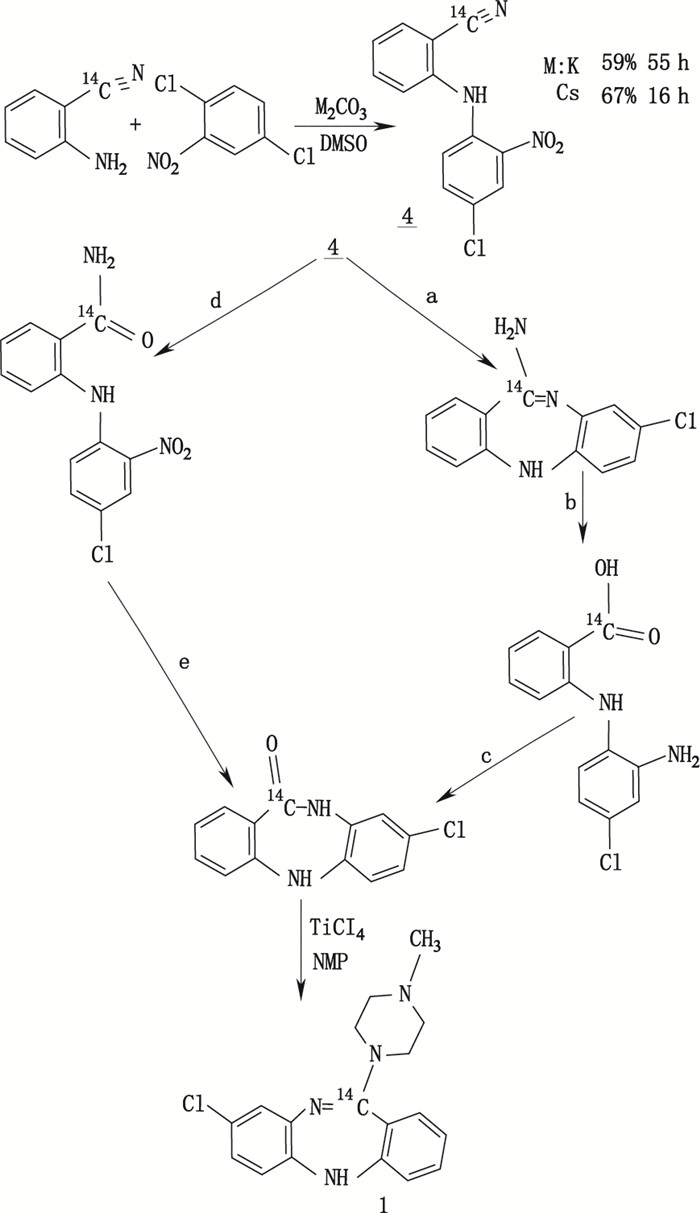
在标记合成过程中始终要探索更合理、更有效、更经济的合成策略。Matloubi等[15]在早期报道基础上,对11-[14C]-clozapine(氯氮平)的标记合成路线进行了改造和优化。结果显示,反应时间缩短了60%,总产率从原来的6%增加到23%,获得较好的改造效果。11-[14C]-clozapine的合成路线和反应条件改造过程见图 4。此例说明合成路线设计的合理与否直接影响反应产率,甚至还影响目标产物的放化纯度、比活度等。
|
a. SnCl2/HCl b. KOH/EtOH c. HCl/EtOH[3步反应(3 steps),124 h,23.27%]d. H2O2 30%,K2CO3/DMSO e. SnCl2/AcOH[2步反应(2 steps),16 h,77%] 图 4 原报道中的合成路线(a、b、c)及改造后的合成路线(d、e) Figure 4 Reported synthetic pathway (a, b, c) and modified synthetic pathway (d, e) |
新药研究过程中,在进入临床前研究和临床研究阶段之前通常可用直接氚化等非合成氚化技术[16],如用氚水、氚气、氚复合物以及近期发展起来的氚化试剂等在目标化合物分子中直接引入氚原子,得到简单的非定位氚标记目标化合物,进行示踪研究,而不必用定位标记化合物。如通过同位素交换方法,比化学合成方法简单、经济、快速、有效得多。由于氚能直接或非直接地取代或加成到化合物中,不需要进行碳架合成,所以较14C标记化合物的制备简便得多。一般非合成标记方法有同位素交换法、反冲原子法以及其他生物化学标记法等。
叠氮胸苷(azidothymidine)是一种用于治疗艾滋病获得性免疫缺陷综合征(AIDS)的药物。Sidorov等[17]用同位素交换方法制备氚标记叠氮胸苷,用于临床前示踪研究,获得很好的效果。研究表明,反应收率达20%~70%。本研究采取固态和液态同位素交换方法,在氚气和氚水中与叠氮胸苷发生催化氢-氚交换反应,并详细考察了不同催化剂、溶剂、pH、温度条件下的反应进程和反应收率。催化氚交换反应条件参考表 1和表 2。
|
|
表 1 液相中非均相催化剂催化同位素交换方法氚标记叠氮胸苷时不同溶剂和催化剂的影响(氚-氕混合(1:1 000),180 min,20 ℃) Table 1 Effect of solvents and catalysts on liquid-phase catalytic heterogeneous isotope exchange of azidothymidine with tritium (trtium-protium mixture (1:1 000), 180 min, 20 ℃) |
|
|
表 2 在DMF(180 μL)和三乙胺(10 μL)溶剂中用氚水(10 μL,55 Ci· mL-1)同位素交换方法获得氚标记叠氮胸苷(2 μmol)3 h Table 2 Isotope exchange of azidothymidine (2 μmol) with tritium water (10 μL, 55 Ci·mL-1) in DMF (180 μL) and triethylamine (10 μL), 3 h |
Shevchenko等[18]为阐明氚水同位素交换反应的反应机理和影响因素,对溴氰菊酯(deltamethrin)、巴吉林(pargiline)、曲古抑菌素(trichostatin)、环丙沙星(ciprofloxacin)和1,3-O-二苯甘油(1,3-O-dibenzylglycerol)等6种化合物,用氚水作为氚源,在钯催化剂的作用下进行氚化交换,并优化了反应条件,最后还尝试用近期发展起来的固相反应-“电容模型”解释了氚标记特性和反应机理。其中5种化合物的氚交换反应条件和反应收率见表 3。
|
|
表 3 氚水中的同位素交换氚标记(溶剂为二氧六环-Et3N,Pd催化剂) Table 3 Tritium labeling by isotope exchange with tritium water (solvent dioxane-Et3N, Pd catalysts) |
生物化学方法也是一种常用非合成氚标记方法,其基本原理是利用生物体的代谢过程或利用某些生物活性物质(如酶)的催化作用,将已经氚化的中间体或起始原料(starting material)转化成所需要的氚标记物质。如S-胸苷-L-[甲基-3H]-蛋氨酸(S-adenosyl-L-[methyl-3H]methionine)的生物合成[19]。热原子反冲标记法,即利用核反应6Li(n,a)3H或3He(n,p)3H所产生的带有动能的氚原子与有机分子的作用来制备氚标记化合物。如将氨基酸与碳酸锂混合,封入真空石英安瓿瓶或铝容器中,置于反应堆内,边冷却边照射一定时间,放置几星期后开封,可从被照射的混合物中分离出氚标记的氨基酸。由于用核反冲所得的产品中杂质多,比活度低,实用价值不大。
1.3 化学合成方法制备3H和14C标记药物非合成方法获得氚标记产物有一定缺陷,如标记位置和标记数量不确定,在体内易于与体内的氢原子交换而导致原药及其代谢产物失去放射性。而在新药研究后期进行的ADME研究、代谢动力学研究及物料平衡研究等时,对目标化合物进行确切的定性、定位、定量分析,因此标记药物使用稳定的定位标记化合物[16]。定位标记是指通过化学合成方法,利用3H或14C标记中间体或起始原料,将3H或14C原子标记在后续研究中代谢稳定性较强的母核基团的C原子上,形成C-H键(或C-C等稳定键),获得标记位置明确,化学性质较为稳定的目标化合物的一种化学合成方法。
1.3.1 催化加氚方法制备3H标记药物化合物在催化剂作用下与氚气发生还原加成反应,如碳碳双键加氚反应、碳杂原子双键加氚反应等。Ren等[20]在氚标记合成一种选择性磷酸二酯酶5型抑制剂SCH 444877的研究中,以乙酸乙酯为溶剂,用10% Pd/C催化剂催化合成其起始原料(1),在其母环2,3位碳碳双键上发生氚加成反应,获得氚标记前导物(2),再经过另外两步反应获得高放化纯度(99.6%)、高比活度(693 mCi·mmol-1)氚标记目标化合物[3H]-SCH 444877(5),其合成路线见图 5。
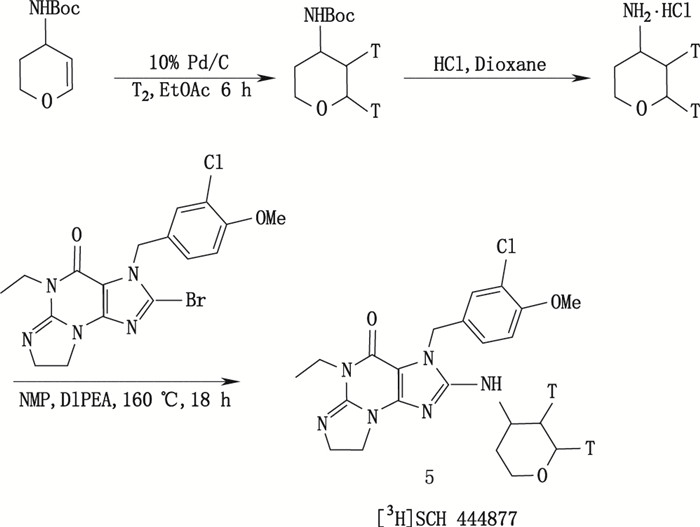
|
NMP. N-甲基吡咯烷酮(N-methyl pyrrolidone)DIPEA.二异丙基乙胺(disopropylethylamine) 图 5 [3H]-SCH 444877(5)的合成路线 Figure 5 Synthetic route of [3H]-SCH 444877 (5) |
这是在催化剂作用下以氚气作为氚原子供体,将化合物上的功能基团与氚原子交换,获得定位氚标记化合物的一种方法。最常用的是催化氚-卤置换方法。Egan等[21]在氚标记一种疟疾特效药氯喹(chloroquine)的研究中,用10% Pd/C作为催化剂,氚气作为氚源,对碘化前导物(1)进行碘-氚置换反应,成功获得高比活度(1.07 TBq·mmol-1)的符合动物实验所需的氚标记目标化合物[3-3H](+/-)-氯喹(2)。氯喹的碘化前导物(1)和氚标记目标化合物结构(2)见图 6。
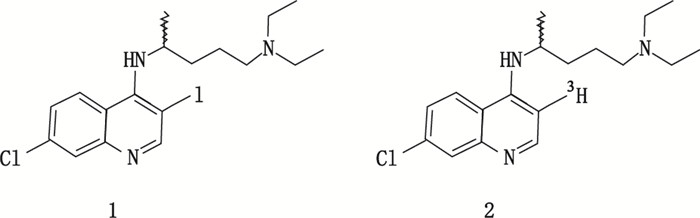
|
图 6 氯喹的碘化前导物(1)和氚标记目标化合物(2)结构 Figure 6 Structures of iodo precursor (1) and tritium labeled chloroquine (2) |
也有少数氧和硫原子与氚原子的置换反应,虽然相关例子不多,但也是一种有效可行的氚标记合成方法。如Kovalainen等[22]在氚标记合成一种抗组胺剂盐酸N,N-二乙基-2-[4-(苯甲基)苯氧]-乙胺(N,N-diethyl-2-[4-(phenylmethyl)phenoxy]-ethaneamine · HCl,DPPE)研究中,10% Pd/C作为催化剂,进行氚-氧置换反应,获得比活度达到30.5 Ci·mmol-1的目标氚标记化合物[3H]-DPPE。其合成路线见图 7。
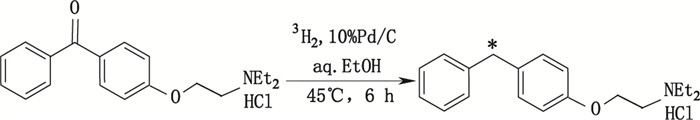
|
图 7 氚标记DPPE合成路线(*标记位置) Figure 7 Synthetic route of tritium labeled DPPE(*labeled site) |
用氚标记还原剂还原不同化合物,获得相应氚标记目标化合物。氚化还原产物很少有同位素干扰和置换副反应等影响产物质量的因素,但其反应中的溶剂或反应产生的水会造成同位素稀释问题,降低预期比活度。另外,还可能产生同位素动力学影响(kinetic isotope effects),会在氚-氢置换反应过程中降低预期放射性比活度[23]。如氚标记还原剂硼氚化钠(NaB3H4),因为其用途广泛、稳定,以及放射性比活度高(可达80 Ci·mmol-1),经常作为氚化还原试剂应用。1981年Paaren等[24]在氚标记合成维生素D时采用比活度为48 Ci·mmol-1的硼氚化钠,成功获得反应产物氚标记维生素D,其比活度达到12 Ci·mmol-1。
氚化铝锂(LiAl3H4)也是常用的氚化还原试剂之一。其还原性强于钠和锂的硼氢(氚)化物,能够还原大部分相关基团。1974年Egmond等[25]在前人的工作基础上,利用氚化铝锂(LiAl3H4)合成了氚标记亚油酸,获得比活度、放化纯度都能满足后续试验需求的氚标记目标化合物。研究结果表明,此氚标记方法可用于大部分D-或L-脂肪酸的氚标记合成,而且可获得很好的结果。合成路线见图 8。
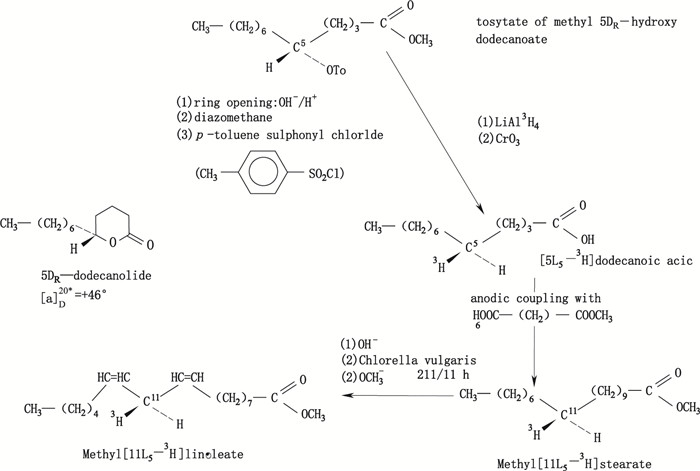
|
图 8 氚标记亚油酸的合成路线 Figure 8 Synthetic route of tritium labeled linoleic acid |
此外,还有氚化锂(Li3H)、硼氚化锂(LiB3H4)、氚化铝锂(LiAl3H4)、氰基硼氚化钠(NaB3H3CN)等氚化还原剂可用于不同目的和性质的氚化还原合成反应。
1.3.4 用小分子氚化前导物制备3H标记药物这是一种利用市场化的氚化前导物作为起始材料或中间体,经过修饰、合成、制备获得所需目标氚标记药物的方法。常用的小分子氚标记前导物有氚水(3H2O)、氚化二亚胺(3HN=N3H)、氚化碘甲烷(C3H3 I)、氚化甲醛(3HCHO,3HC3HO)、氚化丙酮等。根据试验需求购买、定制,或用易于获得的氚源自备氚前导物,用于不同目标化合物的合成制备。此类氚化合成方法种类多,文献材料丰富,合成路线的选择也有其特殊性。如抗艾滋病药物Vicriviroc(SCH 417690)是一种有效性和选择性很强的CCR5拮抗剂。Hesk等[26]用氚水作为氚化前导物,制备了高比活度氚标记化合物[3H]-SCH 417690,用于研究其受体结合特性。合成路线见图 9。实验结果表明,合成获得的[3H]-SCH 417690比活度为16.4 Ci·mmol-1,虽然未能达到比活度预期值,但足以满足后续进行的受体结合研究需要。
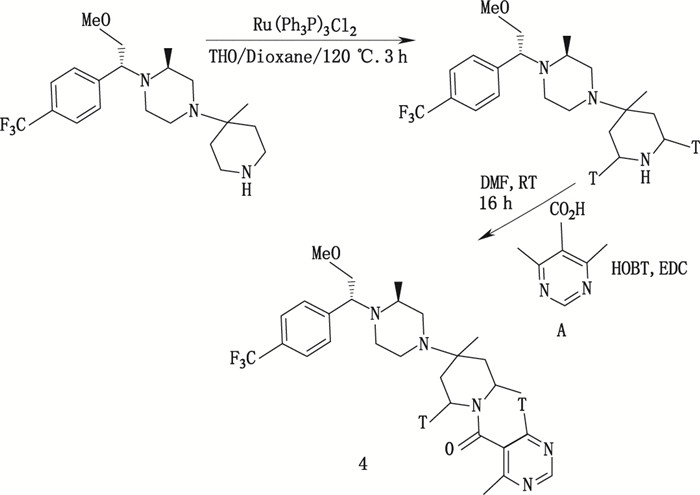
|
图 9 [3H]-SCH 417690(4)合成路线 Figure 9 Synthetic route of [3H]-SCH 417690 (4) |
14CO2是最常用的14C标记化合物合成的起始材料,从Ba14CO3的催化反应中获取,溶于氢氧化钠溶液中备用。大部分市场化的14C起始原料是14CO2的衍生物。Ba14CO3是一种所有14C标记化合物通用的14C供体,来自核反应堆里的14N(n,p)14C反应,并在一定催化条件下(浓H2SO4或PbCl2)释放14CO2,作为14C前导物用于合成14C标记化合物[9]。因此,Ba14CO3可以认为是14CO2的一种较为稳定的保存形式。各种14C标记起始材料或中间体的应用主要取决于14C标记目标化合物的结构和合成路线的选择。如[14C]-甲酸(H14COOH)、[14C]-甲醛(H14CHO)、[14C]-碘甲烷(14CH3I)、[14C]-硝基甲烷(14CH3NO2)、[14C]-乙酸及其衍生物、卤素的[14C]-醋酸盐、[14C]-丙酮、金属[14C]-氰化物、[14C2]-乙炔(H14C≡14CH)等都是常用的14C标记化合物起始材料。14C标记化合物在同位素标记合成领域文献众多,根据不同目标化合物的结构、后续研究的需求,其反应路线的选择、合成反应条件和优化方法都有其各自的特点。
1,5-芳基-1,2,3-三唑类(1,5-diaryl-1,2,3-triazoles)化合物均具有抗惊厥特性,其特点与苯巴比妥米那(镇静安眠剂)、苯妥英等相似,其化学结构见图 10。Matloubi等[27]在14C标记合成1,5-芳基-1,2,3-三唑类药物时利用K14CN作为起始原料,合成获得Cu14CN,随后通过另外6步反应获得14C标记目标化合物。反应产率高,比活度可满足随后进行的生物示踪研究需要。其反应路线见图 11。
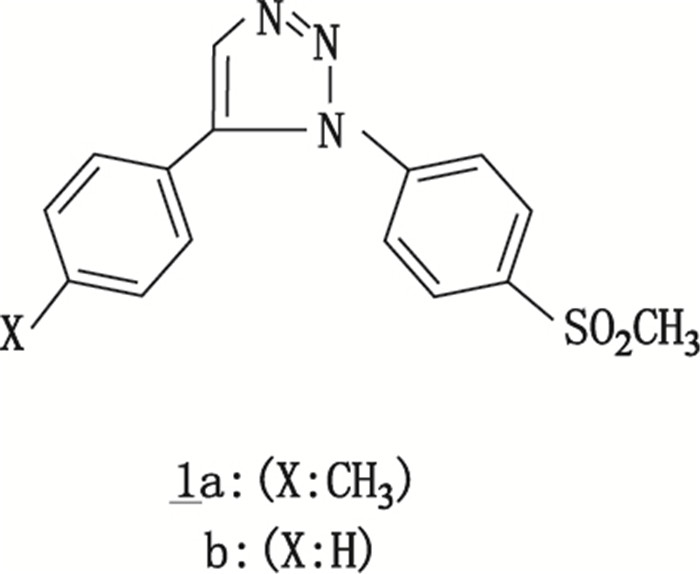
|
图 10 1,5-芳基-1,2,3-三唑类化学结构 Figure 10 Structure of 1, 5-diaryl-1, 2, 3-triazoles |
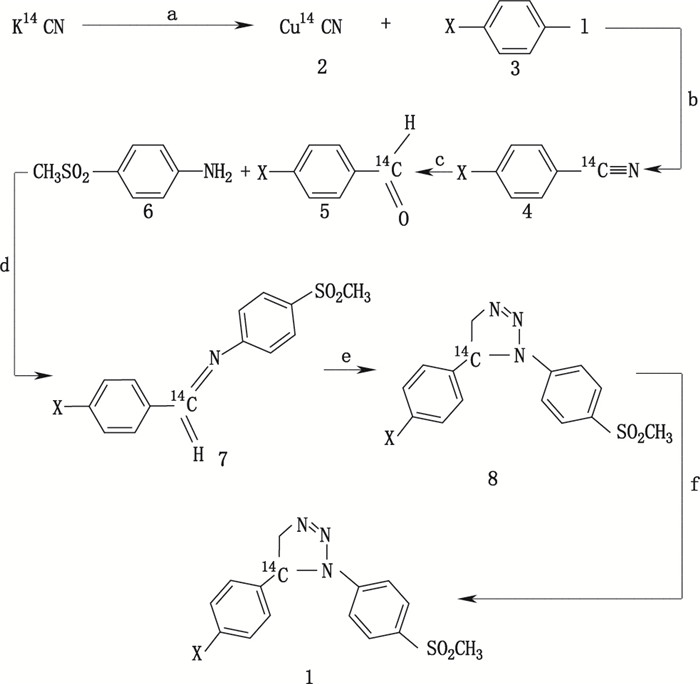
|
a. CuSO4·5H2O,Na2S2O5 b. DMF c.雷尼镍(Raney-Ni),HCO2H 75% d. EtOH/THF e. CH2N2,二氧六环(dioxane)f. KMnO4,n-Bu4N+Cl-,苯(benzene),H2O X. a:(CH3),b:(H) 图 11 [14C]-1,5-芳基-1,2,3-三唑类合成路线 Figure 11 Synthetic route of 1, 5-diaryl-1, 2, 3-triazoles |
另外,Hesk等[26]在14C标记合成抗艾滋病药物Vicriviroc(SCH 417690)时以14C-甲醛([14C]-HCHO)作为14C源,经过8步反应获得目标化合物[14C]-SCH 417690,其比活度达16.74 mCi·mmol-1(25.76 µCi·mg-1),放化纯度99.2%。合成路线见图 12。
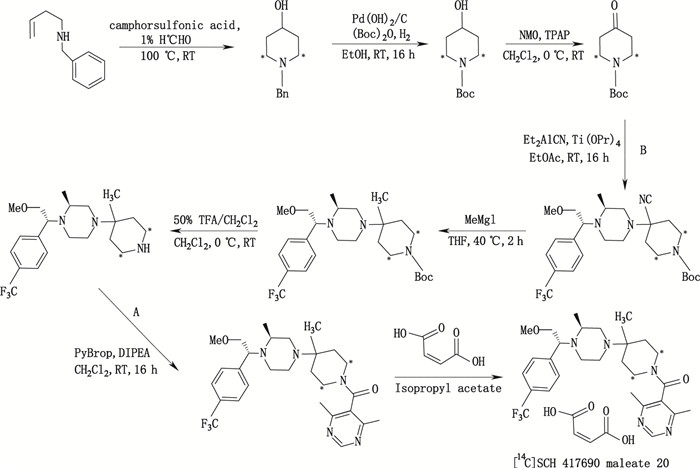
|
图 12 [14C]SCH 417690的马来酸盐(20)合成路线 Figure 12 Synthetic route of [14C]SCH 417690 maleate (20) |
微量合成改造的目的是获得能够满足后续示踪研究所需的高比活度放射性标记化合物,还能限制对工作人员的放射性暴露和实验室的放射性污染。为此,将上述常规剂量的合成步骤完成后将其改造成微量合成步骤,并优化每一步反应的产率,为下一步进行放射性合成做好充分的准备。制备放射性同位素标记药物试验要求准确、仔细,稍有疏忽或考虑不周就匆忙进行正式放射性试验(热试验,hot test),既容易导致试验失败,又会造成放射性起始原料和其他实验试剂和用品的浪费,还会增加放射性废物,提高实验室放射性本底水平,使实验者接受不必要的辐射剂量。所以模拟实验(冷试验,cold test)不仅可以检查热试验中所用器材,药品是否合格,而且可以对操作人员进行训练,以保证正式实验能顺利进行。由于放射性标记化合物有许多自身的特殊性,其制备也有诸多特殊要求。制备放射性化合物的原料如14C、3H等得来不易,价格昂贵,因此在制备过程中必须充分利用,要求标记率尽量高,未标记上的放射性核素也要尽量回收。标记、分离、鉴定等过程均需要用微量或超微量技术。在操作过程中,要尽量减少放射性核素的稀释,避免引入不必要的载体。
放射性标记药物的剂量和比活度可能直接影响示踪试验的成败,其反应路线的微量合成改造不仅要考虑示踪试验用药剂量,还要考虑仪器设备的检测限。因此,避免发生自辐射分解的条件下目标标记化合物的比活度越高越好。比活度高可以用非标记药物混合稀释,如果比活度低于用药条件,等于整个实验的失败,无法挽回。微量合成改造过程中合成路线的合理性、投料量大幅缩小后的反应条件的变化、终产物的分离纯化等都需要重新调整和优化。例如,斯琴朝克图[14]在前述制备氚标记喹赛多的微量合成改造过程中,3步反应(图 1)中的最后1步(合成6-[3H]-CYX反应),微量合成改造主要从投料量、溶剂用量、分离纯化过程3个方面进行考察优化,并获得满意的收率和符合示踪试验条件的高放化纯度、高化学纯度、高比活度的氚标记稳定产物,详细优化数据见表 4。
|
|
表 4 合成6-[3H]-CYX反应条件的微量合成改造与优化设计 Table 4 Modification and improvement design of regular reaction conditions to a microscale-synthesis level for synthesis of 6-[3H]-CYX |
三磷酸吡啶核苷酸(NADPH)是研究NADP+依赖性酶的重要物质,作为供氢体可参与体内多种代谢反应。Agrawal等[28]为了研究NADPH在体内代谢过程,采用微量合成方法制备了氚标记NADPH。他们在早期文献报道[29]的基础上重新设计,改造了氚标记还原型烟酰胺腺嘌呤二核苷酸(R-[4-3H]-NADPH)的合成路线和反应条件。与早期研究报道相比,不仅反应路线短,产率增加明显,产物纯度相对高,而且标记合成规模也缩小了很多,产物比活度也更高。合成获得的中间体2-[3H]-异丙醇(2-[3H]-iPrOH)的比活度可达25 Ci·mmoL-1,更适合作为起始原料用于其相关衍生物的氚标记合成。其合成路线图见图 13。
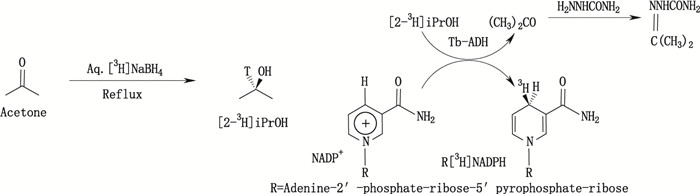
|
图 13 [2-3H]-iPrOH和R-[4-3H]-NADPH)标记合成路线 Figure 13 Synthetic pathways of [2-3H]-iPrOH and R-[4-3H]-NADPH |
放射性同位素标记药物的分离纯化方法比普通化合物的纯化方法复杂得多,试剂和药品的用量远小于普通化合物的合成规模。放射性示踪研究所需高比活度氚标记化合物一般只需几微克至毫克级,而14C标记化合物一般也只需10~100 mg。其分离纯化过程中还存在自辐射产生的杂质污染。对于微量放射性标记药物而言,最适宜的纯化方法是色谱分离方法,其优点是易于控制放射性污染途径,纯化较为彻底。如硅胶柱色谱、快速柱色谱(flash chromatography)与其配套的自动收集装置、封闭的高效液相色谱(HPLC)或中压液相色谱(MPLC)、超临界流体色谱法(SFC)、制备径向流色谱(radial flow chromatography,RFC)和薄层色谱(TLC)等。如,Matloubi等[15]在14C标记制备精神病治疗药物氯氮平(11-[14C]-氯氮平)时,所有3步反应产物的分离纯化都采用了硅胶柱色谱分离方法,产率分别达到67.3%、89.6%、86.0%,产物纯度基本满足示踪研究需要。Agrawal等[28]对制备氚标记NADPH方法进行优化时主要目标化合物的纯化采用了HPLC制备方法。[2-3H]-iPrOH反应混合物放射性HPLC色谱图(图 14-A)显示,5 min出现的色谱峰为[3H]-H2O(占总放射性的19%);15.5 min时的峰为[2-3H]-iPrOH(占总放射的81%),未进行分离直接用于下一步反应。合成R-[4-3H]-NADPH反应混合物的放射性HPLC图谱(图 14-B)表明,5 min的色谱峰为[3H]-H2O;15.5 min的峰为[2-3H]-iPrOH,17.5 min的峰为[4-3H]-NADPt;26 min的峰为目标化合物R-[4-3H]-NADPH(占总放射性的75%),收集26 min对应R-[4-3H]-NADPH色谱峰的流动相馏分(fraction),获得高纯度、高放化纯度的目标化合物。此外,Parnes等[30]则用微量合成方法制备挥发性酰氯化合物(volatile,14C-labelled acid chlorides),过程中采用了真空传输(vacuum transfer)分离技术纯化中间体和终产物,未经进一步馏分接受(fractionation)的方法。
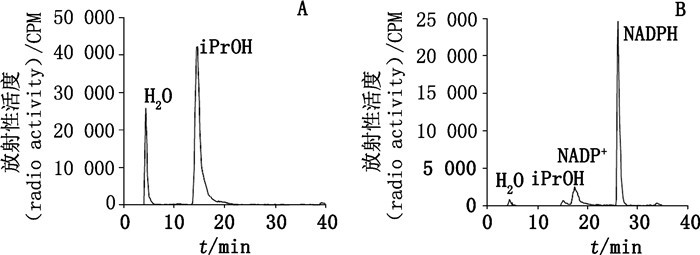
|
图 14 [2-3H]-iPrOH和[3H]-SCH 417690(4)反应混合物的放射性HPLC图谱 Figure 14 HPLC radiochromatograms of the [2-3H]-iPrOH and [3H]-SCH 417690 (4)reaction mixture |
对于毫克级别的放射性标记药物的分离纯化,除上述仪器分析方法以外,还可选用更简便易行的重结晶、萃取等化学分离方法。对放射性辐射敏感的化合物可在惰性气体保护的环境中操作。
2 3H、14C标记药物质量控制新药研究过程中的药物处置研究,如体外代谢研究、ADME研究、物料平衡研究,食品安全研究中的兽药残留研究和农药残留示踪,放射性治疗药物等药物研究过程中对放射性同位素标记化合物有着详尽的质量要求。公认的放射性同位素标记化合物的质量控制项目包括:放射性药物的结构确证、化学纯度、放射性活度、放化纯度、放射性比活度、放射性同位素的标记位置确定等定量和定性分析[12]。
2.1 结构鉴定放射性标记化合物结构中带有放射性同位素,因此其结构鉴定也有所不同。普通化合物常用的如磁共振图谱(NMR),包括1H-NMR和13C-NMR,能够为3H和14C标记化合物提供几乎大部分化学结构信息。还有2D-NMR也是一种很实用的结构确证方法,当1D-NMR信息不够准确时,2D-NMR能够提供更加完善的相关化学结构信息。质谱(MS)分析不仅能提供相对分子质量,还可用于放射性活度计算。经典分析方法,如红外光谱(IR)提供的化学结构指纹信息,可与未标记标准物质对比分析,没有相关标准物质时也可提供各基团详细信息。NMR或IR能够轻易分辨、解析和判断同位素引起的潜在的化学结构上的信息变化和非放射性元素之间的区别。
需要强调的是,色谱分析方法中常用的标准物质保留时间比对法一般不能用于放射性同位素标记化合物的确证,只能作为参考依据。首先,结构相近的化合物和反应过程中产生的副产物的色谱分离保留时间相近。其次,在高分辨率色谱方法中,未标记标准物质和放射性同位素标记化合物的保留时间会发生较明显的变化,此现象称为同位素组分分馏(isotopic fractionation)[31]。另外,有机胺类化合物中C-H键上的氢原子被3H或2H取代时其pKa值可能发生变化,当HPLC流动相的pH值接近此化合物的pKa时保留时间会发生明显变化[32]。如,Hong等[33]在微量合成氚标记CH2H4叶酸(CH2H4folate)时采用HPLC方法分离,UV定性目标标记化合物。图 15中CH2H4叶酸色谱峰的保留时间为26 min,占总放射性的25%,图中用保留时间无法确证,但图谱中插入的UV图谱可确认此色谱峰为CH2H4叶酸相应的氚标记物质。
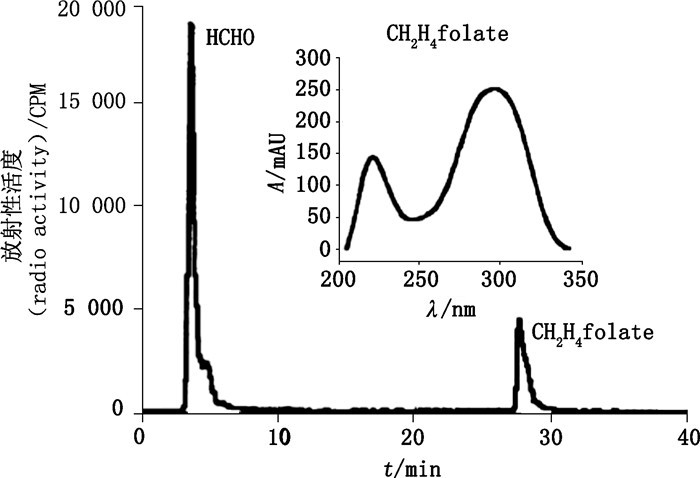
|
图 15 氚标记CH2H4叶酸反应混合物的HPLC氚放射性图谱 Figure 15 HPLC tritium radiogram of the reaction mixture of CH2H4 folate |
测量放射性化合物的化学纯度与普通化合物类似,一般采用配有紫外检测器的高效液相色谱仪(HPLC/UV),用一定量的放射性标记化合物和未标记标准物质多次进样,计算两者峰面积比值,推算含量。放射性标记物质量少,价格昂贵,操作不便,因此对已经拥有标准物质的化合物而言,这可能是最接近真实值的化学纯度检测方法,样品用量小,可以回收。为了避免在操作过程中发生放射性物质的分解变质,一般情况下不要求检测高比活度氚标记物质的化学纯度。高比活度氚标记物质一般在毫克级范围,在高浓度、高比活度的放射性标记物在溶液中可能由于其自身放射性辐射导致分解变质。幸运的是真正用高比活度氚标记化合物的试验较少。如果必须检测化学纯度,可加入一定量的未标记化合物,降低放射性药物的比活度后再进行检测。
2.3 放射性活度及比活度检测放射性活度(radioactivity)是指放射性元素或同位素每秒衰变的原子数。放射性活度的国际单位制单位是贝克(Bq),常用单位有居里(Ci)、脉冲计数率(每分钟计数CPM或每秒钟计数CPS)、衰变数(每分钟衰变数DPM或每秒钟衰变数DPS)等。20世纪60年代以后,随着液体闪烁计数(liquid scintillation count,LSC)技术的发展,解决了氚的放射性活度测量问题,此后3H和14C标记化合物的制备与应用进入了快速发展阶段。3H和14C标记化合物的放射性活度一般用LSC仪检测。测定时待测样品和闪烁液以一定比例混合,闪烁液主要由溶剂和闪烁剂组成,特殊情况下也可加入其他试剂以提高检测效率。多年来人们在闪烁液各组分的筛选、研制、开发配方方面做了很多尝试,现在有很多高效率的市场化产品可供选择。LSC仪检测,3H测量效率高于60%,14C最大测量效率可达95%以上。此外,还有加速器质谱(accelerator mass spectrometry,AMS)作为拥有广阔应用前景的科技手段,对3H和14C的放射性检测灵敏度高,检测限达nCi到mCi范围,也可减少放射性废物。
放射性比活度(specific activity,S.A.)是指化合物单位质量的放射性活度(如mCi·mg-1),或每摩尔(或毫摩尔)物质中的放射性活度(Ci·mmol-1或mCi·mmol-1)。放射性核素标记化合物一般都是标记分子和未标记分子的混合物。比活度高,有利于尽量接近生理状态下的生物示踪研究,比活度越高,分析灵敏度就越高,检测限越低。制备高比活度标记化合物时一般都在微量水平操作,因此会对标记合成、分离纯化、后期质量研究等方面带来诸多困难。3H和14C标记化合物最常用的比活度检测方法是配制一定浓度的放射性标记化合物,用LSC仪测量其放射性活度,计算出单位质量或物质的量中放射性活度即可,此数据也能体现化合物的化学纯度。还有一种方法是放射性HPLC(radio-HPLC),放射性色谱图上采用归一化方法计算放射性标记化合物的放射性活度在总进样量中的比例,此数据也可用于放化纯度测算。高比活度3H或14C标记化合物的质谱检测数据也可用于其比活度计算,方法数据精密可靠,但其数据不能用于化学纯度校正和计算。此外,3H-NMR数据也可用于氚标记化合物的比活度测量。
较为典型的例子,如Kovalainen等[34]在钯碳催化剂作用下用氚气作为氚源,合成一种与抗雌性激素受体结合点密切相关物质DPPE的氚标记化合物([3H]-DPPE),用4种不同方法测定、计算,并相互比较后才确定其比活度。结果表明,LSC和radio-HPLC测定比活度分别为37.7 Ci·mmol-1和27.7 Ci·mmol-1。1H偶联3H-NMR和反门控1H去偶3H-NMR测定结果分别为30.7 Ci·mmol-1和30.3 Ci·mmol-1。还提供了2种3H-NMR测定的数据计算详尽过程,见表 5。出现较高比活度的原因(如LSC测定结果为37.7 Ci·mmol-1),文章分析认为在非质子溶剂(如乙酸乙酯、二甲基甲酰胺和LiAIT4)中用游离二乙醇胺作为前导物导致比活度检测结果差异。
|
|
表 5 根据NMR数据计算[3H]DPPE比活度 Table 5 Calculations S.A. for [3H]-DPPE based on NMR data |
放射性化学纯度(放化纯度,radiochemical purity,RP),是指在一种放射性样品中,以某种特定的化学形态存在的放射性核素占总放射性核素的百分数。
放化纯度=(特定化合物的放射性活度/样品总放射性活度)×100%
放射性同位素标记化合物的放化纯度通常用放射性-薄层板联合(Radio-TLC)方法或高效液相色谱与放射性检测器联合(HPLC-LSC)检测方法。上述2种方法各自都有人工收集馏分和在线(on-line)检测方法。人工收集馏分的检测方法比较费时、耗工,而在线检测方法简便,但设备昂贵,配置复杂。Radio-TLC方法是在一定条件下用薄层板分离已经纯化的化合物,分别人工挖取薄层板上的所有相应斑点,用适当溶剂溶解,提取,过滤,再用LSC仪检测,计算总放射性活度中目标化合物的所占比例,或直接用放射性扫描仪扫描获得放化纯度。如折冬梅等[35]在14C标记合成杀菌剂氟吗啉时,14C标记产物的放化纯度用放射性薄层扫描法检测,结果表明放射性产物只有1个,标记产物放化纯度为97.8%,可满足后续示踪研究需要,其放射性薄层扫描图见图 16。
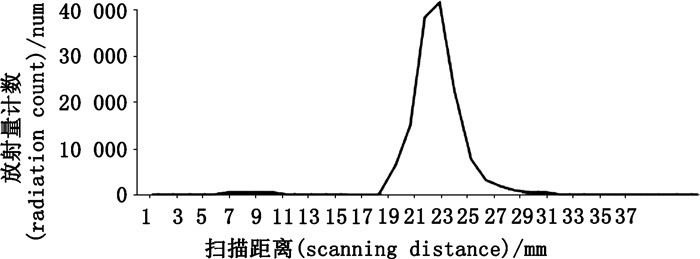
|
图 16 [14C]-氟吗啉放射性薄层扫描图 Figure 16 Radio-TLC chromatogram of [14C]-flumorph |
HPLC-LSC方法是在一定条件下采用HPLC分离已经纯化的化合物,采用在线放射性检测器检测,计算总放射性活度中目标化合物放射性活度所占比例。或采用人工间隔一段时间收集HPLC馏分,用LSC仪检测每个时间点的放射性活度,计算目标化合物放射性活度在总放射性活度中所占比例。如Agrawal等[28]制备氚标记NADPH时,将获得的反应产物用HPLC分离纯化,再用配有放射性检测器的在线HPLC(HPLC-LSC联用)分析其放化纯度,放化纯度超过99.2%,其色谱图见图 17。
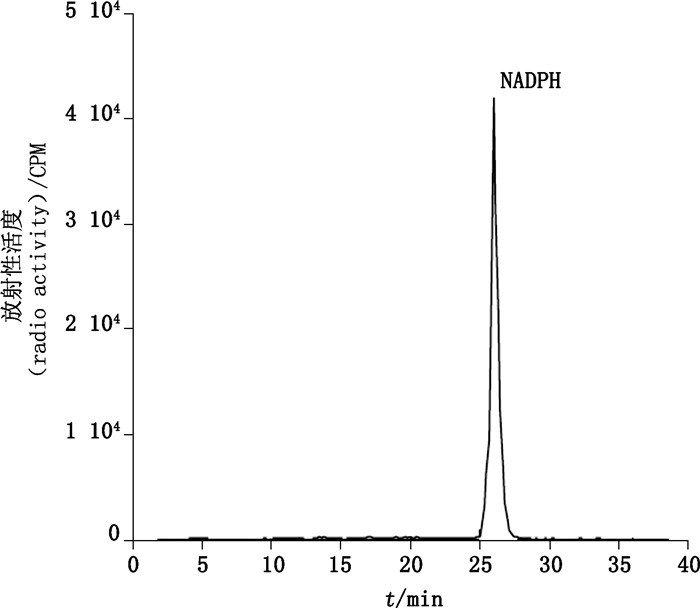
|
图 17 纯化后R-[4-3H]NADPH的HPLC色谱图 Figure 17 HPLC radiochromatogram of the purified R-[4-3H]NADPH |
斯琴朝克图[14]在制备氚标记喹赛多研究中采用人工收集馏分检测方法。将氚标记喹赛多用HPLC分离,收集每0.5 min的流动相,分别置于LSC仪检测,以放射性活度(DPM)为纵轴,分离时间(min)为横轴,绘制折线散点图,根据曲线采用归一化法计算产品放化纯度,结果表明放化纯度99.0%以上,其色谱图见图 18。在资金不足、仪器设备落后的实验室里仍可用此方法协助完成放射性同位素标记化合物的放化纯度检测工作,结果同样可靠。
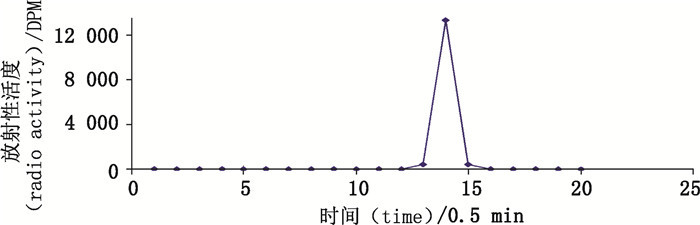
|
图 18 分离纯化后的[3H]-CYX的HPLC-LSC色谱图 Figure 18 HPLC-radiochromatogram of separated [3H]-CYX |
放射性同位素在药物分子上的标记位置直接影响此药物在后续示踪研究中的研究目的和试验结果。放射性同位素标记位置可能会受到反应机理、分子重构和同位素交换机理等因素影响[36]。标记位置一般可由合成路线中逻辑推理即可确定[12],如卤素-氚交换反应中的卤素位置即标记位置,氚加成反应中双键所在位置即标记位置,14C标记药物的标记位置由14C标记前导物决定等。但有些反应过程中可能会发生标记位置的变化,或有些药物在标记合成过程中无法完全判断反应路线的具体标记途径,从而导致对放射性同位素标记位置的无法确证情况,此时可借助于13C-NMR和3H-NMR等设备加以确证。如Hesk等[37]在标记合成[3H]-SCH 466036的报道中详细描述了对产物标记位置确证过程,其合成路线和标记位置见图 19。根据作者3H-NMR图谱解析说明,51%的氚元素出现在2-氨基吡啶环的预期位置6位上,另外43%的氚元素标记在哌啶环上,而剩余6%的氚元素标记在单取代环邻位的哌啶氮上。[3H]-SCH 466036的1H-NMR和3H-NMR图谱见图 20。
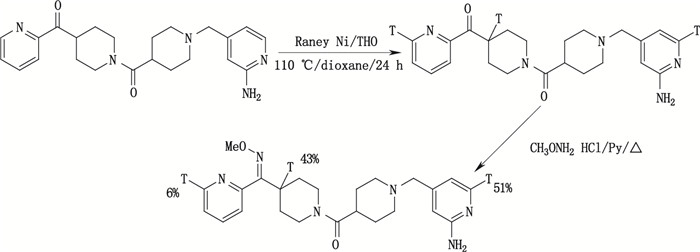
|
图 19 [3H]-SCH 466036合成路线 Figure 19 Synthetic routeof [3H]-SCH 466036 |
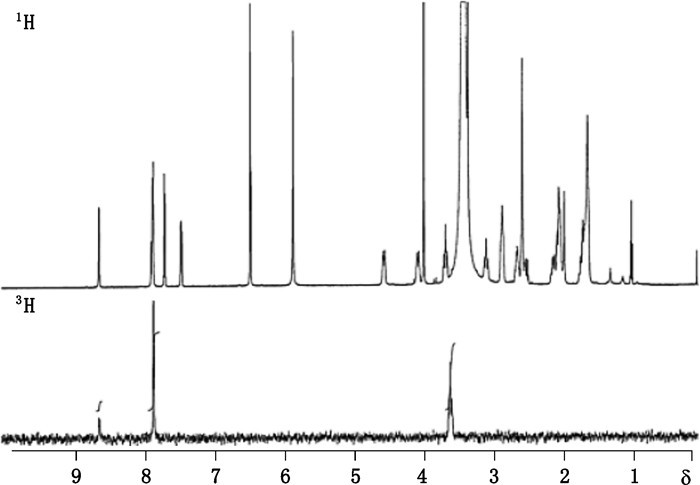
|
图 20 [3H]-SCH 466036的1H-NMR和3H-NMR图谱 Figure 20 1H-NMR and 3H-NMR of [3H]-SCH 466036 |
另外,Filer等[38]氚标记合成了一种多巴胺受体的配体麦角乙脲[(-)-lisuride]的相应氚标记物质,用麦角乙脲的溴化物作为前导物,经催化氚化成功获得目标产物。麦角乙脲及其溴化物和氚标记化合物的结构见图 21,采用[3H]-NMR对氚标记产物进行了标记位置的确定。图 22中[3H]-NMR图谱表明,化合物1b的唯一3H原子标记在化合物分子中的吲哚的2位,试验获得的氚标记化合物1b完全符合后续示踪研究需要。
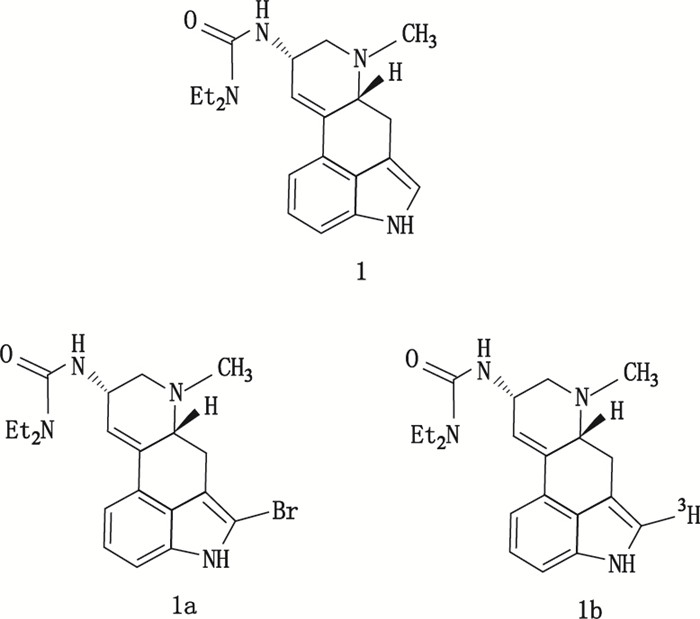
|
图 21 麦角乙脲(1)及其溴化物(1a)、氚标记物(1b)结构 Figure 21 Structures of(-)-lisuride (1)and its oromo precursor (1a), tritium labeled compound (1b) |
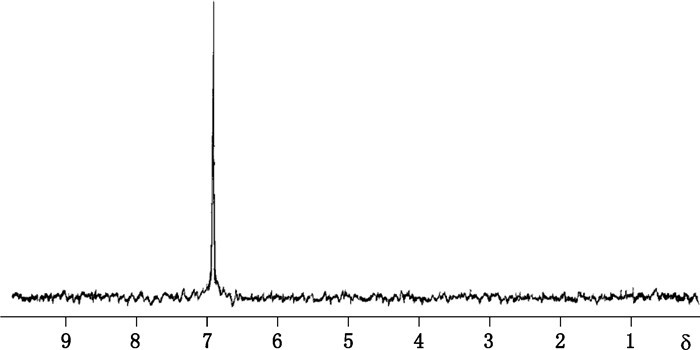
|
图 22 氚标记产物1b的[3H]-NMR(CD3OD)图谱 Figure 22 [3H]-NMR (CD3OD) spectrum of tritium labeled compound 1b |
放射性同位素示踪方法在医学领域和食品安全领域应用范围极广,发展也很快,国内正在受到广泛关注和重视。用放射性同位素示踪试验可研究物质代谢的各种问题,如药物代谢途径、转变的速率、代谢产物在体内的分布,以及激素、维生素等在体内重要代谢产物的定量测定,配体和受体结合位点确证等。放射性同位素示踪方法是新药开发研究以及药物残留研究中不可或缺的实验手段,可用于生物化学研究、酶促反应机制研究和环境科学领域研究,并可以揭示生物合成途径,阐明有机反应机制,是生命科学领域非常重要的检测技术。本文介绍了3H和14C标记药物的制备工艺设计、标记物来源、合成制备方法,较为详细探讨了3H和14C标记药物的质量控制方法和正在使用和发展的检测手段,并举例说明了相关研究手段和应用方法。
【致谢:本文是在毛清黎教授主持的国家自然科学基金面上项目(编号31370691)支持下完成的,在此表示衷心感谢!】
| [1] |
HANSEN PE. Isotope effect on chemical shifts in hydrogen——bonded systems[J]. J Label Compd Radiopharm, 2007, 50(11-12): 967. DOI:10.1002/(ISSN)1099-1344 |
| [2] |
MAHMUD T. Isotope tracer investigations of natural products biosynthesis:the discovery of novel metabolic pathways[J]. J Label Compd Radiopharm, 2007, 50(11-12): 1039. DOI:10.1002/(ISSN)1099-1344 |
| [3] |
CLELAND WW. The use of isotope effects to determine enzyme mechanisms[J]. Arch Biochem Biophys, 2005, 433(1): 2. DOI:10.1016/j.abb.2004.08.027 |
| [4] |
FITZPATRICK PF. Insights into the mechanisms of flavoprotein oxidases from kinetic isotope effects[J]. J Label Compd Radiopharm, 2007, 50(11-12): 1016. DOI:10.1002/(ISSN)1099-1344 |
| [5] |
HOFF RH, HENGGE AC. The use of isotopes in the study of reactions of acyl, phosphoryl, and sulfurylesters[J]. J Label Compd Radiopharm, 2007, 50(11-12): 1026. DOI:10.1002/(ISSN)1099-1344 |
| [6] |
LLOYD-JONES GC, MUÑOZ MP. Isotopic labelling in the study of organic and organometallic mechanism and structure:an account[J]. J Label Compd Radiopharm, 2010, 50(11-12): 1072. |
| [7] |
GERARD P. Applications of deuterium isotope effects to probing aspects of reactions involving oxidative addition and reductive elimination of H-H and C-H bonds[J]. J Label Compd Radiopharm, 2007, 50(11-12): 1088. DOI:10.1002/(ISSN)1099-1344 |
| [8] |
WESTAWAY KC. Determining transition state structure using kinetic isotope effects[J]. J Label Compd Radiopharm, 2010, 50(11-12): 989. |
| [9] |
朱建华, 沈鸣华. 核药学概论[M]. 上海: 复旦大学出版社, 2002. ZHU JH, SHEN MH. Introduction of Nuclear Pharmacy[M]. Shanghai: Fudan University Press, 2002. |
| [10] |
LEE HN, YANG SD, KIM WH, et al. Separation of 3H, 14C, 32P, 35S, 125I, and 131I in radioisotope waste[J]. J Radioanal Nucl Chem, 2010, 284(3): 527. DOI:10.1007/s10967-010-0515-7 |
| [11] |
ELSINGA PH. Radiopharmaceutical chemistry for positron emission tomography[J]. Adv Drug Deliv Rev, 2002, 62(11): 1031. |
| [12] |
VOGES R, HEYS JR, MOENIUS T. Preparation of compounds labeled with tritium and carbon-14[J]. Wiley, 2009, 26(5): 645. |
| [13] |
SALJOUGHIAN M, WILLIAMS PG. Recent developments in tritium incorporation for radiotracer studies[J]. Curr Pharm Des, 2000, 6(10): 1029. DOI:10.2174/1381612003399969 |
| [14] |
斯琴朝克图. 氚标记喹赛多的制备及其在大鼠和鸡体内处置研究[D]. 武汉: 华中农业大学, 2011 HARNUD S. The Synthesis of Tritium Labeled Cyadox and Its Disposition in Rats and Chicken[D]. Wuhan: Huazhong Agricultural University, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10504-1016151562.htm |
| [15] |
MATLOUBI H, GHANDI M, ZARRINDAST MR, et al. Modified synthesis of 11-[14C]-clozapine[J]. Appl Radiat Isot, 2001, 55(6): 789. DOI:10.1016/S0969-8043(01)00134-8 |
| [16] |
MARATHE PH, SHYU WC, HUMPHREYS WG. The use of radiolabeled compounds for ADME studies in discovery and exploratory development[J]. Curr Pharm Des, 2004, 10(24): 2991. DOI:10.2174/1381612043383494 |
| [17] |
SIDOROV GV, ZVERKOV YB, MYASOEDOV NF. Isotope exchange of azidothymidine with tritium[J]. Radiochemistry, 2003, 45(1): 87. DOI:10.1023/A:1022385922249 |
| [18] |
SHEVCHENKO V, NAGAEV I, MYASOEDOV N. Optimization of conditions for tritium labeling of organic compounds by isotope exchange with tritium water, based on the concepts of reactions on the catalyst surface[J]. Radiochemistry, 2005, 47(4): 403. DOI:10.1007/s11137-005-0110-x |
| [19] |
MIASOEDOV NF, KUZNETSOVA OB, KOZIK VS. Biosynthesis of tritium-labeled S-adenosyl-L-methionine in yeast cells[J]. Bioorg Khim, 1985, 11(7): 944. |
| [20] |
REN S, HESK D, MCNAMARA P, et al. Syntheses of 3H-labeled, 14C-labeled, and 2H4-labeled SCH 444877, phosphodiesterase type 5 inhibitors[J]. J Label Compd Radiopharm, 2013, 56(9-10): 480. DOI:10.1002/jlcr.v56.9-10 |
| [21] |
EGAN JA, LASETER AG, FILER CN. Tritium labelling and characterization of the antimalarial drug (+/-)-chloroquine by several methods[J]. Appl Radiat Isot, 2002, 57(3): 343. DOI:10.1016/S0969-8043(02)00117-3 |
| [22] |
KOVALAINEN JT, MORIMOTO H, WILLIAMS PG, et al. Synthesis of a tritium labelled antihistaminic drug[3H]-N, N-diethyl-2-[4-(phenylmethyl)phenoxy]-ethaneamine·HCl[J]. J Label Compd Radiopharm, 1995, 36(12): 1147. DOI:10.1002/jlcr.v36:12 |
| [23] |
BAGSHAW CR. Kinetic Isotope Effects[J]. Springer Berlin Heidelberg, 2013, 3(236): 1200. |
| [24] |
PAAREN HE, FIVIZZANI MA, SCHNOES HK, et al. Preparation of tritium-or deuterium-labeled vitamin D analogs by a convenient general method[J]. Proc Nat Acad Sci USA, 1981, 78(10): 6173. DOI:10.1073/pnas.78.10.6173 |
| [25] |
EGMOND MR, VLIEGENTHART JFG, BOLDINGH J. Synthesis of ⅱ(n-8) ls, tritium-labelled linoleic acid[J]. Biochim Biophys Acta, 1973, 316(1): 1. |
| [26] |
HESK D, BORGES S, HENDERSHOT S, et al. Synthesis of 3H, 2H4, and 14C-SCH 417690(vicriviroc)[J]. J Label Compd Radiopharm, 2016, 59(5): 190. DOI:10.1002/jlcr.v59.5 |
| [27] |
MATLOUBI H, SHAFIEE A, SAEMIAN N, et al. Synthesis of carbon-14 analogue of 1, 5 diaryl-5-[14C]-1, 2, 3-triazoles[J]. Appl Radiat Isot, 2004, 60(5): 665. DOI:10.1016/j.apradiso.2003.12.003 |
| [28] |
AGRAWAL N, KOHEN A. Microscale synthesis of 2-tritiated isopropanol and 4R -tritiated reduced nicotinamide adenine dinucleotide phosphate[J]. Anal Biochem, 2003, 322(2): 179. DOI:10.1016/j.ab.2003.08.012 |
| [29] |
ICHINOSE K, LEEPER FJ, BATTERSBY AR. Preparation of[4R-3H]NADH, [4R-3H]NADPH and the corresponding 4S-isomers all with substantial specific activities[J]. J Chem Soc, Perkin Trans, 1993, 11(11): 1213. |
| [30] |
PARNES H, KECZER SD. Microscale synthesis of volatile, 14C-labelled acid chlorides[J]. J Label Compd Radiopharm, 2010, 22(3): 287. |
| [31] |
FILER CN. Isotopic fractionation of organic compounds in chromatography[J]. J Label Compd Radiopharm, 1999, 42(2): 169. DOI:10.1002/(ISSN)1099-1344 |
| [32] |
HEYS JR. High performance liquid chromatographic studies of pH dependence in the isotopic fractionation of deuterated benzazepines[J]. J Chromatogr A, 1987, 407: 37. DOI:10.1016/S0021-9673(01)92602-0 |
| [33] |
HONG B, KOHEN A. Microscale synthesis of isotopically labeled 6R-N5, N10-methylene-5, 6, 7, 8-tetrahydrofolate[J]. J Label Compd Radiopharm, 2010, 48(10): 759. |
| [34] |
KOVALAINEN JT, MORIMOTO H, WILLIAMS PG, et al. Synthesis of a tritium labelled antihistaminic drug[3H]-N, N-diethyl-2-[4-(phenylmethyl)phenoxy] -ethaneamine·HCl[J]. J Label Compd Radiopharm, 1995, 36(12): 1147. DOI:10.1002/jlcr.v36:12 |
| [35] |
折冬梅, 曲哲, 黄啟良, 等. 杀菌剂氟吗啉的14C标记合成[J]. 核农学报, 2007, 21(2): 206. SHE DM, QU Z, HUANG QL, et al. Preparation of C-14 labeled flumorph[J]. J Nucl Agric Sci, 2007, 21(2): 206. |
| [36] |
FILER CN. The analysis of 14C and 3H labeled compounds[J]. Appl Radiat Isot, 1988, 39(6): 530. |
| [37] |
HESK D, BORGES S, DUMPIT R, et al. Synthesis of 3H, 13C, 2H3, 15N and 14C-labelled SCH 466036, a histamine 3 receptor antagonist[J]. J Label Compd Radiopharm, 2015, 58(2): 36. DOI:10.1002/jlcr.v58.2 |
| [38] |
FILER CN, HAINLEY C, NUGENT RP. Tritiation of dopaminergic ligands (-)-lisuride and (+/-)-nomifensine[J]. J Radioanal Nucl Chem, 2006, 267(2): 345. DOI:10.1007/s10967-006-0053-5 |
 2018, Vol. 38
2018, Vol. 38 
