2. 江苏嘉逸医药有限公司, 南京 211106
2. Jiangsu Jiayi Pharmaceutical Co., Ltd., Nanjing 211106, China
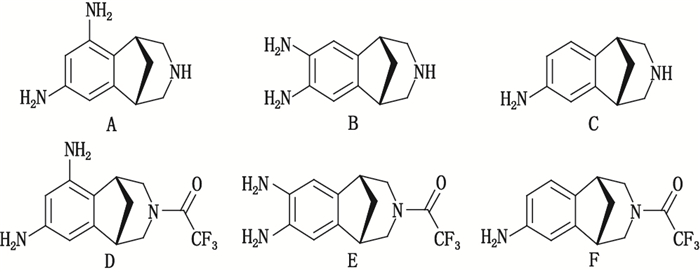
酒石酸伐尼克兰(varenicline tartrate,图 1,商品名Champix),是一种α4β2乙酰胆碱受体的部分激动剂[1],临床用于成人戒烟。酒石酸伐尼克兰的合成路线见图 1,其中化合物E(2,3,4,5-四氢-3-(三氟乙酰基)-1,5-甲桥-1H-3-苯并氮杂䓬-7,8-二胺)为合成酒石酸伐尼克兰的起始原料,可能因残留或未完全脱三氟乙酰基保护最终于原料药中形成杂质A(2,3,4,5-四氢-1,5-甲桥-1H-3-苯并氮杂䓬-6,8-二胺)、杂质B(2,3,4,5-四氢-1,5-甲桥-1H-3-苯并氮杂䓬-7,8-二胺)、杂质C(2,3,4,5-四氢-1,5-甲桥-1H-3-苯并氮杂䓬-7-胺)、杂质D(2,3,4,5-四氢-3-(三氟乙酰基)-1,5-甲桥-1H-3-苯并氮杂䓬-6,8-二胺)、杂质E(化合物E)和杂质F(2,3,4,5-四氢-3-(三氟乙酰基)-1,5-甲桥-1H-3-苯并氮杂䓬-7-胺)(图 2),它们均含有基因毒性警示结构苯胺基团,具有潜在基因毒性[2-3]。欧洲药品管理局(EMEA)、美国食品药品管理局(FDA)及人用药品注册技术要求国际协调会(ICH)先后颁布了基因毒性杂质控制的指导文件,推荐以毒理学关注阈值(TTC,1.5 μg·d-1)来控制用药风险[4-6]。

|
图 1 酒石酸伐尼克兰的合成路线 Figure 1 The synthetic route of varenicline tartrate |
|
图 2 酒石酸伐尼克兰中类苯胺基因毒性杂质的化学结构 Figure 2 Chemical structures of aniline-like genotoxic impurities in varenicline tartrate |
2015年ICH M7附录[7]中明确规定,苯胺及苯胺盐酸盐类基因毒性杂质的日暴露量(PDE)限度为720 μg。但本品的6个类苯胺基因毒性杂质因结构相似,可能具有协同的基因毒性作用,故根据EMEA建议,以TTC 1.5 μg·d-1作为其“限度和”[8]开展本研究。按酒石酸伐尼克兰口服剂量2 mg·d-1计算,6个基因毒性杂质的限度和不超过1.5 μg·d-1时,可达到ICH M7的要求。
酒石酸伐尼克兰质量研究文献主要涉及其有关物质或降解产物[9-12]的定性定量研究,未见其基因毒性杂质的研究报道,也未见类似结构的类苯胺基因毒性杂质和多通道同时检测的相关报道。本研究建立了酒石酸伐尼克兰中6个类苯胺基因毒性杂质(杂质A~F)同时定量限度检查的LC-MS测定法,可为酒石酸伐尼克兰的工艺和质量控制提供参考依据。
1 仪器与试药Dionex Ultimate 3000高效液相色谱仪(Thermo Fisher Scientific公司),TSQ Quantum Ultra三重四极杆质谱仪(配有LC-QUANTM 2.9QF1定量处理软件,Thermo Fisher Scientific公司),Inertsil ODS-SP色谱柱(250 mm × 4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶;GL Sciences公司),BS 21S分析天平(Satrious公司)。
酒石酸伐尼克兰原料药(批号AFN160801、AFN160802、AFN160901,纯度均 > 99.0%,江苏嘉逸有限公司)、基因毒性杂质A~F(纯度均 > 99.0%,江苏嘉逸有限公司);乙腈(色谱纯,TEDIA公司);醋酸铵、甲酸、氨水(分析纯,南京化学试剂有限公司);二巯基苏糖醇(纯度99%,上海麦克林生化科技有限公司);自制去离子水。
2 方法与结果 2.1 色谱-质谱条件 2.1.1 色谱条件采用Inertsil ODS-SP色谱柱(250 mm×4.6 mm,5 μm),以[0.1%醋酸铵-0.005%甲酸水溶液(pH 6.0)]-乙腈(95:5)为流动相A,乙腈为流动相B,线性梯度洗脱[0 min,A-B(100:0)→5 min,A-B(100:0)→15 min,A-B(10:90)→17 min,A-B(10:90)→17.5 min,A-B(100:0)→24 min,A-B(100:0)],流速1 mL·min-1,柱温40 ℃,自动进样20 µL,柱后分流(7:3)进行LC-MS/MS测定。
2.1.2 质谱条件采用电喷雾正离子化(ESI+)测定6个类苯胺基因毒性杂质,优化后的参数如下:喷雾电压3 kV,雾化温度100 ℃,毛细管温度350 ℃,鞘气压力241 kPa,辅助气压力34 kPa,吹扫气压力3 kPa。三重四极质谱MRM检测,外标法定量。共分2段进行监测:0~12 min多反应监测杂质A(m/z 190.1→m/z 161.1)、杂质B(m/z 190.1→m/z 144.1)和杂质C(m/z 175.1→m/z 146.1);12~24 min多反应监测杂质D(m/z 286.1→m/z 173.1)、杂质E(m/z 286.1→m/z 156.0)和杂质F(m/z 271.1→m/z 158.0);碰撞氩气压力0.2 Pa,碰撞能量均为18 eV。
2.2 溶液制备 2.2.1 稀释溶剂含5 mmol·L-1二巯基苏糖醇的0.1%醋酸铵缓冲液(1%氨水调节pH至7.0)-乙腈(95:5)。
2.2.2 杂质对照溶液取杂质A~F各约5 mg,精密称定,分别置10 mL量瓶中,加乙腈-水(9:1)溶解并稀释至刻度,摇匀,制成每1 mL中各约含0.5 mg的杂质对照品储备液。精密移取各杂质对照品储备液0.2 mL置同一10 mL量瓶中,加乙腈-水(9:1)稀释至刻度,摇匀,制成每1 mL中含各杂质均约为10 μg的杂质混合溶液(现配现用),精密移取该混合溶液0.1 mL于10 mL量瓶中,用稀释溶剂稀释至刻度,摇匀,即得每1 mL中含杂质A~F均约100 ng的溶液,作为杂质对照溶液。
2.2.3 供试品溶液取酒石酸伐尼克兰约8 mg,精密称定,置于10 mL量瓶中,加约5 mL稀释溶剂溶解,并加入1%氨水溶液0.5 mL(调节pH至约7.0),再加稀释溶剂至刻度,摇匀,即得每1 mL中含酒石酸伐尼克兰约为0.8 mg的溶液,作为供试品溶液。
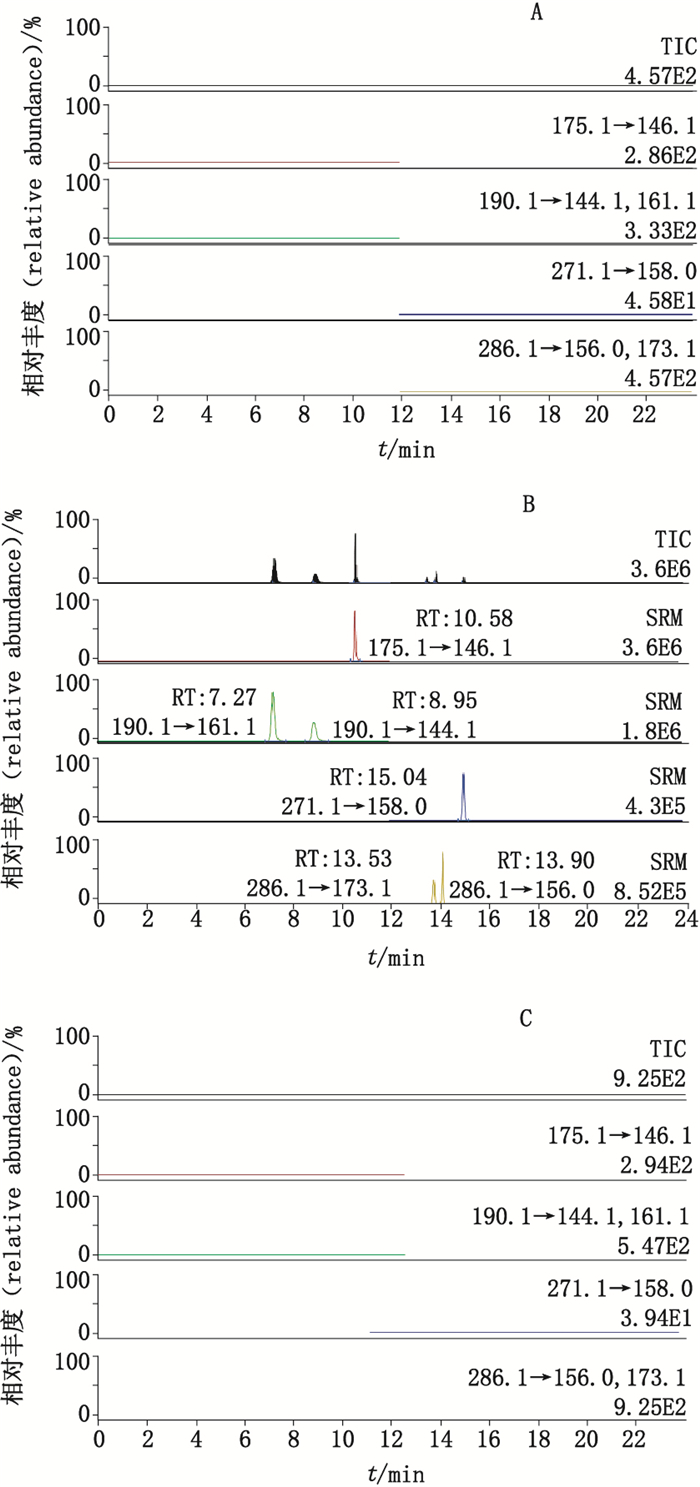
2.3 专属性试验在所建立的色谱和质谱条件下,杂质A~F的保留时间分别为7.27、8.95、10.58、13.53、13.90和15.04 min,6个基因毒性杂质完全分离,峰形良好。空白溶剂、辅料和主成分对各杂质的检查无干扰(图 3)。
|
A.空白溶剂(blank) B.杂质对照溶液(reference solution) C.供试品溶液(test solution) 图 3 酒石酸伐尼克兰类苯胺基因毒性杂质LC-MS检查专属性试验图 Figure 3 LC-MS chromatograms for specificity test of aniline-like genotoxic impurities in varenicline tartrate |
精密量取“2.2.2”项下杂质混合溶液适量,用稀释溶剂定量稀释制成各杂质的质量浓度均分别约为20、50、75、100、150和200 ng·mL-1(各相当于限度浓度的20%、50%、75%、100%、150%和200%)的系列溶液,照“2.1”项下条件分别进样测定,记录色谱图。以各杂质峰面积(A)对其质量浓度(C,ng·mL-1)进行权重(1/C)线性回归。结果,杂质A~F回归方程:
A=-147 492+142 994C r=0.998 8
A=-509 930+53 449C r=0.997 8
A=486 131+132 327C r=0.998 3
A=-121 695+22 016C r=0.998 6
A=-389 596+20 159C r=0.993 5
A=-127 682+23 791C r=0.995 1
各杂质各浓度点的准确度偏差均不超过15%;表明杂质A~F质量浓度均在20~200 ng·mL-1范围内线性关系良好,外标法进行样品中相应基因毒性杂质的检查的准确度良好。
2.5 检测限和定量限根据中国药典2015年版通则[13]9101中“响应值标准偏差和标准曲线斜率法”计算,杂质A~F的检测限约为15 ng·mL-1,定量限约为45 ng·mL-1。为进一步验证,精密量取“2.2.2”项下杂质混合溶液适量,用稀释溶剂稀释制成含各杂质的质量浓度均约为20 ng·mL-1的对照溶液6份,并进行测定。结果,各杂质峰面积的RSD分别为4.5%、8.7%、2.5%、3.8%、5.3%和12.7%,均小于15%,符合测定灵敏度的要求。
2.6 加样回收率试验取已测定基因毒性杂质含量(均未检出)的样品约8 mg,精密称定,置10 mL量瓶中,用约5 mL稀释溶剂溶解,精密加入“2.2.2”项下杂质混合溶液50、100或150 μL,加1%氨水溶液0.5 mL(调节pH至约7.0),再用稀释溶剂稀释至刻度,摇匀,制得低(50%)、中(100%)、高(150%)浓度的加样供试溶液,每个浓度各3份;照“2.1”项下方法分别进样测定,记录色谱图。另取“2.2.2”项下的杂质对照溶液,同法测定。按外标法以峰面积计算杂质A~F的测得质量浓度,并计算各杂质的回收率。结果,杂质A~F的平均加样回收率(n=9)依次为104.8%、105.2%、106.0%、96.5%、103.0%和94.4%,RSD最大为7.4%。微量基因毒性杂质的限度检查,根据中国药典2015年版通则中有关低含量多组分测定的准确度要求,回收率应该在85%~110%范围[13]9101,861,所以本法准确度良好。
2.7 精密度试验 2.7.1 进样精密度取“2.2.2”项下杂质对照溶液,连续进样6次,计算杂质A~F峰面积的RSD(n=6)分别为2.2%、3.4%、1.3%、4.7%、5.8%和3.2%,表明仪器进样精密度良好。
2.7.2 重复性试验按“2.2.2”项下方法配制杂质对照溶液2份,按“2.6”项下方法制备“中浓度”的加样供试液6份,分别进样测定,按外标法以峰面积计算杂质A~F的测得质量浓度。结果,测得杂质A~F的加样回收率结果(n=6)分别为88.5%、99.4%、96.9%、98.3%、108.8%和98.6%,RSD均不超过5.4%,重复性良好,均符合中国药典2015年版通则9101中0.01%含量水平组分的定量准确度和精密度要求。
2.8 稳定性试验 2.8.1 进样盘(15 ℃)稳定性按“2.6”项下方法制备低、高浓度的加样供试液,和不加样的低、高浓度的对照溶液。分别在0、3、6、10和15 h,照“2.1”项下条件分别进样测定,记录色谱图。各溶液中杂质A~F峰面积的RSD依次为4.0%~5.8%、3.6%~9.1%、0.64%~3.0%、3.0%~7.8%、4.8%~7.3%和6.5%~9.8%,均不超过10%。表明对照溶液和加样供试液在15 ℃放置15 h内,均稳定。
2.8.2 杂质对照品储备液(4 ℃)稳定性取按“2.2.2”项下的方法新鲜配制的各杂质对照品储备液及4 ℃冰箱储存17 d的各杂质对照品储备液适量,分别制成100 ng·mL-1的杂质对照溶液各2份;照“2.1”项下条件分别进样测定,记录色谱图,以现制混合溶液为参比,计算4 ℃冰箱储存17 d后制得的杂质对照溶液的回收率。结果,杂质A~F的回收率分别为104.5%、104.6%、97.5%、94.2%、102.0%和97.5%,均在85%~110%通则规定范围内,表明杂质A~F储备液4 ℃放置17 d稳定。
2.9 样品测定根据上述试验条件,按“2.2”项下方法分别配制杂质对照溶液和供试品溶液,照“2.1”项下条件分别进样测定,记录色谱图,按外标法以峰面积计算各杂质的含量。结果(图 3-C)显示,3批样品中基因毒性杂质A~F均未检出,符合限度要求。
3 讨论 3.1 稳定性条件的选择和优化类苯胺化合物极易氧化降解,所以本品基因毒性杂质检查时,保持供试品溶液中各杂质的稳定是研究的重点和难点。稳定性试验结果表明,在没有稳定剂的情况下,对照溶液中,杂质B和E在连续进样过程中就出现了色谱峰面积显著减小的现象,这与其为邻苯氨基结构,在溶液中接触空气更易被氧化相应。研究试验了二巯基苏糖醇为抗氧化稳定剂,并根据其巯基所需的碱性环境和色谱柱耐受的pH条件,确定采用“含5 mmol·L-1二巯基苏糖醇的0.1%醋酸铵缓冲液(1%氨水调节pH至7.0)-乙腈(95:5)为稀释溶剂”进行对照溶液的制备,从而有效地保障了对照溶液的稳定性。
采用稀释溶剂直接配制样品加样回收率试验溶液时,发现少数基因毒性杂质成分再次呈现不稳定的趋势。探究表明,样品中酒石酸的引入,使溶液pH下降,导致二巯基苏糖醇抗氧化的还原性消失。故,在供试品溶液配制过程中,需额外加入1%氨水溶液0.5 mL(调节pH至约7.0)。
对照溶液和供试品溶液制备方法经优化,均在15 h内稳定,满足分析批样品测定的要求。
3.2 色谱、质谱条件的选择和优化串联质谱MRM检测是基于对特异性母离子和子离子的质荷比进行选择而实现专属和准确定量的方法,在检测的离子反应特征不同的情况下,即使待测组分未达到有效的色谱分离,也不影响定量测定,极大地缩短了样品分析时间。但是,本品中潜在的基因毒性杂质A和B,D和E分别为苯环上氨基邻、间位异构体,质谱检测的离子反应特征相同,所以必须以有效的色谱分离来保证质谱的准确定量。
杂质A~F均为小分子类苯胺有机化合物,极性均较大,因此在反相色谱条件下流动相的pH选择和梯度设置是实现它们色谱分离的关键。在较低pH流动相情况下杂质均以离子状态存在,色谱保留均较弱,不能实现有效分离。本研究采用pH约为6.0的0.1%醋酸铵-0.005%甲酸水溶液作流动相缓冲溶液,乙腈为洗脱调节剂,进行梯度洗脱,在该条件下,类苯胺待测物主要处于游离状态,既增强了色谱保留,又根据保留行为差异实现了分离,还提高了各分析物在ESI条件下的离子化效率,增加了检测灵敏度。
3.3 结论本研究采用LC-MS法实现了6个小分子类苯胺基因毒性杂质同时定量分析,建立的方法专属性好,灵敏度高,选择性强。二巯基苏糖醇的应用提高了供试品溶液的稳定性。本方法已成功应用于酒石酸伐尼克兰中微量类苯胺基因毒性杂质的分析检测,为其生产工艺和质量控制提供了保障。
| [1] |
El-Bagary RI, Abo-Talib NF, Mohamed EW. Novel liquid chromatographic methods for the determination of varenicline tartrate[J]. Talanta, 2015, 146: 83. |
| [2] |
Matveeva OA, Kovaleva EL. Modern approaches to estimating the content of genotoxic impurities in drugs(a review)[J]. Pharm Chem J, 2016, 49(11): 765. DOI:10.1007/s11094-016-1367-4 |
| [3] |
MÜLLER L, MAUTHE RJ, RILEY CM, et al. A rationale for determining, testing, and controlling specific impurities in pharmaceuticals that possess potential for genotoxicity[J]. Regul Toxicol Pharm, 2006, 44(3): 198. DOI:10.1016/j.yrtph.2005.12.001 |
| [4] |
SZEKELY G, MC ADS, GIL M, et al. Genotoxic impurities in pharmaceutical manufacturing:sources, regulations, and mitigation[J]. Chem Rev, 2015, 115(16): 8182. DOI:10.1021/cr300095f |
| [5] |
Munro IC, Renwick AG, Danielewskanikiel B. The threshold of toxicological concern(TTC) in risk assessment[J]. Toxicol Lett, 2008, 180(2): 151. DOI:10.1016/j.toxlet.2008.05.006 |
| [6] |
CPMP/SWP/5199/02 Guidelines on the Limits of Genotoxic Impurities[S].2006
|
| [7] |
ICH M7(R1)Current Step 2 Version, Addendum to ICH M7:Assessment and Control of DNA Reactive(Mutagenic) Impurities in Pharmaceuticals to Limit Potential Carcinogenic Risk[S].2015
|
| [8] |
EMA/CHMP/SWP/431994/2007 Rev.3, Questions and Answers on the 'Guideline on the Limits of Genotoxic Impurities'[S].2010
|
| [9] |
SATHEESH B, KUMARPULLURU S, RAGHAVAN V, et al. UPLC separation and quantification of related substances of varenicline tartrate tablet[J]. Acta Chromatogr, 2010, 22(2): 207. DOI:10.1556/AChrom.22.2010.2.4 |
| [10] |
KADI AA, MOHAMED MS, KASSEM MG, et al. A validated stability-indicating HPLC method for determination of varenicline in its bulk and tablets[J]. Chem Cent J, 2011, 5(1): 30. DOI:10.1186/1752-153X-5-30 |
| [11] |
Satheesh B, Ganesh KKS, Saravanan D. Identification, isolation and characterization of an unknown impurity of varenicline[J]. Sci Pharm, 2012, 80(2): 329. DOI:10.3797/(ISSN)0036-8709 |
| [12] |
Pujeri SS, Khader AMA, Seetharamappa J. Stress degradation studies on varenicline tartrate and development of a validated stability-indicating HPLC method[J]. Sci Pharm, 2011, 80(1): 115. |
| [13] |
中国药典2015年版. 四部[S]. 2015: 9101, 861 ChP 2015.Vol Ⅳ[S].2015:9101, 861 |
 2018, Vol. 38
2018, Vol. 38 
