逍遥丸(浓缩丸)以柴胡、当归、白芍、炒白术、茯苓、炙甘草、生姜和薄荷共8味药材制得,具有疏肝健脾、养血调经之功效,临床多用于肝郁脾虚所致的郁闷不舒、胸胁胀痛、头晕目眩、食欲减退和月经不调[1]。逍遥丸是比较常见的中成药,目前,针对其质量分析方面的研究较少,中国药典仅对芍药苷做了技术规定,成英等[2]也采用HPLC测定逍遥丸中甘草苷、异甘草素和甘草酸的含量,苏兰宜等[3]对逍遥丸中芍药苷、阿魏酸和槲皮素的含量做了研究,易润青等[4]采用毛细管电泳法测定逍遥丸中柴胡皂苷a和柴胡皂苷d的含量,白雁等[5]采用近红外光谱法快速测定逍遥丸中芍药苷的含量,上述研究虽对逍遥丸几个成分做了分析,但不够全面和系统,实用性也不强。
中成药多以几种甚至十几种药材制得,往往是数种药材的活性成分联合发挥作用,单个或部分成分研究无法评价和控制药品质量[6]。中药指纹图谱质量控制方法能直观、全面和系统地反映出药品内在活性成分,对药品质量做出正确的评价,在中药领域应用广泛,药材和制剂的指纹图谱方法已有报道[7-13]。本研究建立了逍遥丸HPLC指纹图谱方法,通过与混合对照品图谱比对,从17个共有峰中指认出6个主要成分,并建立同时测定这6个成分含量的方法,方法准确、快速,灵敏度高,实用性强,可以为评价和控制逍遥丸质量提供参考依据。
1 仪器和材料Waters 2695-2489型高效液相色谱仪(沃特世公司);Agilent TC-C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶;安捷伦公司);EP125SM型电子天平(普利赛斯公司);Thermo Scientific Medifuge台式离心机(赛默飞世尔科技公司);FP240恒温干燥箱(宾得公司);SCQ-168数控加热超声波清洗机(上海声彦超声波仪器有限公司,功率3 000 W);Milli-Q Integral 5超纯水一体化系统(默克密理博公司)。
逍遥丸12批,芜湖张恒春药业有限公司生产,批号分别为1407081(S1)、1411061(S2)、1412131(S3)、1506171(S4)、1509161(S5)、1511031(S6)、1510261(S7)、1603251(S8)、1603261(S9)、1604221(S10)、1605221(S11)、1606121(S12)。
对照品芍药苷(批号110736-201640,含量95.2%)、阿魏酸(批号110773-201313,含量99.6%)、甘草苷(批号111610-201607,含量93.1%)、绿原酸(批号110753-201415,含量96.2%)、甘草酸铵(批号110731-201619,含量93.0%)均购自中国食品药品检定研究院,藁本内酯(批号110825,含量>98%)购自上海融禾医药科技有限公司;对照药材当归(批号120927-201516,为伞形科植物当归Angelica sinensis(Oliv.)Diels干燥根的粉末)、白芍(批号120905,为毛茛科植物白芍Paeonia lactiflora Pall.的干燥根的粉末)、白术(批号120925-201611,为菊科植物白术Atractylodes macrocephala Koidz.的干燥根茎的粉末)、甘草(批号120904-201519,为豆科植物甘草Glycyrrhiza uralensis Fisch.的干燥根和根茎的粉末)、茯苓[批号121117-201509,为多孔菌科真菌茯苓 Poria cocos(Schw.)Wolf干燥菌核的粉末]、柴胡(批号120992-201509,为伞形科植物柴胡Bupleurum chinense DC.的干燥根的粉末)均购自中国食品药品检定研究院;乙腈(默克公司)为色谱纯,水为超纯水,其余试剂(北京化工厂)均为分析纯。
2 方法与结果 2.1 色谱条件采用Agilent TC-C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶),流动相为乙腈(A)-0.2%磷酸水溶液(B),梯度洗脱(0~10 min,3%A;10~20 min,3%A→10%A;20~70 min,10%A→80%A),流速为1.0 mL·min-1,进样量20 μL,检测波长为326 nm(0~27 min,绿原酸)、230 nm(27~30.5 min,芍药苷)、280 nm(30.5~36 min,甘草苷、阿魏酸)、276 nm(36~52 min,甘草酸)、350 nm(52~70 min,藁本内酯),柱温35 ℃。
2.2 溶液的制备 2.2.1 混合对照品溶液分别取绿原酸、芍药苷、甘草苷、阿魏酸、甘草酸、藁本内酯的对照品适量,精密称定,加70%乙醇水溶液制得含绿原酸0.063 mg·mL-1,芍药苷0.010 mg·mL-1,甘草苷0.045 mg·mL-1,阿魏酸0.038 mg·mL-1,甘草酸0.010 mg·mL-1和藁本内酯0.021 mg·mL-1的混合溶液,0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2.2 供试品溶液取样品适量,置干燥箱(85 ℃)中干燥60 min。研细,取细粉约1.0 g,精密称定,置200 mL具塞锥形瓶中,精密加入70%乙醇水溶液100 mL,密塞,称量,超声处理(功率250 W,频率33 kHz)30 min,放冷,再称量,用70%乙醇水溶液补足减失的量,摇匀,0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2.3 对照药材溶液取当归、白芍、白术、甘草、茯苓、柴胡的对照药材适量,精密称定,分别按“2.2.2”项下方法同法操作,即得。
2.3 HPLC指纹图谱的建立 2.3.1 精密度试验取同一批样品(批号1603251)的供试品溶液,连续进样5次,记录色谱图,以甘草酸为参比峰,计算各共有峰相对峰面积的RSD均小于5%,相对保留时间的RSD均小于2%,表明仪器精密度良好。
2.3.2 稳定性试验取同一批样品(批号1603251)的供试品溶液,分别在0、3、6、9、12、24 h进样,记录色谱图,以甘草酸为参比峰,计算各共有峰相对峰面积的RSD均小于4%,相对保留时间的RSD均小于2%,结果表明供试品溶液在24 h内稳定。
2.3.3 重复性试验取同一批样品(批号1603251)6份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进行分析,记录色谱图,以甘草酸为参比峰,计算各共有峰相对峰面积的RSD均小于5%,相对保留时间的RSD均小于2%,结果表明方法重复性良好。
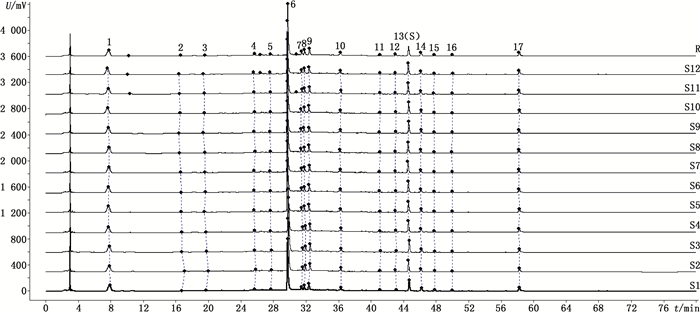
2.3.4 指纹图谱的建立及相似度评价取逍遥丸(浓缩丸)12批(S1~S12),按照“2.2.2”项下方法制备供试品溶液,依“2.1”项下色谱条件进行测定,指纹图谱采用国家药典委员会推荐的《中药色谱指纹图谱相似度评价系统》(2012年版)进行分析,以S1为参考图谱,时间窗宽度设为0.3 min,经全谱匹配共确立17个共有峰,并生成指纹图谱共有模式(平均值法,R)。结果12批供试品相对于共有模式的相似度分别为0.998、0.996、0.993、0.975、0.999、0.995、0.996、0.994、0.990、0.992、0.997、0.995,均大于0.99,说明逍遥丸各批次之间质地均匀。在17个共有峰中,以13号峰的峰面积适中,与相邻峰之间分离完全,对称性较好,故确定13号峰为参照峰(S)。指纹图谱及其共有模式见图 1,共有峰相对峰面积见表 1。
|
图 1 12批逍遥丸HPLC指纹图谱和对照指纹图谱 Figure 1 Fingerprints of 12 batches of Xiaoyao pills and the reference fingerprint |
|
|
表 1 12批样品(S1~S12)共有峰相对峰面积 Table 1 The relative areas of common peaks of 12 samples(S1-S12) |
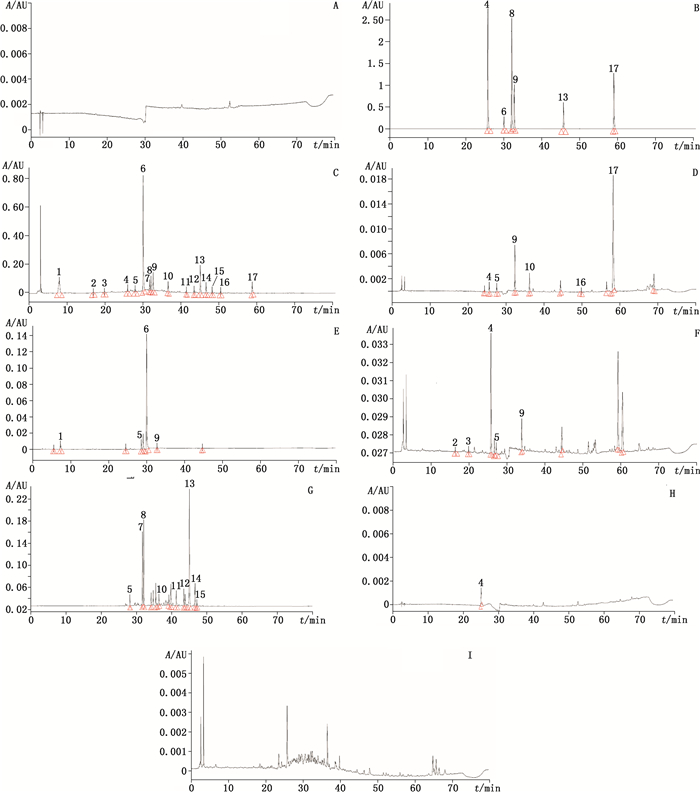
取空白溶剂、混合对照品溶液、供试品溶液及对照药材溶液,按“2.1”项下色谱条件依次进样测定。空白溶剂、对照品、样品和对照药材色谱图见图 2。17个共有峰经与混合对照品和对照药材色谱峰比对分析,可以指认出:峰9、16、17来源于当归,峰1、6、9来源于白芍,峰2、3、9号峰来
|
4.绿原酸(chlorogenic acid)6.芍药苷(paeoniflorin)8.甘草苷(liquiritin)9.阿魏酸(ferulic acid)13.甘草酸(glycyrrhizic acid)17.藁本内酯(ligustilide) A.空白溶剂(solvent blank)B.混合对照品(mixed reference substances)C.样品(sample)D.当归药材(Angelicae Sinensis Radix)E.白芍药材(Paeoniae Radix Alba)F.白术药材(Atractylodis Macrocephalae Rhizoma)G.甘草药材(Glycyrrhizae Radix et Rhizoma)H.茯苓药材(Poria)I.柴胡药材(Bupleuri Radix) 图 2 空白溶剂、混合对照品、样品和对照药材的HPLC图 Figure 2 HPLC chromatograms of solvent blank, mixed reference substances, sample and reference crude drugs |
源于白术,峰8、11、12、13、14、15来源于甘草,4号峰为当归、白术和茯苓共同贡献,5号峰为当归、白芍、白术和甘草共同所有,而7号峰来自于白术和甘草,10号峰来自于当归和甘草;可以确定的化合物有:4号峰为绿原酸,6号峰为芍药苷,8号峰为甘草苷,9号峰为阿魏酸,13号峰为甘草酸,17号峰为藁本内酯。
2.4 逍遥丸中多指标成分定量分析 2.4.1 线性关系的考察分别精密量取混合对照品溶液2、6、12、24、36、48 μL注入液相色谱仪,按“2.1”项下色谱条件进行分析,记录液相色谱图。以各组分色谱峰峰面积(Y)为纵坐标,进样量(X)为横坐标,绘制标准曲线,求得各组分回归方程及相关系数见表 2。
|
|
表 2 峰面积与浓度的线性关系 |
取同一批样品(批号1603251)的供试品溶液,在“2.1”项色谱条件下,连续进样6次,记录色谱图。结果绿原酸、芍药苷、甘草苷、阿魏酸、甘草酸和藁本内酯峰面积的RSD分别为0.26%、0.56%、0.84%、0.79%、0.61%和0.90%,表明仪器精密度良好。
2.4.3 稳定性试验取同一批样品(批号1603251)的供试品溶液,按“2.1”项下色谱条件,分别于0、4、8、12、18、20、24 h进样,记录色谱图。结果绿原酸、芍药苷、甘草苷、阿魏酸、甘草酸和藁本内酯峰面积的RSD分别为1.6%、1.8%、1.6%、1.1%、0.78%和1.0%,表明在24 h内供试品溶液稳定。
2.4.4 重复性试验取同一批样品(批号1603251),按“2.2.2”项方法平行制备6份供试品溶液,按“2.1”项下色谱条件进行测定,记录色谱图。结果绿原酸、芍药苷、甘草苷、阿魏酸、甘草酸和藁本内酯含量分别为12.365、10.387、5.580、5.079、2.016、2.676 mg·g-1,RSD分别为0.98%、1.1%、1.1%、0.78%、0.84%和0.57%,表明本方法重复性良好。
2.4.5 加样回收率试验取同一批样品(批号1603251)干燥细粉0.5 g共6份,精密称定,分别置200 mL具塞锥形瓶中,加入绿原酸、芍药苷、甘草苷、阿魏酸、甘草酸和藁本内酯对照品各适量,按“2.2.2”项下方法制备供试溶液,进样分析,记录色谱图,计算各组分加样回收率,结果见表 3。
|
|
表 3 逍遥丸6种成分的加样回收率结果(n=6) Table 3 Recoveries of six components in Xiaoyao pills |
取逍遥丸供试品溶液,按“2.1”项下色谱条件测定,按外标法分别计算样品中绿原酸、芍药苷、甘草苷、阿魏酸、甘草酸和藁本内酯的含量,结果见表 4。
|
|
表 4 样品测定结果(mg·g-1,n=3) Table 4 Determination results |
研究发现,将逍遥丸预先干燥60 min后,再进行溶液制备,分析所得到色谱图基线噪音较小,色谱信息也较未处理时丰富,峰形和强度也有明显改善和增加,本研究中,样品在制备溶液前均经干燥处理。用甲醇制备样品的溶液时,色谱峰较少,而改用70%乙醇水溶液后,经超声处理(功率250 W,频率33 kHz)30 min,色谱峰较多,各成分也能提取完全。
3.2 色谱条件优化逍遥丸由8味药材制得,成分复杂,各成分化学结构存在差异,分析波长也不尽相同,通过查阅相关文献[2, 14-15],设定检测波长为326 nm(绿原酸)、230 nm(芍药苷)、280 nm(甘草苷、阿魏酸)、276 nm(甘草酸)和350 nm(藁本内酯),利用色谱仪波长变换功能分段实施。在流动相考察方面,先后对甲醇-水系统、甲醇-磷酸盐水系统、乙腈-冰醋酸水系统及乙腈-磷酸盐水系统进行比较,结果以乙腈-0.2%磷酸水溶液系统试验得到色谱峰信号较多,各峰之间分离较好,峰形较佳;而等度洗脱出峰时间过长,在不影响分离度前提下,采用梯度洗脱程序更为合理和经济;柱温对分离度有一定影响,笔者先后考察20、25、30、35、40 ℃等系列柱温,发现当柱温小于35 ℃时,供试品色谱图中存在峰包裹情况,尤其是7、8和9号峰之间难以分离,而当柱温高于35 ℃时各峰分离完全,考虑色谱柱使用寿命,故不考虑以40 ℃作为实验柱温条件。
本研究利用HPLC法,在同一色谱条件下,既建立了逍遥丸指纹图谱,又同时测定了绿原酸、芍药苷、甘草苷、阿魏酸、甘草酸和藁本内酯共6个成分的含量,方法简便快捷,科学实用,同时具备定性和定量两重作用,为有效控制逍遥丸质量提供了科学依据。
| [1] |
中国药典2015年版. 一部[S]. 2015: 1356 ChP 2015. Vol Ⅰ[S]. 2015: 1356 |
| [2] |
成英, 宋九华. HPLC测定逍遥丸中甘草苷、异甘草素和甘草酸的含量[J]. 中国现代应用药学, 2012, 29(2): 163. CHENG Y, SONG JH. Determination of liquiritin, glycyrrhizic acid and isoliquiritigenin in Xiaoyao Wan by HPLC[J]. Chin J Mod Appl Pharm, 2012, 29(2): 163. |
| [3] |
苏兰宜, 尹小英. 反相高效液相色潽法同时检测逍遥丸中芍药苷、阿魏酸和槲皮素的含量[J]. 中国医院药学杂志, 2011, 31(18): 1558. SU LY, YIN XY. Determination of paeoniforin, erulicacid and querceti in Xiaoyao Wan by HPLC[J]. Chin Hosp Pharm J, 2011, 31(18): 1558. |
| [4] |
易润青, 叶秀金, 宋粉云. 毛细管电泳法测定逍遥丸中柴胡皂苷a和柴胡皂苷d的含量[J]. 中药新药与临床药理, 2011, 22(5): 554. YI RQ, YE XJ, SONG FY. Determination of saikosaponin a and saikosaponin d in Xiaoyao pills by capillary electrophoresis[J]. Tradit Chin Drug Res Pharmacol, 2011, 22(5): 554. |
| [5] |
白雁, 李小庆, 雷敬卫. 近红外光谱法快速测定逍遥丸(浓缩丸)中芍药苷含量[J]. 中医学报, 2013, 28(180): 709. BAI Y, LI XQ, LEI JW. Rapid determination of paeoniflorinn in Xiaoyao pills(condensed)by near-infrared spectroscopy[J]. China J Chin Med, 2013, 28(180): 709. |
| [6] |
李强, 杜思邈, 张忠亮, 等. 中药指纹图谱技术进展及未来发展方向展望[J]. 中草药, 2013, 44(22): 3095. LI Q, DU SM, ZHANG ZL, et al. Progress in fingerprint technology on Chinese materia medica and prospect of its future development[J]. Chin Tradit Herb Drugs, 2013, 44(22): 3095. |
| [7] |
程红, 姚志红, 戴毅, 等. 中药复方制剂仙灵骨葆胶囊HPLC指纹图谱研究[J]. 中国药学杂志, 2013, 48(10): 772. CHENG H, YAO ZH, DAI Y, et al. HPLC fingerprint of Xianling Gubao capsules, a TCM prescription[J]. Chin Pharm J, 2013, 48(10): 772. |
| [8] |
李家春, 孙兰, 李红娟, 等. 桂枝茯苓胶囊HPLC指纹图谱研究[J]. 中草药, 2012, 43(7): 1333. LI JC, SUN L, LI HJ, et al. HPLC fingerprint of Guizhi Fuling capsules[J]. Chin Tradit Herb Drugs, 2012, 43(7): 1333. |
| [9] |
何轶, 张聿梅, 鲁静, 等. 西黄丸中指标成分含量测定及挥发性成分指纹图谱的建立[J]. 药物分析杂志, 2016, 36(3): 480. HE Y, ZHANG YM, LU J, et al. Index component determination and the fingerprint chromatography of volatile components in Xihuang pills[J]. Chin J Pharm Anal, 2016, 36(3): 480. |
| [10] |
于桂芳, 闫显光, 殷洪梅, 等. 益心舒片的HPLC指纹图谱[J]. 中国实验方剂学杂志, 2017, 23(1): 69. YU GF, YAN XG, YIN HM, et al. Fingerprint analysis of Yixinshu tablets by HPLC[J]. Chin J Exp Tradit Med Form, 2017, 23(1): 69. |
| [11] |
潘伟东, 杜义龙, 赵胜男, 等. 韩信草的高效液相色谱指纹图谱及化学模式识别[J]. 药物分析杂志, 2015, 35(2): 250. PAN WD, DU YL, ZHAO SN, et al. HPLC fingerprint and chemical pattern recognition of Scutellaria indica[J]. Chin J Pharm Anal, 2015, 35(2): 250. |
| [12] |
张春泥, 王英姿, 孙欣光, 等. HPLC-CAD结合化学计量学的川楝子饮片指纹图谱研究[J]. 药学学报, 2017, 52(3): 456. ZHANG CN, WANG YZ, SUN XG, et al. Chromatographic fingerprint analysis of Toosendan Fructus by HPLC-CAD coupled with chemometrics methods[J]. Acta Pharm Sin, 2017, 52(3): 456. |
| [13] |
杨宁, 刘艳妮, 康杰芳. 山茱萸药材HPLC指纹图谱的优化研究[J]. 药物分析杂志, 2014, 34(11): 1989. YANG N, LIU YN, KANG JF, et al. Optimization of the HPLC fingerprint for Cornus officinalis[J]. Chin J Pharm Anal, 2014, 34(11): 1989. |
| [14] |
王婕, 赵建邦, 宋平顺. 30批当归中阿魏酸、藁本内酯含量测定[J]. 中国实验方剂学杂志, 2011, 17(16): 70. WANG J, ZHAO JB, SONG PS. Determination of ferulic and ligustilide in Angelicae Sinensis Radix from 30 batches[J]. Chin J Exp Tradit Med Form, 2011, 17(16): 70. DOI:10.3969/j.issn.1005-9903.2011.16.020 |
| [15] |
周萃, 杨燕云, 张振秋, 等. 波长切换HPLC法同时测定甘草及其炮制品中7个物质的含量[J]. 药物分析杂志, 2011, 31(11): 2067. ZHOU C, YANG YY, ZHANG ZQ, et al. HPLC with switching wavelength simultaneous determination of seven constituents in licorice and its processed products[J]. Chin J Pharm Anal, 2011, 31(11): 2067. |
 2018, Vol. 38
2018, Vol. 38 