2. 安徽出入境检验检疫局, 合肥 230022
2. Anhui Entry-Exit Inspection and Quarantine Bureau, Hefei 230022, China
蜂蜜为蜜蜂科昆虫中华蜜蜂Apis cerana Fabricius或意大利蜂Apis mellifera Linnaeus所酿的蜜,具有润肠降压,营养心肌,保护肝脏,抗衰养颜,增强免疫力,防止血管硬化的效果[1]。蜂蜜作为一种天然营养食品,近年来需求量迅速增加,天然蜂蜜供不应求,受利益驱动,市售蜂蜜中采用各种低廉的果葡糖浆、麦芽糖浆等掺杂现象时有发生,极大损害了消费者利益。蜂蜜掺假、制假已成为目前蜂产业生产中不容忽视的问题[2-3]。天然蜂蜜中主要营养成分包括碳水化合物、蛋白质、矿物质、维生素和多酚类物质等,其中固体物质有95.0%~99%为糖类,占总成分的70%~80%。葡萄糖和果糖含量占蜂蜜总含量的65%以上,其中,果糖含量在30.9%~44.3%,葡萄糖含量在22.9%~40.8%,果糖与葡萄糖含量比在0.76~1.9[4]。2015年版中国药典规定,蜂蜜中果糖和葡萄糖的总含量不得低于60%,蔗糖和麦芽糖含量分别不得超过5%,且不含五糖及以上寡糖[5]。因此,糖类成分为蜂蜜质量考察的重要指标[6],通过对蜂蜜中糖类化合物的检测可以区分蔗糖或麦芽糖浆等掺假。
对于糖类化合物HPLC定量检测,由于糖类化合物无紫外吸收且为非挥发性物质,因此常用RID和ELSD这2种检测器。电喷雾检测器(CAD)是近年发展起来的一种新型通用检测器,其灵敏度及重现性均优于RID和ELSD[7],已用于药用植物中糖类化合物分析[8]。本文首先采用TLC法对天然蜂蜜和市售蜂蜜进行快速比较分析,以了解天然蜂蜜中糖类成分特征;再利用HPLC-CAD对蜂蜜中的果糖、葡萄糖、蔗糖及麦芽糖进行定量分析,考察天然蜂蜜与市售蜂蜜中糖类成分含量,从糖类成分定性和定量两方面探讨其在评价市售蜂蜜质量中的作用。
1 仪器与试药AS30薄层色谱自动点样仪(迪赛克公司),薄层硅胶板G60(10 cm×20 cm,默克公司),戴安U3000高效液相色谱仪和Corona Ultra RS电喷雾检测器(赛默飞世尔科技公司),Waters氨基分析柱(4.6 mm×250 mm,5 μm;填料:基于亚乙基桥杂化颗粒的三键键合酰胺基;Waters公司),XS105型分析天平(梅特勒-托利多公司),FFD8518型冷冻干燥机(ILShinBioBase公司),YOKO-XR薄层显色加热器(武汉药科新技术开发有限公司),Milli-Q超纯水系统(默克密理博)。
乙腈、硫酸(色谱纯,默克公司),磷酸(纯度85%,默克公司),果糖、葡萄糖、蔗糖及麦芽糖(纯度≥99%,西柯玛公司),茚三酮(分析纯,西柯玛公司),苯胺、二苯胺、香草醛(纯度≥99%,上海阿拉丁生化科技股份有限公司),乙酸(色谱级,≥99%,上海阿拉丁生化科技股份有限公司),正丁醇、异丙醇(分析纯,天津市富宇精细化工有限公司)。
天然蜂蜜(编号W01~W14)共14批,编号为W01~W08的样品采集于广东,编号为W11~W14的样品采集于海南,编号为W09和W10的样品产地未知;市售蜂蜜(编号C01~C14)共14批,购买于珠海大型超市,生产厂家分别来自福建(编号C01)、广东(编号C02、C12)、江西(编号C03~C07)、湖北(编号C08、C09、C13、C14)、安徽(编号C10)和浙江(编号C11)。所有样品备份保存于澳门大学中华医药研究院。
2 方法与结果 2.1 混合对照品储备液制备分别精密称取果糖对照品9.86 mg,葡萄糖对照品10.42 mg,蔗糖对照品9.96 mg,麦芽糖对照品10.25 mg,置10 mL量瓶中,加入Milli-Q超纯水溶解并定容至刻度,摇匀,即得果糖、葡萄糖、蔗糖、麦芽糖混合对照品储备液。
2.2 供试品溶液制备蜂蜜样品采用冷冻干燥机冻干,取蜂蜜约150 mg,置于10 mL量瓶中,加Milli-Q超纯水定容至刻度,摇匀,采用0.22 μm滤膜过滤,即得供试品溶液A,用于TLC分析。取供试品溶液A,加超纯水稀释60倍,即得供试品溶液B,用于HPCL-CAD分析。
2.3 薄层色谱法TLC法参照文献报道方法[9],采用薄层硅胶板,取“2.2”项下供试品溶液A,点样体积4 μL,条带长度8 mm,间距6 mm,起始点样高度10 mm。采用展开剂正丁醇-异丙醇-醋酸-水(7:5:1:2)展样至90 mm,吹干后以苯胺-二苯胺-磷酸(4 mL苯胺、4 g二苯胺、20 mL磷酸溶解于200 mL丙酮)显色,喷显色剂后于105 ℃加热5 min,在可见光下观察拍照。另对在同一TLC分离条件下的相同样品,分别采用硫酸-乙醇(10%硫酸溶解于无水乙醇中)、茚三酮(1.5 g茚三酮、3 mL醋酸溶解于100 mL正丁醇)、香草醛(5 g溶解于10%硫酸-乙醇中)作显色剂,喷雾显色剂后于加热板105 ℃加热5 min,在可见光下观察拍照(见图 1),以选择合适的显色剂。

|
图 1 天然蜂蜜(W01)用苯胺-二苯胺-磷酸(A)、硫酸乙醇(B)、茚三酮(C)及香草醛-硫酸(D)显色的薄层色谱图 Figure 1 TLC chromatograms of wild honey sample (W01) colored with aniline-diphenylamine-phosphoric acid(A), ethanol-sulfuric acid (B), ninhydrin (C), and vanillin-sulfuric acid (D) |
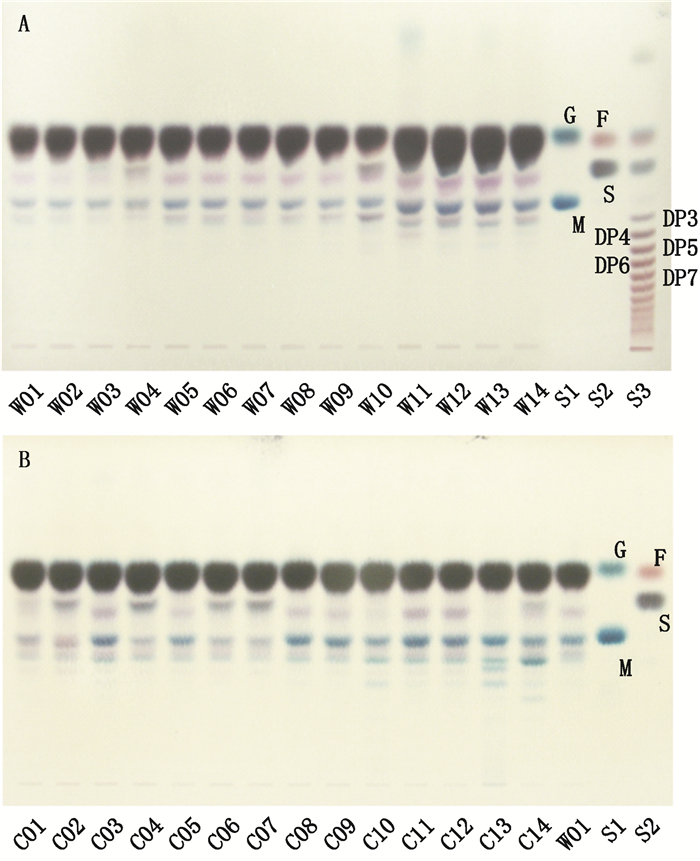
天然采集和市售蜂蜜TLC色谱图见图 2,从图 2可见天然采集蜂蜜一致性较高,具有4个特色条带,由下至上分别为浅蓝、深蓝、粉红和黑色条带。根据对照品的Rf值,可知蜂蜜样品含有较多葡萄糖和果糖,以及少量蔗糖和麦芽糖。虽然α-萘酚显色剂比苯胺-二苯胺-磷酸显色剂更灵敏[10],但苯胺-二苯胺-磷酸显色剂对不同种类糖颜色显色各异,如五碳木糖、阿拉伯糖和鼠李糖显浅棕色,六碳葡萄糖、甘露糖、半乳糖显蓝色,果糖、糖醛酸显红棕色。此外,对低聚糖类也具特征显色,如低聚麦芽糖显蓝色,低聚木糖显浅棕色,低聚果糖显红棕色[10-11]。因此,对商品蜂蜜掺入的糖类化合物具有一定的鉴别作用。此外,采用硫酸-乙醇、茚三酮试剂和香草醛-浓硫酸进行显色以了解蜂蜜中可能存在的其他成分及氨基酸用于鉴别的可能性,但未见较苯胺-二苯胺-磷酸显色更多的特征条带(图 1)。天然采集蜂蜜图谱中未见有低聚糖类条带(图 2),而市售样品C10、C13和C14却具有低聚糖条带,可能是样品中有低聚糖掺杂。
|
S1、S2:对照品(sugar reference substances)S3:果寡糖(fructooligosaccharides)G.葡萄糖(glucose)M.麦芽糖(maltose)F.果糖(fructose)S.蔗糖(sucrose) 图 2 W01~W14天然采集蜂蜜(A)和C01~C14市售(B)蜂蜜薄层色谱图 Figure 2 TLC chromatograms of W01-W14 wild honey samples (A) and C01-C14 commercial honey samples (B) |
采用Waters氨基分析柱(4.6 mm×250 mm,5 μm),以乙腈(A)-水(B)为流动相,二元梯度洗脱(0~10 min,75%B→45%B;10~12 min,45%B→30%B;12~15 min,30%B),流速1 mL·min-1,柱温30 ℃,进样量5 μL,检测器为电喷雾检测器(CAD),N2压力241.325 kPa。
2.4.2 标准曲线的绘制取混合对照品储备液,采用倍比稀释,配制成不同浓度的系列混合对照品溶液,果糖、葡萄糖、蔗糖、麦芽糖浓度范围分别为16.4~493.0、17.4~521.0、0.72~498.0和0.68~512.0 μg·mL-1,各对照品为8个浓度点。按“2.4.1”项下色谱条件进行测定,每个浓度点进样2次,以测得平均峰面积Y的常用对数为纵坐标,对照品质量浓度X(μg·mL-1)的常用对数为横坐标,绘制标准曲线[12],所有待测物的线性关系良好,r > 0.998 1,具体回归方程见表 1。
|
|
表 1 果糖、葡萄糖、蔗糖和麦芽糖线性方程、检测限和定量限 Table 1 Linear regression data, limit of detection (LOD) and limit of quantitation (LOQ) for fructose, glucose, sucrose and maltose |
逐级稀释“2.1”项下的混合对照品储备液,注入液相色谱仪,按“2.4.1”项下色谱条件进行测定,各化合物对应峰高为噪音峰3倍(S/N=3)时糖浓度为该化合物检测限;各化合物对应峰高为噪音峰10倍(S/N=10)时糖浓度作为该化合物定量限。各化合物检测限和定量限分别为0.13~0.22 μg·mL-1和0.46~0.72 μg·mL-1,具体结果见表 1。
2.4.4 精密度试验日内与日间精密度实验为取中间浓度混合对照品溶液,按“2.4.1”项下高效液相色谱条件连续进样6次,以及连续3日每日重复进样2次,以6次测定结果峰面积及保留时间RSD评价方法精密度。各对照品峰面积日内、日间的RSD分别为0.21%~3.4%和1.6%~2.4%(n=6),保留时间日内、日间RSD分别为0.04%~0.09%和0.21%~0.30%(n=6),表明仪器精密度良好,具体结果见表 2。
|
|
表 2 果糖、葡萄糖、蔗糖和麦芽糖日内、日间精密度考察 Table 2 Precision (intra-and inter-day) for fructose, glucose, sucrose and maltose |
取W01蜂蜜原液6份,按“2.2”项下方法溶解、定容制备供试品溶液,再按“2.4.1”项下高效液相色谱条件进样测定,记录4种糖的峰面积,计算含量,果糖、葡萄糖、蔗糖、麦芽糖平均含量(n=6)分别为40.0%、31.6%、1.1%、0.55%,RSD分别为2.1%、2.2%、2.2%、4.9%,表明方法重复性良好。
2.4.6 稳定性试验取重复性试验项下的供试品溶液,分别在放置0、2、4、8、16、24 h后进样测定,各组分峰面积的RSD(n=6)分别为3.2%、2.8%、2.8%和0.43%,表明供试品溶液在24 h内稳定。
2.4.7 加样回收率试验取W01蜂蜜样品约75 mg,置于10 mL量瓶中,共6份,分别加入果糖、葡萄糖、蔗糖和麦芽糖的对照品36.0、35.8、1.1、0.75 mg,按“2.2”项下方法制备HPLC-CAD分析的供试溶液。按“2.4.1”项下高效液相色谱条件进样测定,依回收率=[(测定含量-供试品理论含量)/对照品加入量]×100%;果糖、葡萄糖、蔗糖和麦芽糖加样回收率(n=3)为87.0%~112.8%,RSD为0.75%~6.1%,结果见表 3。
|
|
表 3 果糖、葡萄糖、蔗糖和麦芽糖重复性、稳定性和回收率考察结果 Table 3 Repeatability, stability and recovery for fructose, glucose, sucrose and maltose |
取混合对照品溶液及供试品溶液进样测定,对照品及天然采集和市售蜂蜜代表性HPLC-CAD图谱见图 3,样品中代表性糖类化合物含量见表 4。结果显示:与TLC分析结果相似,葡萄糖和果糖为蜂蜜中主要糖类化合物。天然采集的蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量分别为43.5%~53.5%、41.3%~50.3%、0.41%~6.6%和0.64%~1.8%,平均值分别为(47.3±2.9)%、(46.2±2.9)%、(1.9± 1.5)%和(1.1±0.3)%;市售蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量分别为45.4%~54.3%、41.0%~50.3%、0.12%~2.8%和0.08%~1.6%,平均值分别为(48.8±2.8)%、(45.5±2.7)%、(1.5±0.85)%和(0.84±0.59)%。天然采集蜂蜜和市售蜂蜜中果糖含量和葡萄糖含量均无统计学差异(p > 0.05),4种糖类成分含量总计为94.4%~99.0%,与Rodríguez报道[13]相似。除W10样品中蔗糖含量为6.6%外,其余样品中蔗糖、麦芽糖含量均低于5%。2015年版中国药典规定蜂蜜中蔗糖和麦芽糖含量均不得超过5%[5];食品安全国家标准GB 14963—2011规定:来源于桉树、柑橘、紫苜蓿、荔枝及野桂花蜜中蔗糖含量不大于10%,其他来源蜂蜜中蔗糖含量不大于5%[14]。所检测的天然蜂蜜及市售蜂蜜中果糖、葡萄糖、蔗糖及麦芽糖含量均符合2015年版中国药典或GB 14963—2011规定。此外,果糖和葡萄糖含量比值为蜂蜜一个重要质量指标,可用于判断蜂蜜风味[15],亦可以判断蜂蜜结晶情况,即含量比值> 1时呈现液体状态,含量比值< 1时会呈现结晶状。Gleiter等[16]认为果糖和葡萄糖含量比值为1.0左右属于花蜜,而在1.5左右为蜜露。本研究所分析的蜂蜜样品果糖和葡萄糖含量比值均在0.9~1.3之间,提示样品均属花蜜。但由于本研究样本量有限,国内天然蜂蜜中糖类成分特点,尚需通过加大样本量进行确认。

|
1.果糖(fructose)2.葡萄糖(glucose)3.蔗糖(sucrose)4.麦芽糖(maltose) 图 3 混合对照品(A)、天然(B)和市售(C)蜂蜜代表性高效液相色谱图 Figure 3 HPLC-CAD chromatograms of mixed reference substances (A), wild (B) and commercial (C) honey samples |
|
|
表 4 天然采集和市售蜂蜜中果糖、葡萄糖、蔗糖和麦芽糖含量 Table 4 The contents of fructose, glucose, sucrose and maltose in wild and commercial honey samples |
本研究可通过TLC定性分析蜂蜜样品中是否有寡糖成分直接判断是否有外源性糖类成分掺入,而HPLC-CAD对蜂蜜代表性糖类成分的定量分析,可进一步评价蜂蜜质量。
| [1] |
张琳, 刘嫦玉, 何群, 等. 蜂蜜的营养与保健作用研究进展-蜂蜜的内服[J]. 中国中医药咨讯, 2010, 2(33): 30. ZHANG L, LIU CY, HE Q, et al. Honey, the role of nutrition and health research[J]. J China Tradit Chin Med Inf, 2010, 2(33): 30. |
| [2] |
何仁, 李军生, 侯革非. 现行国家标准在鉴别蜂蜜掺假方面存在的缺陷[J]. 食品与发酵工业, 2004, 30(2): 115. HE R, LI JS, HOU GF. A potential imperfection of current national product standard in detecting honey adulteration[J]. Food Ferment Ind, 2004, 30(2): 115. |
| [3] |
裴高璞, 史波林, 赵镭, 等. 蜂蜜质量市场动态及掺假检测方法现状分析[J]. 食品科学, 2013, 34(15): 329. PEI GP, SHI BL, ZHAO L, et al. Current situation analysis of quality market dynamics and detection methods for honey adulteration[J]. Food Sci, 2013, 34(15): 329. DOI:10.7506/spkx1002-6630-201315068 |
| [4] |
袁玉伟, 张志恒, 叶雪珠, 等. 蜂蜜掺假鉴别技术的研究进展与对策建议[J]. 食品科学, 2010, 31(9): 318. YUAN YW, ZHANG ZH, YE XZ, et al. Research progress in the detection of honey adulteration[J]. Food Sci, 2010, 31(9): 318. |
| [5] |
中国药典2015年版. 一部[S]. 2015: 359 ChP 2015.Vol Ⅰ[S].2015:359 |
| [6] |
张婧, 王家祺, 陈潇, 等. 国内外蜂蜜标准对比及我国蜂蜜安全标准分析[J]. 中国食品卫生杂志, 2017, 29(2): 203. ZHANG Q, WANG JQ, CHEN X, et al. Comparison of domestic and international honey standards and the analysis of national honey safety standard[J]. Chin J Food Hyg, 2017, 29(2): 203. |
| [7] |
GREMBECKA M, LEBIEDZIŃSKA A, SZEFER P. Simultaneous separation and determination of erythritol, xylitol, sorbitol, mannitol, maltitol, fructose, glucose, sucrose and maltose in food products by high performance liquid chromatography coupled to charged aerosol detector[J]. Microchem J, 2014, 117: 77. DOI:10.1016/j.microc.2014.06.012 |
| [8] |
LI J, HU D, ZONG W, et al. Determination of inulin-type fructooligosaccharides in edible plants by high-performance liquid chromatography with charged aerosol detector[J]. J Agric Food Chem, 2014, 62(31): 7707. DOI:10.1021/jf502329n |
| [9] |
CHEONG KL, WU DT, HU DJ, et al. Comparison and characterization of Panax species glycome by HPTLC[J]. JPC-J Planar Chromatogr-Mod TLC, 2014, 27: 449. DOI:10.1556/JPC.27.2014.6.8 |
| [10] |
CHEONG KL, LI J, ZHAO J, et al. A simple analysis of fructooligosaccharides in two medicinal plants by high-performance thin-layer chromatography[J]. JPC-J Planar Chromatogr-Mod TLC, 2014, 27(4): 245. DOI:10.1556/JPC.27.2014.4.2 |
| [11] |
WU DT, CHEONG KL, WANG LY, et al. Characterization and discrimination of polysaccharides from different species of Cordyceps using saccharide mapping based on PACE and HPTLC[J]. Carbohydr Polym, 2014, 103: 100. DOI:10.1016/j.carbpol.2013.12.034 |
| [12] |
GORECKI T, LYNEN F, SZUCS R, et al. Universal response in liquid chromatography using charged aerosol detection[J]. Anal Chem, 2006, 78(9): 3186. DOI:10.1021/ac060078j |
| [13] |
RODRIGUEZ GO, FERRER BS, FERRER A, et al. Characterization of honey produced in Venezuela[J]. Food Chem, 2004, 84(4): 499. DOI:10.1016/S0308-8146(02)00517-4 |
| [14] |
GB 14963-2011食品安全国家标准蜂蜜[S].2011 GB 14963-2011 National Food Safety Standard Honey[S].2011 |
| [15] |
BRAY GA. How bad is fructose?[J]. Am J Clin Nutr, 2007, 86(4): 895. |
| [16] |
GLEITER RA, HORN H, ISENGARD HD. Influence of type and state of crystallisation on the water activity of honey[J]. Food Chem, 2006, 96(3): 441. DOI:10.1016/j.foodchem.2005.03.051 |
 2018, Vol. 38
2018, Vol. 38 
