虫草是中国传统名贵中药,为真菌寄生在昆虫幼虫上的子座及幼虫尸体的复合体。目前全球已发现400多种虫草,在中国有90多种,主要分布在青海、西藏、四川等地,包括冬虫夏草、古尼虫草、凉山虫草、亚香棒虫草、蝉花虫草、细虫草等[1]。在种类众多的虫草中,冬虫夏草最著名,也是中国药典唯一收录的品种[2]。研究表明,虫草多糖具有抗菌,抗肿瘤,降血糖,增强免疫力等功效[3-4],是最重要的活性成分之一[5]。因此,虫草多糖组成糖比较分析对不同种类虫草质量控制具有重要意义[6]。实际上,多糖生物活性与其单糖组成及比例等密切相关[7-8]。有研究将多糖组分分子量分布及其构成比作为虫草质量控制的一个指标[9],或采用糖谱法[10]比较分析不同种类及产地虫草多糖差异[11]。而多糖的单糖组成分析是进行多糖质量控制和获取多糖基本信息的重要环节。因此,本文比较分析不同种类及产地虫草多糖的单糖组成与比例,旨在为虫草质量控制提供参考。
目前,多糖的单糖组成测定方法主要有高效液相色谱法(HPLC)[12]、高效阴离子交换分离-脉冲安培色谱法(HPAEC-PAD)[13]、毛细管电泳法(CE)[14]、气相色谱联用质谱法(GC-MS)[15]和薄层色谱法(TLC)[16]等。其中TLC法分析单糖组成操作简单、快速,成本低,灵敏度较高,能够同时进行多个样品分析,不同单糖具有较高的分离度并能显示不同的颜色便于区分,是一种简便有效的定性、半定量分析方法[16],已成功应用于天然产物多糖如人参[16]、灵芝[17]、茶叶[18]多糖的单糖组成分析。本文采用TLC方法分析了不同种类及产地虫草多糖的单糖组成及比例,包括天然冬虫夏草、古尼虫草、凉山虫草、亚香棒虫草、细虫草、人工培养蛹虫草以及人工发酵虫草菌粉等,旨在为不同种类虫草质量控制和评价提供参考。
1 仪器与试药ASE 200溶剂加速提取仪(赛默飞世尔科技有限公司),AS30薄层色谱自动点样仪和CD60扫描仪(迪赛克公司),薄层色谱纤维素板(默克公司),XS105型分析天平(梅特勒-托利多公司),FD8518型冷冻干燥机(ILShinBioBase公司),YOKO-XR薄层显色加热器(武汉药科新技术开发有限公司),Milli-Q超纯水系统(默克密理博)。
半乳糖醛酸、葡萄糖醛酸、核糖、木糖、阿拉伯糖、甘露糖、鼠李糖、半乳糖和葡萄糖对照品(纯度≥99%,西格玛奥德里奇公司),苯胺、邻苯二甲酸(纯度≥99%,上海阿拉丁生化科技股份有限公司),乙酸、三氟乙酸(色谱级,≥99%,上海阿拉丁生化科技股份有限公司),乙酸乙酯、乙醇(分析纯,天津市富宇精细化工有限公司),吡啶(分析纯,天津大茂试剂有限公司)。
天然冬虫夏草(Cordyceps sinensis,编号NC1-3和NC5-7)、新疆虫草(Cordyceps sp.,编号为NC4)、古尼虫草(Cordyceps gunnii,编号为AC1和AC8)、凉山虫草(Cordyceps liangshanensis,编号为AC2和AC4)、细虫草(Cordyceps gracilis,编号为AC5)、亚香棒虫草(Cordyceps hawkesii,编号为AC3和AC6)、蝉花(Cordyceps cicadae,编号为AC7)均收集于中国不同地区。人工培养蛹虫草子实体(cultured Cordyceps militaris fruiting-body,编号为CM1-9)和人工发酵虫草菌粉(cultured Cordyceps sinensis mycelia,编号为CC1-10)收集于不同生产厂家,以及本实验室人工发酵虫草菌丝体(编号为CC11-12),所有生产厂家的人工培养虫草均有国家相关管理机构鉴定证明,其余虫草样品经通讯作者鉴定并备份保存于澳门大学中药质量研究国家重点实验室,详细信息见表 1。
|
|
表 1 虫草样品种类和来源 Table 1 The species of Cordyceps and their sources |
精密称取半乳糖、葡萄糖、甘露糖、木糖、核糖、鼠李糖的对照品各约10 mg,以10 mL 60%乙醇溶液定容,摇匀,即得混合对照品储备液,置于4 ℃冰箱中保存。
2.2 虫草多糖样品及供试品溶液的制备虫草样品于40 ℃烘箱干燥24 h,粉碎成细粉;称取粉末0.5 g,按1:1比例将粉末和硅藻土混合搅拌均匀,置于11 mL加压溶剂提取罐内进行提取。加压溶剂提取法提取[11]:提取溶剂为去离子水,温度100 ℃,时间5 min,循环次数1次及压力1.034×104 kPa,提取液旋转蒸发浓缩至约5 mL,加入3倍体积95%乙醇,静置过夜,于3 000 g下离心10 min,收集沉淀,80 ℃挥干残余醇溶液,沉淀物用15 mL纯水80 ℃下溶解,3 000 g下离心10 min去不溶物,上清液离心超滤(膜截留分子量3 kDa)去除小分子化合物,截留液于-80 ℃冷冻干燥后即得虫草多糖样品。
称取虫草多糖样品5 mg,加入2 mol·L-1三氟乙酸1 mL,于90 ℃下水解12 h。冷却至室温,氮气吹干,采用60%乙醇溶解,转入10 mL量瓶中,加入60%乙醇定容至刻度,混匀,0.45 μm滤膜过滤,即得供试品溶液。
2.3 薄层色谱法分析利用自动点样仪,点样于20 cm×10 cm薄层纤维素板中,点样量10 μL,样品条带宽9 mm,间隔12 mm,起始点样高度10 mm。点样后,采用展开剂乙酸乙酯-吡啶-醋酸-水(7.0:3.0:0.2:1.4)进行展开至7 cm处,取出吹干,再利用苯胺-邻苯二甲酸显色剂(0.93 g苯胺和1.66 g邻苯二甲酸溶解于100 mL的水饱和正丁醇)进行显色,喷雾显色剂后于加热板105 ℃加热5 min,在可见光下观察拍照,并利用薄层色谱扫描仪于410 nm下扫描进行定量分析[19]。对照品显色后,在380~800 nm扫描,结果显示虫草样品中主要类型单糖葡萄糖、半乳糖及甘露糖在410 nm处有最大吸收(图 1),考虑检测的灵敏度和便利性,优选410 nm作为测定波长。
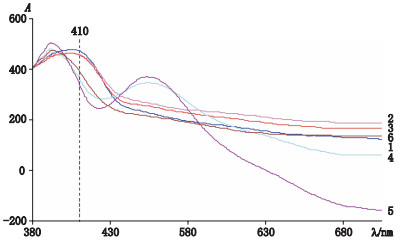
|
1.半乳糖(galactose)2.葡萄糖(glucose)3.甘露糖(mannose)4.木糖(xylose)5.核糖(ribose)6.鼠李糖(rhamnose) 图 1 不同单糖显色后380~800 nm扫描图 Figure 1 The spectra of different monosaccharides in the range of 380-800 nm after colorization |
分别精密吸取混合对照品储备液0.5、1.0、1.5、2.0、2.5、3.0 mL至10 mL量瓶中,加60%乙醇溶液定容至刻度,配制成系列混合对照品溶液。按“2.3”项下色谱条件展开、扫描,以测得峰面积Y对进样质量X(μg)进行线性回归,得回归方程,见表 2。结果表明6种单糖的线性关系良好,r > 0.995 7。取混合对照品溶液逐级稀释,以信噪比(S/N)为3:1和10:1为基准测得各化合物的检测限和定量限,分别为0.02~0.10 μg和0.08~0.40 μg,结果见表 2。
|
|
表 2 几种单糖线性回归结果、检测限和定量限 Table 2 Linear regression data, limit of detection (LOD)and limit of quantitation (LOQ) of the tested monosaccharides |
同板精密度为同一混合对照品溶液在同一张板上点6个样、展开,异板精密度为同一混合对照品溶液按“2.3”项下条件分别在6块板上点样、展开;显色后扫描得峰面积。结果(表 3)显示同板、异板精密度试验的峰面积RSD(n=6)分别为2.9%~6.4%和6.0%~8.4%,说明此方法具有的良好精密度。
|
|
表 3 6个单糖精密度、稳定性、重复性和回收率(n=6) Table 3 Precision, stability, repeatability and recovery of 6 monosaccharides |
取6份冬虫夏草(NC6)制得的虫草多糖样品,按“2.2”项下条件制备供试品溶液,按“2.3”项下条件分离后显色,使用薄层色谱扫描仪积分所得峰的峰面积,计算各单糖含量,以6次测定结果RSD作为评价指标,考察重复性,见表 3。结果各单糖含量的RSD(n=6)为2.3%~6.3%,表明该方法重复性良好。
2.7 稳定性试验取同一份冬虫夏草(NC6)样品,按“2.2”项下条件制备供试品溶液,按“2.3”项下条件分离后显色,显色后每隔5 min(0~25 min)使用薄层色谱扫描仪积分所得峰的峰面积,考察稳定性,结果见表 3。各单糖峰面积的RSD(n=6)为0.66%~1.6%,表明该方法稳定性良好。
2.8 加样回收率试验称取冬虫夏草(NC6)多糖样品2.5 mg,共6份,分别加入半乳糖、葡萄糖、甘露糖、木糖、核糖及鼠李糖对照品0.14、2.27、0.92、1.2、1.2、1.5 mg,按“2.2”项下方法制备供试溶液,按“2.3”项下条件分离后显色、扫描,记录峰面积,依回收率=[(测定含量-供试品理论含量)/对照品加入量]×100%计算得各单糖加样回收率为94.0%~103.8%(n=6),结果见表 3。
2.9 虫草多糖的单糖组成分析虫草多糖供试品溶液和单糖对照品S1(阿拉伯糖,0.5 mg·mL-1)、S2(鼠李糖、核糖、木糖、葡萄糖、半乳糖、甘露糖、葡萄糖醛酸、半乳糖醛酸混合液,各0.5 mg·mL-1),分别点样10 μL,在薄层展开后以苯胺-邻苯二甲酸显色剂显色,可得组成糖类成分特征图谱(图 2-A),单糖分离显色后用薄层扫描仪扫描定量(图 2-B),不同虫草样品中单糖及其含量见表 4。
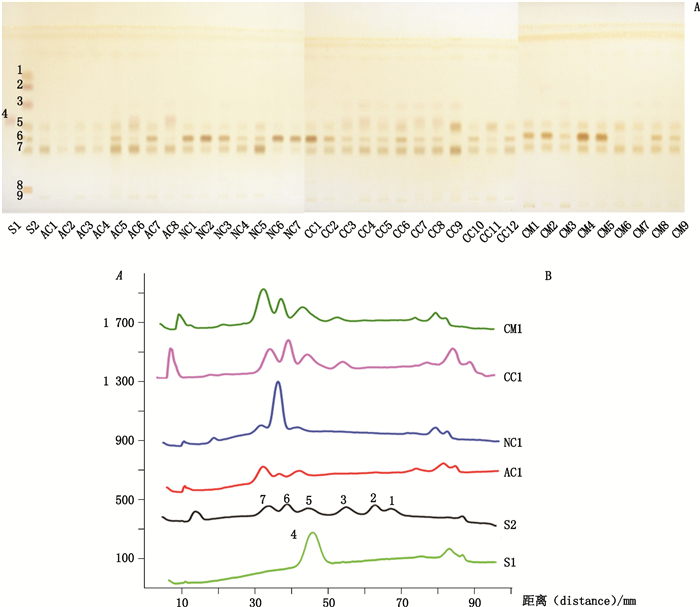
|
S1、S2.单糖对照品(monosaccharide reference substances) S1:4.阿拉伯糖(arabinose)S2:1.鼠李糖(rhamnose);2.核糖(ribose);3.木糖(xylose);5.甘露糖(mannose);6.葡萄糖(glucose);7.半乳糖(galactose);8.葡萄糖醛酸(glucuronic acid);9.半乳糖醛酸(galacturonic acid)样品编号和信息同表 1 the samples codes were the same as in Tab. 1 图 2 虫草多糖完全酸水解产物薄层色谱图(A)和扫描图(B) Figure 2 TLC chromatograms (A) and densitograms (B) of complete acid hydrolysis of Cordyceps polysaccharides |
|
|
表 4 不同虫草样品中单糖及其含量 Table 4 Contents of monosaccharides in Cordyceps spp. samples |
结果显示:天然冬虫夏草多糖(NC1~NC7)主要由葡萄糖、甘露糖和半乳糖组成,其中以葡萄糖含量相对最高,葡萄糖与半乳糖含量的平均比值为5.2:1,葡萄糖与甘露糖含量的平均比值为16.9:1,总糖含量为(13.2±5.3)mg·g-1,与之前报道[15]一致;不同来源天然冬虫夏草样品(青海产NC1、NC2和NC6,四川产NC3及市售NC7)无明显差异;而云南(NC5)产天然虫草样品中半乳糖比例较高,新疆虫草(NC4)与其相似[20]。
古尼虫草、凉山虫草、亚香棒虫草、细虫草及蝉花样品(AC1~AC8)中也主要由葡萄糖、甘露糖和半乳糖组成,但其中葡萄糖的平均含量相对较低,葡萄糖与半乳糖含量的平均比值为0.31:1,葡萄糖与甘露糖含量的平均比值为0.81:1,且总糖含量也相对较低,为(7.9±4.0)mg·g-1。
人工培养的蛹虫草子实体中(CM1~CM9),其单糖组成与天然虫草相似,也与之前的报道[21]一致。其中葡萄糖含量相对较高,葡萄糖与半乳糖含量的平均比值为1.9:1,葡萄糖与甘露糖含量的平均比值为5.9:1,半乳糖含量约为甘露糖的2倍,总糖含量为(10.1±5.6)mg·g-1,但样品CM6(0.02 mg·g-1)和CM7(0.24 mg·g-1)则只含有少量葡萄糖,提示培养条件可能对单糖组成有较大影响。
人工发酵虫草菌粉样品(CC1~CC12)中,其单糖组成也主要是葡萄糖、甘露糖和半乳糖,虽与天然虫草一致,但含量却有较大差别,如样品CC1中葡萄糖含量较高(34.57 mg·g-1),CC4~CC9则含有较高半乳糖(13.00~21.78 mg·g-1),CC4和CC9含有较高甘露糖(22.45~25.02 mg·g-1)。葡萄糖与半乳糖含量的平均比值为0.96:1,葡萄糖与甘露糖含量的平均比值为2.0:1,总糖含量相对较高为(31.9±14.9)mg·g-1。此外,部分样品CC3~CC9还含有少量木糖(0.02 ~0.72 mg·g-1)。人工发酵虫草菌粉多糖的单糖组成差异可能与其生产菌株和/或发酵工艺有关[22]。
2.10 聚类分析和主成分分析应用统计分析软件ORIGIN 9.0中的系统聚类分析法,以虫草样品单糖组成数据为特征变量进行聚类分析。结果:所有虫草样品大体可以分为3类(图 3-A),即古尼虫草(AC1和AC8),凉山虫草、亚香棒虫草、细虫草(AC2~AC6),人工培养蛹虫草(CM3、CM6、CM7、CM8和CM9)、人工发酵菌粉样品(CC3)和新疆虫草(NC4)样品在第1类,此类样品中葡萄糖含量较低[(1.2±1.4)mg·g-1],葡萄糖和半乳糖含量平均比值为0.38:1,葡萄糖和甘露糖含量平均比值为0.73:1,且平均总糖含量较低[(7.5±5.0)mg·g-1];蝉花(AC7)与天然虫草样品(NC1~NC3和NC6、NC7)为第2类,第2类中还包含了人工培养蛹虫草(CM1、CM5、CM2和CM4)和人工发酵菌粉(CC10、CC12和CC2),此类样品中葡萄糖含量较高[(9.7±2.7)mg·g-1],葡萄糖和半乳糖含量平均比值为4.3:1,葡萄糖和甘露糖含量平均比值为13.4:1,平均总糖含量为(15.0±3.3)mg·g-1;第3类为人工发酵菌粉(CC5、CC7、CC8、CC6、CC4和CC9)和天然冬虫夏草样品(NC5),此类样品半乳糖和甘露糖含量均较高,分别为(17.7±3.0)mg·g-1和(14.8±7.4)mg·g-1,葡萄糖含量稍低为(6.5±3.7)mg·g-1;葡萄糖和半乳糖含量平均比值为0.40:1,葡萄糖和甘露糖含量平均比值为0.64:1,且同时含有少量木糖(0.09~0.72 mg·g-1),平均总糖含量最高[(39.7±9.0)mg·g-1]。
对虫草样品进行主成分分析,基于半乳糖及甘露糖含量的影响(PC1,累积贡献率为60.7%)和葡萄糖含量的影响(PC2,累积贡献率为20.9%)的得分图(见图 3-B)显示:天然冬虫夏草(NC1、NC2、NC3、NC5、NC6、NC7)、人工蛹虫草(CM1、CM2、CM4、CM5)、人工发酵虫草菌粉(CC2、CC3、CC10、CC12)和蝉花(AC7)为一类(Ⅰ类);人工发酵虫草菌粉样品(CC4~CC9)为一类(Ⅲ类);第Ⅱ类则有古尼虫草、凉山虫草、亚香棒虫草、细虫草(AC1~AC6、AC8)、新疆虫草(NC4)、人工发酵虫草菌粉样品(CC11)、人工蛹虫草样品(CM3、CM6、CM7、CM8、CM9)。
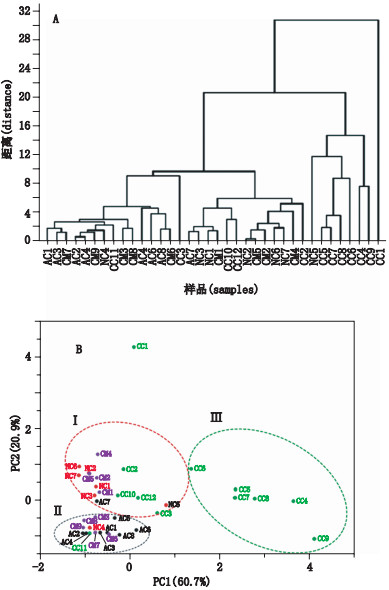
|
样品编号和信息同表 1(the samples codes were the same as in Tab. 1) 图 3 不同虫草样品基于多糖之单糖组成的系统聚类分析(A)和主成分分析(B)图 Figure 3 Hierarchical clustering analysis (A) and principal component analysis score plot (B) of Cordyceps based on compositional monosaccharides of their polysaccharides |
不同种类虫草多糖包括天然冬虫夏草、古尼虫草、凉山虫草、亚香棒虫草、细虫草、新疆虫草、人工培养蛹虫草以及人工发酵虫草菌粉多糖等都具有相似的组成糖,即甘露糖、葡萄糖和半乳糖,但其含量差异明显,本研究有助于基于多糖特征的不同种类虫草质量控制。
| [1] |
YUE K, YE M, ZHOU ZJ, et al. The genus Cordyceps:a chemical and pharmacological review[J]. J Pharm Pharmacol, 2013, 65(4): 474. DOI:10.1111/j.2042-7158.2012.01601.x |
| [2] |
中国药典2015年版. 一部[S]. 2015: 115 ChP 2015. Vol Ⅰ[S]. 2015: 115 |
| [3] |
YAN JK, WANG WQ, WU JY. Recent advances in Cordyceps sinensis polysaccharides:mycelial fermentation, isolation, structure, and bioactivities:a review[J]. J Funct Food, 2014, 6: 33. DOI:10.1016/j.jff.2013.11.024 |
| [4] |
LI SP, ZHAO KJ, JI ZN, et al. A polysaccharide isolated from Cordyceps sinensis, a traditional Chinese medicine, protects PC12 cells against hydrogen peroxide-induced injury[J]. Life Sci, 2003, 73(19): 2503. DOI:10.1016/S0024-3205(03)00652-0 |
| [5] |
ZHAO J, XIE J, WANG LY, et al. Advanced development in chemical analysis of Cordyceps[J]. J Pharm Biomed Anal, 2014, 87: 271. DOI:10.1016/j.jpba.2013.04.025 |
| [6] |
LI SP, YANG FQ, TSIM KWK, et al. Quality control of Cordyceps sinensis, a valued traditional Chinese medicine[J]. J Pharm Biomed Anal, 2006, 41(5): 1571. DOI:10.1016/j.jpba.2006.01.046 |
| [7] |
HU DJ, CHEONG KL, ZHAO J, et al. Chromatography in characterization of polysaccharides from medicinal plants and fungi[J]. J Sep Sci, 2013, 36(1): 1. DOI:10.1002/jssc.v36.1 |
| [8] |
LI SP, WU DT, LV GP, et al. Carbohydrates analysis in herbal glycomics[J]. TrAC-Trends Anal Chem, 2013, 52: 155. DOI:10.1016/j.trac.2013.05.020 |
| [9] |
李绍平, 张平, 夏全, 等. 天然和人工冬虫夏草多糖组分的HPLC分析[J]. 药物分析杂志, 2003, 23(1): 20. LI SP, ZHANG P, XIA Q, et al. Analysis of ploysaccharides from natural Cordyceps sinensis and cultured Cordyceps mycelia by HPLC[J]. Chin J Pharm Anal, 2003, 23(1): 20. |
| [10] |
李绍平, 吴定涛, 赵静. 糖谱及其在中药多糖质量控制中的应用[J]. 中国中药杂志, 2015, 40(17): 3505. LI SP, WU DT, ZHAO J. Saccharide mapping and its application in quality control of polysacchrides from Chinese medicines[J]. China J Chin Mater Med, 2015, 40(17): 3505. |
| [11] |
WU DT, CHEONG KL, WANG LY, et al. Characterization and discrimination of polysaccharides from different species of Cordyceps using saccharide mapping based on PACE and HPTLC[J]. Carbohydr Polym, 2014, 103: 100. DOI:10.1016/j.carbpol.2013.12.034 |
| [12] |
苑鹤, 白燕冰, 斯金平, 等. 柱前衍生HPLC分析铁皮石斛多糖中单糖组成的变异规律[J]. 中国中药杂志, 2011, 36(18): 2465. YUAN H, BAI YB, SI JP, et al. Variation of monosacchride composition of polysacchrides in Dendrobium officinale by pre-column derivatization HPLC method[J]. China J Chin Mater Med, 2011, 36(18): 2465. |
| [13] |
刘婷, 周光明, 罗振亚, 等. 高效阴离子交换分离-脉冲安培检测茶叶多糖中的半乳糖、葡萄糖、甘露糖和果糖[J]. 食品科学, 2009, 30(6): 155. LIU T, ZHOU GM, LUO ZY, et al. Determination of galactose, glucose, mannose and fructose from tea polysaccharides by high performance anion exchange chromatography coupled with pulsed amperometric detection[J]. Food Sci, 2009, 30(6): 155. |
| [14] |
HU YY, WANG T, YANG X, et al. Analysis of compositional monosaccharides in fungus polysaccharides by capillary zone electrophoresis[J]. Carbohydr Polym, 2014, 102: 481. DOI:10.1016/j.carbpol.2013.11.054 |
| [15] |
GUAN J, YANG FQ, LI SP. Evaluation of carbohydrates in natural and cultured Cordyceps by pressurized liquid extraction and gas chromatography coupled with mass spectrometry[J]. Molecules, 2010, 15(6): 4227. |
| [16] |
CHEONG KL, WU DT, HU DJ, et al. Comparison and characterization of the glycome of Panax species by high-performance thin-layer chromatography[J]. JPC-J Planar Chromatogr-Mod TLC, 2014, 27(6): 449. DOI:10.1556/JPC.27.2014.6.8 |
| [17] |
钱夕惠. 薄层色谱法分析灵芝多糖中的单糖组成[J]. 中国现代药物应用, 2013, 7(18): 13. QIAN XH. Determination of monosaccharides composition from Ganoderma lucidum polysaccharide by thin-layer chromatography[J]. Chin J Mod Drug Appl, 2013, 7(18): 13. DOI:10.3969/j.issn.1673-9523.2013.18.007 |
| [18] |
肖作奇, 文晓柯, 潘涛. 薄层色谱和高效液相色谱用于矮地茶多糖的单糖组成分析[J]. 中国医药导报, 2016, 13(30): 130. XIAO ZQ, WEN XK, PAN T. Analysis of monosaccharide composition in Ardisia japonica polysaccharide by TLC and HPLC[J]. China Med Her, 2016, 13(30): 130. |
| [19] |
CHEONG KL, LI J, ZHAO J, et al. A simple analysis of fructooligosaccharides in two medicinal plants by high-performance thin-layer chromatography[J]. JPC-J Planar Chromatogr-Mod TLC, 2014, 27(4): 245. DOI:10.1556/JPC.27.2014.4.2 |
| [20] |
KIHO T, TABATA H, UKAI S, et al. A minor, protein-containing galactomannan from a sodium carbonate extract of Cordyceps sinensis[J]. Carbohydr Res, 1986, 156: 189. DOI:10.1016/S0008-6215(00)90110-1 |
| [21] |
LEE JS, KWON JS, WON DP, et al. Study on macrophage activation and structural characteristics of purified polysaccharide from the liquid culture broth of Cordyceps militaris[J]. Carbohydr Polym, 2010, 82(3): 982. DOI:10.1016/j.carbpol.2010.06.025 |
| [22] |
KIM H, YUN J. A comparative study on the production of exopolysaccharides between two entomopathogenic fungi Cordyceps militaris and Cordyceps sinensis in submerged mycelial cultures[J]. J Appl Microbiol, 2005, 99(4): 728. DOI:10.1111/jam.2005.99.issue-4 |
 2018, Vol. 38
2018, Vol. 38 
