龙胆泻肝丸是由龙胆泻肝汤通过剂型改革制成的现代中成药制剂,收载于中国药典2015年版一部,具有清肝胆及利湿热的功效[1],临床主要用于肝胆湿热、头晕目赤、耳鸣耳聋、耳肿疼痛、胁痛口苦、尿赤涩痛及湿热带下等症[2-5]。其处方由龙胆、栀子、黄芩、柴胡、泽泻、木通、盐车前子、酒当归、炙甘草和地黄共10味药材组成,其中,龙胆为君药,栀子、黄芩为臣药。研究表明,龙胆苦苷和獐牙菜苦苷为龙胆中的代表性环烯醚萜苷类成分,具有抗炎、镇痛、保肝等作用[6-8];京尼平苷和京尼平龙胆双糖苷为栀子中的代表性环烯醚萜苷类成分,具有保肝、抗炎、抗氧化、抗血栓等作用[7-11];黄芩苷、汉黄芩苷、黄芩素和汉黄芩素为黄芩中的代表性黄酮类成分,具有抗炎、抗肿瘤、抗血栓等作用[12-14]。中国药典2015年版仅以龙胆苦苷、京尼平苷和黄芩苷为指标成分,采用高效液相色谱法测定其含量,无法全面有效地控制龙胆泻肝丸的质量。本文参照相关文献[15-17],结合笔者前期研究[18-20],建立高效液相色谱法同时测定龙胆泻肝丸中龙胆苦苷、獐牙菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素和汉黄芩素的含量,方法简便、快速、准确,可为提升龙胆泻肝丸的质量标准提供科学依据。
1 仪器与试药 1.1 仪器岛津公司LC-20A型高效液相色谱仪(配备SIL-20AHT自动进样器,LC-20AT二元泵,CTO-20A柱温箱,SPD-20A紫外检测器,LC solution色谱工作站);沃特世公司Waters SunFireTM C18色谱柱(4.6 mm×250 mm,5 µm;填料:十八烷基硅烷键合硅胶);昆山市超声仪器有限公司KQ-250DE型数控超声波清洗器(功率:250 W);赛多利斯仪器有限公司CPA 225D型电子天平;天津市泰斯特仪器有限公司FW80型微型高速万能试样粉碎机;江苏新康医疗器械有限公司XK96-A快速混匀器;上海跃进医疗器械厂HH-B11型电热恒温培养箱。
1.2 试药乙腈和甲醇(流动相考察时用)为色谱纯(Thermo Fisher科技有限公司);甲醇(提取溶剂)为分析纯(天津市巴斯夫化工有限公司);磷酸为分析纯(天津市北方天医试剂厂);纯净水(杭州娃哈哈集团有限公司);龙胆苦苷对照品(批号110770-200611)、獐芽菜苦苷对照品(批号110785-201404)、京尼平苷对照品(批号110749-201316)、黄芩苷对照品(批号110715-201619)、汉黄芩苷对照品(批号112002-201501)、黄芩素对照品(批号111595-201607)和汉黄芩素对照品(批号111514-201605)均购自中国食品药品检定研究院,京尼平龙胆双糖苷对照品(批号141120)购自成都普菲德生物技术有限公司;以上对照品纯度均大于98%。龙胆泻肝丸购自北京同仁堂有限责任公司。
2 方法与结果 2.1 溶液的制备 2.1.1 对照品储备液取龙胆苦苷、獐芽菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素的对照品适量,精密称定,用甲醇配成质量浓度均为1.0 mg·mL-1的单一成分的溶液,即得。
2.1.2 供试品溶液取龙胆泻肝丸本品6.0 g,研细,精密称取1.0 g,置于50 mL具塞锥形瓶中,加入甲醇-水(50: 50)50 mL,密塞,精密称量,超声(功率250 W,频率50 kHz)提取20 min,放冷至室温后再进行称量,并用甲醇-水(50: 50)补足减失的量,振摇均匀,用0.45μm微孔滤膜过滤,取续滤液,即得。
2.1.3 阴性样品溶液按处方量分别制备不含龙胆的阴性样品、不含黄芩的阴性样品、不含栀子的阴性样品,按“2.1.2”项方法操作,即得。
2.2 色谱条件采用Waters SunFireTM C18色谱柱(4.6 mm×250 mm,5 µm),流动相为乙腈(A)-0.1%磷酸水(B),梯度洗脱(0~6 min,10%A→15%A;6~7 min,15%A;7~10 min,15%A→16%A;10~15 min,16%A;15~20 min,16%A→30%A;20~35 min,30%A→33%A;35~38 min,33%A→38%A;38~60 min,38%A→48%A),流速1.0 mL·min-1,检测波长254 nm,柱温为30 ℃,进样量20 μL。龙胆苦苷、獐牙菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素和汉黄芩素用于含量测定的典型色谱图见图 1。
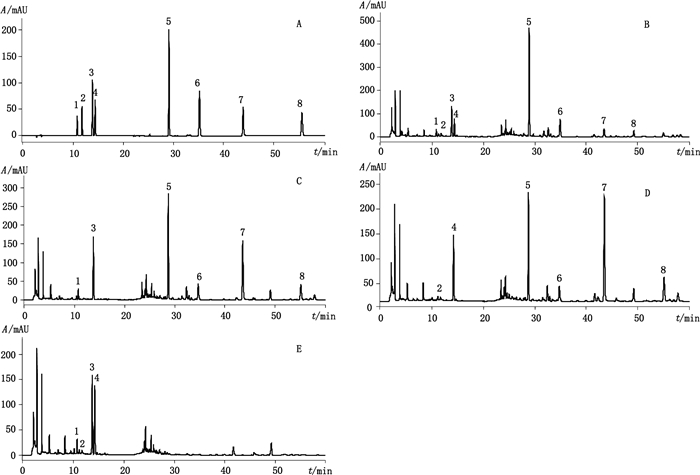
|
1.京尼平龙胆双糖苷(gentiopicroside) 2.獐牙菜苦苷(swertiamarin) 3.京尼平苷(geniposide) 4.龙胆苦苷(genipingentiobioside) 5.黄芩苷(baicalin) 6.汉黄芩苷(wogonoside) 7.黄芩素(baicalein) 8.汉黄芩素(wogonin) 图 1 混合对照品(A)、样品(B)、不含龙胆的阴性样品(C)、不含栀子的阴性样品(D)、不含黄芩的阴性样品(E)的HPLC色谱图 Figure 1 HPLC chromatograms of mixed reference substances(A), sample(B), negative sample without Gentianae Radixet Rhizoma(C), negative sample without Gardeniae Fructus(D)andnegative sample without Scutellariae Radix(E) |
分别精密吸取“2.1.1”项下的各对照品储备液适量,置于同一5mL量瓶中,用甲醇-水(50: 50)配制成龙胆苦苷、獐芽菜苦苷、京尼平龙胆双糖苷、汉黄芩苷质量浓度均为2.5、5、10、25、50和100 μg·mL-1,京尼平苷和黄芩苷质量浓度均为5、10、20、50、100和200 μg·mL-1,黄芩素和汉黄芩素质量浓度均为1.25、2.5、5、12.5、25和50 μg·mL-1的系列混合对照品溶液;取混合对照品溶液200 μL,注入样品瓶中,置于样品架上,按“2.2”项下条件依次进样测定色谱峰面积,以对照品质量浓度X(μg·mL-1)为横坐标,色谱峰面积积分值(Y)为纵坐标,进行线性回归,结果龙胆苦苷、獐芽菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素和汉黄芩素的回归方程:
Y=2.4×104X+1.9×104 r=0.999 7
Y=1.5×104X+1.3×104 r=0.999 6
Y=1.8×104X+3.3×104 r=0.999 6
Y=1.0×104X+8.2×103 r=0.999 6
Y=3.1×104X+6.2×104 r=0.999 5
Y=4.2×104X+3.8×104 r=0.999 6
Y=5.8×104X-7.4×103 r=0.999 8
Y=5.5×104X+1.2×104 r=0.999 8
上述8个成分质量浓度分别在2.5~100、2.5~100、5~200、2.5~100、5~200、2.5~100、1.25~50和1.25~50μg·mL-1范围内与峰面积呈良好的线性关系。
2.4 精密度试验精密吸取“2.3”项下制备的龙胆苦苷、獐芽菜苦苷、京尼平龙胆双糖苷、汉黄芩苷质量浓度均为25 μg·mL-1,京尼平苷和黄芩苷质量浓度均为50 μg·mL-1,黄芩素和汉黄芩素质量浓度均为12.5 μg·mL-1的混合对照品溶液200μL,注入样品瓶中,置于样品架上。按上述色谱条件连续进样6次,记录峰面积。结果龙胆苦苷、獐牙菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素峰面积的RSD(n=6)分别为0.17%、0.18%、0.22%、0.14%、0.072%、0.051%、0.54%、0.20%,表明仪器精密度良好。
2.5 稳定性试验取同一份的供试品溶液200μL,注入样品瓶中,置于样品架上,在室温下分别于供试品溶液制备后0、2、4、8、12和24 h进样测定,记录峰面积。结果龙胆苦苷、獐牙菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素峰面积的RSD分别为0.33%、0.93%、0.50%、0.38%、1.9%、0.93%、2.7%、1.2%,表明供试品溶液在24h内稳定。
2.6 重复性试验取同一批龙胆泻肝丸(批号161202)样品6份,分别按“2.1.2”项下方法制备供试品溶液;取供试品溶液200 μL,注入样品瓶中,置于样品架上,进样测定,记录峰面积,计算待测成分的含量。结果龙胆苦苷、獐牙菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素的含量平均值(n=6)分别为1.707、0.530、3.783、1.697、7.370、1.258、0.518和0.297 mg·g-1,RSD分别为0.46%、1.4%、1.5%、0.15%、1.2%、1.3%、0.96%和1.2%,表明方法重复性良好。
2.7 加样回收率试验精密称取“2.6”项下已测知含量的龙胆泻肝丸样品粉末9份,每份0.5 g,精密称定,分别加入相当于样品中龙胆苦苷、獐牙菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素和汉黄芩素含量的80%、100%、120%的对照品溶液适量,各3份。按“2.1.2”项下的方法制备供试溶液;取供试溶液200 μL,注入样品瓶中,置于样品架上,进样测定,计算龙胆苦苷、獐牙菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素和汉黄芩素的回收率和RSD,结果见表 1。
|
|
表 1 龙胆泻肝丸中8个成分的回收率 Table 1 Recoveries of 8 components in LongdanXiegan pill |
精密称量6批次龙胆泻肝丸样品,按“2.1.2”项下的方法制备供试品溶液,进样20 μL,每个供试品溶液进样3次,记录峰面积,采用外标法计算龙胆苦苷、獐牙菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素、汉黄芩素的含量。6批样品测定结果见表 2。
|
|
表 2 龙胆泻肝丸中8个成分的含量(mg·g-1) Table 2 The contents of 8 components in Longdan Xiegan pill |
分别考察了甲醇-0.1%磷酸溶液、乙腈-0.1%磷酸溶液和乙腈-0.2%磷酸溶液3种流动相体系。采用甲醇-0.1%磷酸溶液作为流动相时,京尼平苷和龙胆苦苷无法完全分离;采用乙腈-0.2%磷酸溶液作为流动相时,京尼平龙胆双糖苷与相邻色谱峰分离度不佳,且汉黄芩苷峰形较差;采用乙腈-0.1%磷酸溶液作为流动相时,能够获得较好的分离效果且其他杂质峰不影响样品的测定。
3.2 梯度洗脱程序的选择龙胆苦苷、獐芽菜苦苷、京尼平苷和京尼平龙胆双糖苷的极性很相近,采用等度洗脱无法完全分离。因此,本文采用乙腈(A)-0.1%磷酸溶液(B)作为流动相,考察了不同的梯度洗脱条件。结果表明,采用本文所选择的梯度洗脱程序时,龙胆苦苷、獐芽菜苦苷、京尼平苷、京尼平龙胆双糖苷能够很好的分离,且杂质峰无干扰。
3.3 检测波长的选择8种活性成分在254 nm下均有较强的紫外吸收,且峰形良好,综合考虑杂峰影响,基线平稳,最大吸收等因素,本试验最终选择254 nm作为检测波长。
3.4 柱温的选择本实验分别考察了柱温为30、35和40 ℃时龙胆苦苷、獐芽菜苦苷、京尼平苷、京尼平龙胆双糖苷、黄芩苷、汉黄芩苷、黄芩素和汉黄芩素的分离情况,结果表明,柱温为30 ℃时,上述8个物质能够实现较好的分离。
3.5 小结本实验研究所用的样品均为市售的不同批次的成方制剂,含量测定结果表明,6批次龙胆泻肝丸均符合中国药典2015年版规定,每1 g龙胆泻肝丸中龙胆苦苷成分含量均大于0.8 mg,京尼平苷含量均大于1.3 mg,黄芩苷含量均大于3.8 mg。本研究建立的HPLC方法重复性及稳定性好,专属性强,与中国药典2015年版相比,又增加了龙胆泻肝丸中5个有效成分的质量控制方法,可为龙胆泻肝丸的质量标准提升提供一定的参考。
| [1] |
中国药典2015年版. 一部[S]. 2015: 770 ChP 2015.VolⅠ[S].2015:770 |
| [2] |
董伟, 梁爱华, 薛宝云, 等. 龙胆泻肝丸(含白木通)对胆汁淤积大鼠利胆保肝作用的实验研究[J]. 中国实验方剂学杂志, 2007, 13(10): 37. DONG W, LIANG AH, XUE BY, et al. Cholagogiceffect and hepatoprotective effect of LongdanXiegan pills(with Caulis AkebialAustralis)on experimental cholestasis in mice[J]. Chin J Exp Tradit Med Form, 2007, 13(10): 37. DOI:10.3969/j.issn.1005-9903.2007.10.014 |
| [3] |
张建平, 周琰, 王林, 等. 龙胆泻肝丸对阻塞性黄疸大鼠肝脏转运功能的影响[J]. 中成药, 2007, 29(7): 979. ZHANG JP, ZHOU Y, WANG L, et al. Effect of LongdanXiegan pills on the liver transport function of rats with obstructive jaundice[J]. Chin Tradit Pat Med, 2007, 29(7): 979. |
| [4] |
杨彦, 范红霞. 龙胆泻肝丸(汤)治疗细菌性阴道病的临床与实验研究[J]. 医学理论与实践, 2005, 18(11): 1277. YANG Y, FAN HX. The clinical and experimental study on the curative effect of Longdan Xiegan pill(decoction)on bacterial vaginosis(BV)[J]. J Med Theory Pract, 2005, 18(11): 1277. DOI:10.3969/j.issn.1001-7585.2005.11.011 |
| [5] |
LIU N, LI YX, GONG SS, et al. Antinociceptive effects of gentiopicroside on neuropathic pain induced by chronic constriction injury in mice:a behavioral and electrophysiological study[J]. Can J Physiol Pharmacol, 2016, 94(7): 769. DOI:10.1139/cjpp-2015-0462 |
| [6] |
陈长勋, 刘占文, 孙峥嵘, 等. 龙胆苦苷抗炎药理作用研究[J]. 中草药, 2003, 34(9): 814. CHEN CX, LIU ZW, SUN ZR, et al. Studies on anti-inflammatory effect of gentiopicroside[J]. Chin Tradit Herb Drugs, 2003, 34(9): 814. |
| [7] |
刘占文, 陈长勋, 金若敏, 等. 龙胆苦苷的保肝作用研究[J]. 中草药, 2002, 33(1): 47. LIU ZW, CHEN CX, JIN RM, et al. Studies on liver-protection and promoting bile secretion of gentiopicroside[J]. Chin Tradit Herb Drugs, 2002, 33(1): 47. |
| [8] |
MA TT, HUANG C, ZONG GJ, et al. Hepatoprotective effects of geniposide in a rat model of nonalcoholic steatohepatitis[J]. J Pharm Pharmacol, 2011, 63(4): 587. DOI:10.1111/j.2042-7158.2011.01256.x |
| [9] |
FU YH, LIU B, LIU JH, et al. Geniposide, from Gardenia jasminoides Ellis, inhibits the inflammatory response in the primary mouse macrophages and mouse models[J]. IntImmunopharmacol, 2012, 14(4): 792. |
| [10] |
DEBNATH T, PARK PJ, NATH NCD, et al. Antioxidant activity of Gardenia jasminoides Ellis fruit extracts[J]. Food Chem, 2011, 128(3): 697. DOI:10.1016/j.foodchem.2011.03.090 |
| [11] |
ZHANG HY, LIU H, YANG M, et al. Antithrombotic activities of aqueous extract from Gardenia jasminoides and its main constituent[J]. Pharm Biol, 2013, 51(2): 221. DOI:10.3109/13880209.2012.717088 |
| [12] |
王英军, 孙英莲, 庄淑杰. 黄芩苷对诱导性佐剂关节炎大鼠的药理作用研究[J]. 特产研究, 2012(4): 23. WANG YJ, SUN YL, ZHUANG SJ. Pharmacological effects of baicalin on inductive adjuvants arthritis of rats[J]. Spec Wild Econ Anim Plant Res, 2012(4): 23. |
| [13] |
申云富, 范小青. 汉黄芩苷的药理活性研究进展[J]. 上海中医药大学学报, 2016, 30(4): 98. SHEN YF, FAN XQ. Progress on pharmacological research of wogonoside[J]. J Shanghai Univ Tradit Chin Med, 2016, 30(4): 98. |
| [14] |
辛文妤, 宋俊科, 何国荣, 等. 黄芩素和黄芩苷的药理作用及机制研究进展[J]. 中国新药杂志, 2013, 22(6): 647. XIN WY, SONG JK, HE GR, et al. Progress in pharmacological study and the underlying mechanism of baicalein and baicalin[J]. Chin J New Drugs, 2013, 22(6): 647. |
| [15] |
郝福, 蒋晔, 李艳荣, 等. HPLC法测定龙胆泻肝丸中龙胆苦苷、黄芩苷和栀子苷[J]. 中草药, 2006, 37(12): 1808. HAO F, JIANG Y, LI YR, et al. Simultaneous determination of gentiopicroside, baicalin and geniposide in Longdan Xiegan pills by HPLC[J]. Chin Tradit Herb Drugs, 2006, 37(12): 1808. DOI:10.3321/j.issn:0253-2670.2006.12.018 |
| [16] |
张勇, 薛昆鹏, 何美, 等. 固相萃取/超高效液相色谱法测定龙胆泻肝丸中栀子苷、龙胆苦苷与黄芩苷[J]. 分析测试学报, 2013, 32(1): 122. ZHANG Y, XUE KP, HE M, et al. Determination of geniposide, gentiopicroside and baicalinin Longdanxiegan pills by SPE/UPLC[J]. J Instrum Anal, 2013, 32(1): 122. |
| [17] |
孔树佳. 龙胆泻肝丸中3种活性成分的HPLC-DAD法测定[J]. 辽宁中医杂志, 2017, 44(1): 114. KONG SJ. HPLC-DAD method determination of three kinds of active ingredients in LongdanXiegan pills[J]. Liaoning J Tradit Chin Med, 2017, 44(1): 114. |
| [18] |
朱雯静, 冯波, 郝乘仪. HPLC-DAD法同时测定龙胆泻肝丸中3种主要活性成分的含量[J]. 吉林医药学院学报, 2016, 37(1): 4. ZHU WJ, FENG B, HAO CY. Simultaneuos determination of three main components in LongdanXiegan pills by HPLC-DAD[J]. J Jilin Med Univ, 2016, 37(1): 4. |
| [19] |
朱鹤云, 关皎, 郭小存, 等. RP-HPLC法同时测定龙胆中3种活性成分的含量[J]. 药物分析杂志, 2011, 31(12): 2298. ZHU HY, GUAN J, GUO XC, et al. RP-HPLC simultaneous determination of three active components in Radix Gentianae[J]. Chin J Pharm Anal, 2011, 31(12): 2298. |
| [20] |
关皎, 朱鹤云, 李菁, 等. UFLC法同时测定栀子中4种活性成分的含量[J]. 中药新药与临床药理, 2017, 28(2): 219. GUAN J, ZHU HY, LI J, et al. Simultaneous determination of four active components in Fructus Gardeniae by UFLC[J]. Tradit Chin Drug Res Clin Pharmacol, 2017, 28(2): 219. |
 2017, Vol. 37
2017, Vol. 37 
