2. 浙江华海药业股份有限公司, 临海 317024
2. Zhejiang Huahai Pharmaceuticals Co., Ltd., Linhai 317024, China
药品质量直接关乎药品治疗效果和人类健康,药物杂质控制是药品质量控制的核心要素。杂质的存在会降低药品活性,影响药物的稳定性,甚至产生副作用和不良反应,对人体健康产生危害。因此,对药物中杂质的研究和控制是保障药品质量的关键环节[1]。为控制药物的质量,须建立有效的分析方法对其潜在杂质、降解杂质及未知杂质进行快速定性分析。当前UPLC、LC-MS、LC-Q-TOF-MS、GC-MS、HPTLC及LC-NMR等已成为药物分析特别是杂质分析的重要方法,广泛应用于药品的杂质研究[2-3]。
近年来,随着人民生活水平的不断提高和老龄化加剧,高血压成为危害人类健康的常见疾病之一。目前已知体内有许多系统与血压的调节有关,其中最主要的有交感神经-肾上腺素系统及肾素-血管紧张素系统[4]。1976年血管紧张素Ⅱ(Ang Ⅱ)拮抗剂开始被研发,该类药物通过竞争性拮抗Ⅰ型AngⅡ受体(AT1受体),阻断Ang Ⅱ所引起的病理生理作用而发挥效应[5],具有高效、长效、低毒等特点。AngⅡ受体拮抗剂(AT1受体拮抗剂)的出现代表高血压治疗的一个重要进展,受体水平拮抗循环和局部的AngⅡ作用成为当前抗高血压药物治疗的新观念和新方法[6]。
从成本、环保及可工业化生产角度考虑,氯沙坦钾生产通常采用汇合式工艺,以3-氯-5-丁基-1H-咪唑-2-醛及4’-溴甲基联苯-2-腈为起始物料,经过缩合、还原、上四氮唑、成盐及结晶工序,最终得到氯沙坦钾成品[7-11]。
氯沙坦钾的一些未知杂质并不能根据已知杂质对照品或相关文献数据进行鉴定,在对氯沙坦钾成品中的有关物质进行研究时,发现部分批次样品在RRT 1.12位置出现了1个新杂质,查阅已知的各个官方药典标准(包括美国药典、欧洲药典、中国药典)及文献报道中均未发现该杂质。为了更好地控制药物的质量,本文通过优化色谱条件,将目标杂质与主成分有效的分离,并利用高效液相色谱-四极杆飞行时间质谱联用法(LC-PDA-QTOF-MS)高分辨率和高灵敏度的特点[12],对产品中RRT 1.12杂质的结构进行分析并确定其来源,从源头控制杂质的产生[13-16]。
1 仪器与试药1260/6545高效液相联用四极杆-飞行时间高分辨质谱仪(安捷伦科技有限公司),Kromasil 100-5 C18色谱柱(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶;AkzoNobel公司),XPE205电子天平(梅特勒-托勒多公司)。氯沙坦钾(批号LOS-16-066,由浙江华海药业股份有限公司提供)。甲醇、甲酸、磷酸(色谱纯,Sigma公司),乙腈(色谱纯,Merck试剂公司),纯化水(Thermo Scientific纯水仪,华海药业实验室自制)。
2 色谱与质谱条件 2.1 液相色谱条件色谱柱:Kromasil 100-5 C18(250 mm×4.6 mm,5 μm);流动相A:0.1%甲酸水溶液;流动相B:乙腈;流动相梯度:0 min(25%B),5 min(25%B),30 min(90%B),40 min(90%B),50 min(25%B),55 min(25%B);流速:1.3 mL·min-1;紫外扫描波长:190~580 nm;检测波长:254 nm;柱温:35 ℃;进样量:5 μL。
2.2 质谱检测条件离子源:ESI离子源;离子模式:正离子模式;干燥气体流速:6 L·min-1;干燥气体温度:325 ℃;鞘气流速:12 L·min-1;鞘气温度:400 ℃;雾化气体压力:2.41×105 Pa;毛细管电压:+4.0 kV;碎片电压:90 V;MS1扫描模式:全波长扫描;MS1扫描带宽:~4 amu;MS1扫描范围:m/z100~1 700;碰撞能量:30 eV;MS2扫描范围:m/z 50~1 700;目标二级质谱信号:m/z 423.16,m/z 399.14。
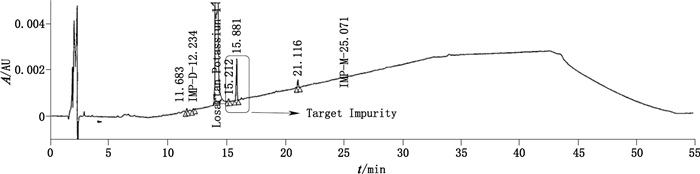
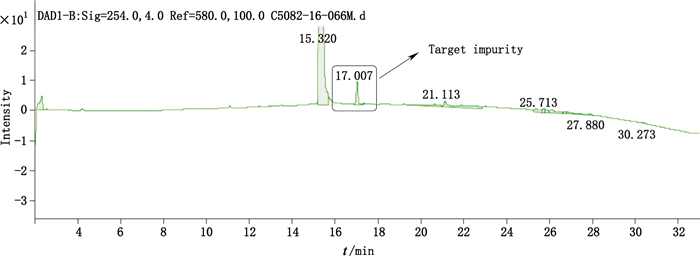
3 结果和讨论 3.1 确定RRT 1.12杂质分子式由于磷酸及其缓冲盐不适合作为一维LC-MS系统的流动相,故采用0.1%甲酸替代0.1%磷酸作为流动相A;在220 nm检测波长下,甲酸流动相背景吸收峰较强,容易掩盖一些峰面积较小的杂质峰,因此选择干扰较少的254 nm作为色谱检测波长。LC-MS色谱谱图中,主成分氯沙坦保留时间(RT)为15.32 min,在17.00 min位置观察到了1个含量约为0.17%的杂质,其相对保留时间(RRT)为1.11,与HPLC图谱中该杂质的RRT 1.12基本一致(见图 1、2),因此判断LC-MS方法中17.00 min出峰的杂质即为目标杂质。
|
图 1 原始HPLC方法中氯沙坦钾RRT 1.12杂质定位 Figure 1 Chromatographic location of impurity with RRT 1.12 in losartan potassium using initial HPLC method |
|
图 2 LC-MS方法中氯沙坦钾及RRT 1.12杂质谱图 Figure 2 UV chromatogram of losartan potassium and the impurity with RRT 1.12 using LC-MS method |
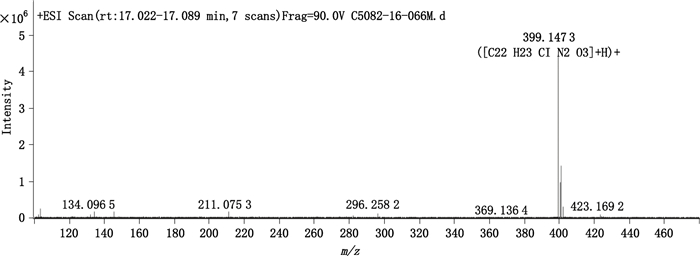
提取RT 17 min组分质谱信号,发现其[M+H]+质谱信号为m/z 399.147 3(见图 3),精确分子式匹配结果为([C22H23ClN2O3]+H)+,匹配误差小于5×10-6,相比氯沙坦分子式C22H23ClN6O多了2个氧原子,少了4个氮原子。
|
图 3 氯沙坦钾RRT 1.12未知杂质一级质谱图 Figure 3 Mass spectrum of impurity with RRT 1.12 in losartan potassium. |
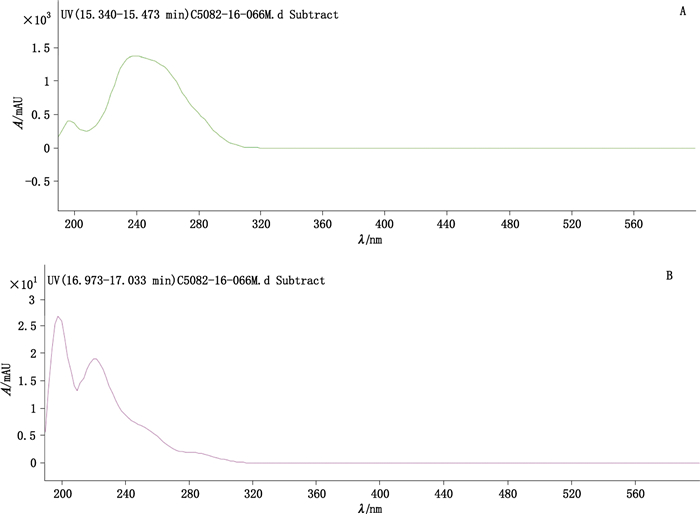
对比氯沙坦与RRT 1.12杂质紫外扫描图谱,发现两者在190~320 nm均有2个最大吸收峰,分别在245和200 nm左右,但是较之氯沙坦钾,RRT 1.12杂质的吸收峰向短波长处移动了20 nm,此外两者在220~320 nm区间的UV扫描图谱特征差异也较大。因此,推断此RRT 1.12杂质分子与氯沙坦紫外吸收基团应该不同(见图 4)。
|
图 4 氯沙坦钾(A)与RRT 1.12未知杂质(B)紫外吸收光谱对比 Figure 4 Comparison of UV absorption spectra between lorsartan potassium (A)and the impurity (B)with RRT 1.12 |
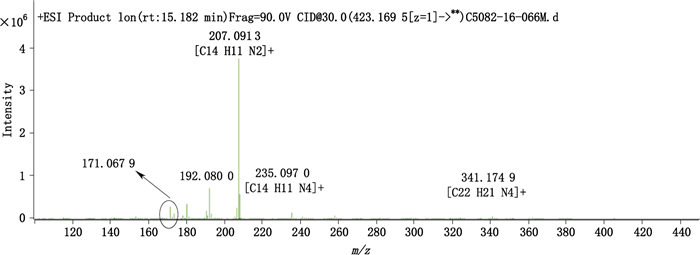
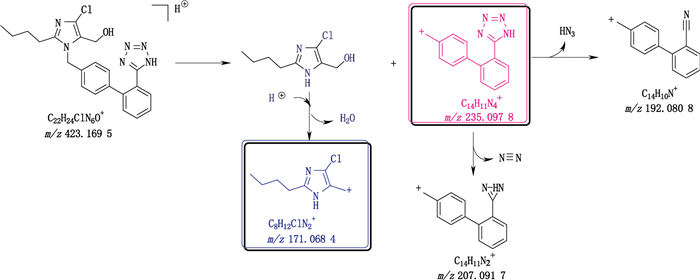
分析氯沙坦的二级质谱,发现在联苯四氮唑与咪唑环连接的位置容易断裂产生m/z 235的碎片,m/z 235碎片消除脱去一分子叠氮酸形成氰基化物即产生m/z 192的碎片,此外m/z 235碎片也可以消除脱去一分子氮气形成三环二氮唑产生m/z 171碎片;而咪唑环中性部分脱水后可以产生m/z 171碎片(见图 5),详细的碎片裂解路线见图 6。
|
图 5 碰撞模式下氯沙坦二级高分辨质谱谱图(碰撞能量:30 eV) Figure 5 High resolution MS2 fingerprint spectrum of losartan by collision-induced decomposition(CID) (collision energy:30 eV) |
|
图 6 氯沙坦的二级质谱裂解规律 Figure 6 MS2 fragmentation regularities of losartan |
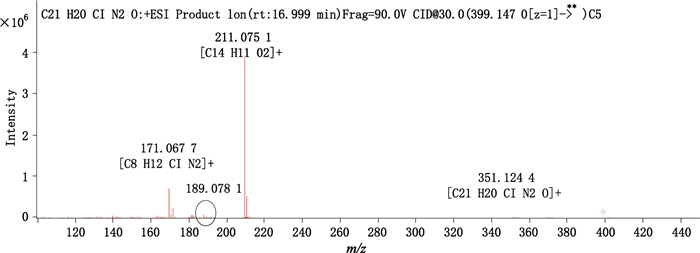
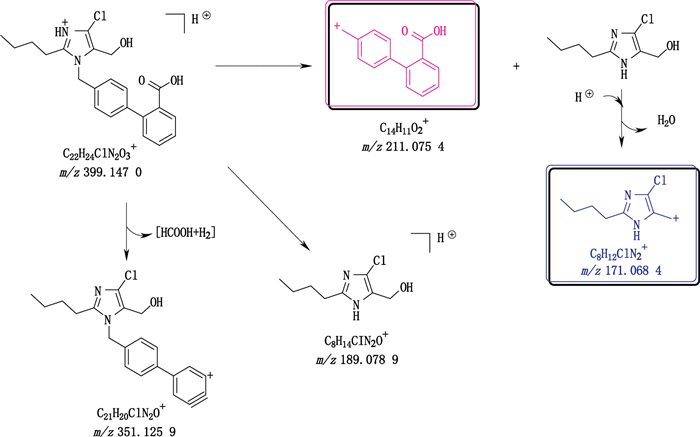
解析氯沙坦钾RRT 1.12杂质二级质谱,发现该杂质也能产生相同的m/z 171碎片峰,但是,其脱去咪唑环部分产生区别于氯沙坦的m/z 211特征碎片峰(见图 7),此碎片不会产生脱叠氮酸及氮气等中性分子而进一步降解。对比一级质谱结果,该杂质二级质谱也符合分子中四氮唑被羧基取代的结构特征,具体的二级质谱碎片解析见图 8。若该杂质为四氮唑被羧基取代后产生,则其对200~320 nm下发色团吸收系数贡献值降低,符合RRT 1.12杂质与氯沙坦的紫外扫描光谱特征。
|
图 7 碰撞模式下氯沙坦RRT 1.12未知杂质二级高分辨质谱谱图(碰撞能量:30 eV) Figure 7 High resolution MS2 fingerprint spectrum of impurity with RRT 1.12 in losartan by collision-induced decomposition (CID)(collision energy:30 eV) |
|
图 8 氯沙坦钾RRT 1.12杂质的二级质谱裂解规律 Figure 8 MS2 fragmentation regularities of impurity with RRT 1.12 in losartan |
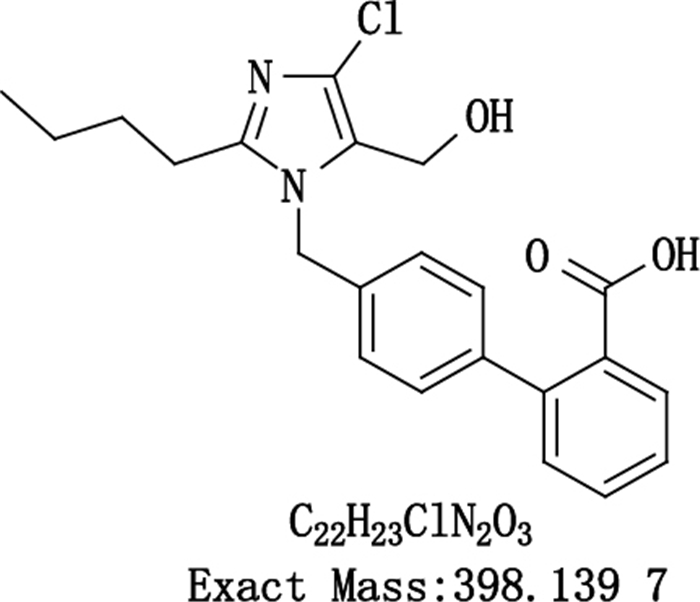
根据如上调查结果,推断LOS-16-066批氯沙坦钾有关物质检测中的RRT 1.12杂质为氯沙坦羧酸,其通用化学名为2-{4-[2-丁基-4-氯-5-(羟甲基)-咪唑基]苯基}苯甲酸,结构式见图 9。
|
图 9 氯沙坦羧酸(RRT 1.12杂质)结构式 Figure 9 Structure of Losartan carboxylic acid(impurity with RRT 1.12)in lorsartan |
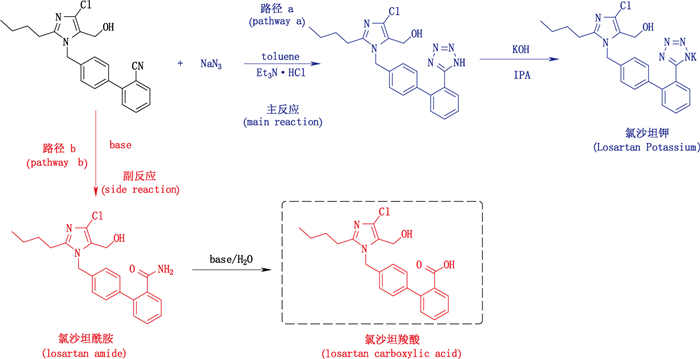
为了探明目标杂质产生的原因,结合解析出的氯沙坦羧酸杂质结构,对生产过程中该杂质产生原因进行了深入调查后发现,氯沙坦钾上四氮唑反应工序是液固两相反应,在反应过程中,加入的叠氮化钠与原料氯腈无法充分混合,导致反应结束后仍有部分(3%~5%)氯腈原料反应不完全,残留的带氰基的氯腈原料在后续的强碱性NaOH溶液分层及KOH-异丙醇高温成盐的过程中氰基水解成羧基即变成氯沙坦羧酸杂质,由于该羧酸杂质与氯沙坦钾理化性质非常接近,在生产工艺的结晶条件下去除效果不足30%,因此会大量残留于产品中。氯沙坦羧酸产生的反应方程式见图 10。
|
图 10 杂质氯沙坦羧酸产生的机理 Figure 10 Proposed formation mechanism of losartan carboxylic acid impurity in losartan potassium |
为了证实以上推断,实验模拟氯沙坦钾API生产工艺条件,即将产物氯沙坦钾及原料氯腈分别在酸、碱条件下升温至80~100 ℃反应10 h,LS-MS检测结果显示氯沙坦钾在酸、碱条件下以及氯腈在酸性条件下均未降解产生RRT 1.12杂质,而氯腈在强碱性(KOH)条件下升温至80~100 ℃[溶剂异丙醇-水(1: 1)]产生3.44%的RRT 1.12杂质,并且同时产生了14.09%的氯沙坦酰胺(即RRT 1.12杂质产生过程中的1个中间体),实验结果表明RRT 1.12杂质来源于反应不完全的原料氯腈在碱性条件下降解产生。
探明杂质来源后,立即着手通过工艺优化对杂质进行控制。首先在上四氮唑工序中加入0.2%~1%含量的相转移催化剂四丁基溴化铵,反应结束后原料氯腈的残留量下降至1.5%~2%左右。其次将反应时间由30 h延长至42 h后,反应液中氯腈的含量进一步降低至1%以下。再在后续的处理的过程中增加一次碱液洗涤后,形成的氯沙坦羧酸杂质转化成钠盐被完全去除至水相中。按照以上优化后的工艺,后续生产批次的氯沙坦钾成品此杂质的含量均低于最终产品有关物质中单个杂质0.02%的报告限,并且由于同时提高了原料氯腈的转化率,氯沙坦钾成品收率提高了3%~5%的,较大幅度地降低了生产成本。
3 结论综上,本文通过应用LC-PDA-QTOF-MS方法快速地检测出RRT1.12杂质结构,结合生产工艺推断并证实该杂质由反应不完全的原料在强碱条件下降解产生。探明原因后,通过工艺优化,杂质得到有效控制。
| [1] |
LI M, LIN M, RUSTUM A. Application of LC-MS (n)in conjunction with mechanism-based stress studies in the elucidation of drug impurity structure:rapid identification of a process impurity in betamethasone 17-valerate drug substance[J]. J Pharm Biomed Anal, 2008, 48(5): 1451. DOI:10.1016/j.jpba.2008.09.021 |
| [2] |
LIU C, YU Z, WANG F, et al. Isolation and structural eluccidation of an unknown impurity in prasugrel by semi-preparative liquid chromatography[J]. J Chromatogr Sci, 2015, 53(7): 1163. DOI:10.1093/chromsci/bmu211 |
| [3] |
WANG X, ZHOU H, ZHENG J, et al. Identification and characterization of four process-related impurities in retigabine[J]. J Pharm Biomed Anal, 2012, 71(12): 148. |
| [4] |
陈建国. 药理学[M]. 第3版. 北京: 科学出版社, 2010, 208. CHEN JG. Pharmacology[M]. 3rd Ed. 2010, 208. |
| [5] |
GOLDBERG AI, DUNLAY MC, SWEET CS. Safety and tolerability of losartan potassium, an angiotensin Ⅱ receptor antagonist, compared with hydrochlorothiazide, atenolol, felodipne ER, and angiotensin-converting enzyme inhibitors for the treatment of systemic hypertension[J]. J Am Coll Cardiol, 1995, 75(12): 793. DOI:10.1016/S0002-9149(99)80413-5 |
| [6] |
GOA KL, WAGSTAFF AJ. Losartan potassium:a review of its pharmacology, clinical efficacy and tolerability in the management of hypertension[J]. Drugs, 1996, 51(5): 820. DOI:10.2165/00003495-199651050-00008 |
| [7] |
NOVARTISPHARMA AG.Process for the preparation of tetrazole derivatives from organo boron and organoaluminiumazides:WO, 2005014602, A1[P].2005-02-17
|
| [8] |
浙江海正药业股份有限公司. 一种制备洛沙坦的方法: 中国, 200610126828. 7[P]. 2007-02-21 Zhejiang Hisun Pharmceutical.A preparation method of losartan:China, 200610126828.7[P].2007-02-21 |
| [9] |
Suven Life Sciences.An improved process for the preparation of losartan:WO, 2007020654, A1[P].2007-02-22
|
| [10] |
Unichem Lab LTD.An improved process for the manufacture of losartan potassium:WO, 2007119246, A2[P].2007-10-25
|
| [11] |
Hanmi Pharm Ind Co LTD.Method for preparing losartan:WO, 2007133040, A1[P].2007-11-22
|
| [12] |
RAMACHANDRA B. Development of impurity profiling methods using Mmodern analytical techniques[J]. Crit Rev Anal Chem, 2017, 47(1): 24. DOI:10.1080/10408347.2016.1169913 |
| [13] |
朱培曦, 陈娟娟, 李会林, 等. 液质联用快速确定尼群地平原料药中的杂质[J]. 药物分析杂志, 2012, 32(1): 88. ZHU PX, CHEN JJ, LI HL, et al. Characterization of impurities in nitrendipine bulk drug by liquid chromatography/ion trap mass spectrometry[J]. Chin J Pharm Anal, 2012, 32(1): 88. |
| [14] |
DETATA D, COLLINS P, MCKINLEY A. A fast liquid chromatography quadrupole time-of-flight mass spectrometry (LC-QTOF-MS)method for the identification of organic explosives and propellants[J]. Forensic SciInt, 2013, 233(1-3): 63. |
| [15] |
OTTARDO R, SORIO D, MUSILE G, et al. Screening for synthetic cannabinoids in hair by using LC-QTOF MS:a new and powerful approach to study the penetration of these new psychoactive substances in the population[J]. Med Sci Law, 2014, 54(1): 22. DOI:10.1177/0025802413477396 |
| [16] |
HERNÁNDEZ F, IBÁ |
 2017, Vol. 37
2017, Vol. 37 
