2. 江苏神华药业有限公司, 淮安 211600
2. Jiangsu Shenhua Pharmaceutical Co., Ltd., Huaian 211600, China
绞股蓝为葫芦科植物绞股蓝Gynostemma pentaphyllum(Thunb.)Makino的全草, 始载于《救荒本草》, 又名“七叶胆”“五叶参”“小苦药”等, 广泛分布于陕西、山西和长江以南各地[1], 是一类“药食同源”类植物资源。
绞股蓝性寒, 味甘苦, 长于补气养阴、清肺化痰、养心安神, 其应用日趋广泛, 多被开发成保健品或药品, 如治疗高脂血症的绞股蓝颗粒、绞股蓝口服液[2-3]。核苷类成分是生物细胞维持生命活动的基本组成元素, 参与DNA代谢过程, 具有抗肿瘤, 抗病毒、免疫调节、改善心脑血管循环、抑制神经递质释放等作用。目前在绞股蓝的质量评价方面多以皂苷、黄酮等类成分为主要考察指标[4-6], 关于核苷类成分的含量测定, 笔者尚未见报道。
目前, 核苷类化合物的定量方法主要有高效液相色谱法(HPLC法)、毛细管电泳法(CE法)、液相色谱-质谱联用技术(LC-MS法)等[7-9]。HPLC法难以解决组分共流出现象, 而CE法的定量检测重现性又相对较差。高分离度快速液相色谱质谱联用(UFLC-QTRAP-MS/MS)技术具有灵敏度高, 选择性强, 定量准确, 分析速度快等优点。因此, 本实验采用UFLC-QTRAP-MS/MS技术建立同时测定10个分析物(6个核苷:胸苷、尿苷、腺苷、肌苷、2′-脱氧鸟苷、鸟苷和4个碱基:腺嘌呤、次黄嘌呤、尿嘧啶、鸟嘌呤)的分析方法, 以期为绞股蓝的内在质量的综合评价和全面控制提供科学依据。
1 仪器与试药 1.1 仪器AB Sciex QTRAP 5500质谱仪(ABSciex公司);LC-20A快速液相仪(配有DGU-20A3在线脱气机、LC-20ADXR泵、SIL-20AXR自动进样器及CTO-20AC柱温箱, Shimadzu公司);Waters公司XBridge Amide氨基色谱柱(2.1 mm×100 mm, 3.5 μm;基质:基于亚乙基桥杂化颗粒(BEH)的三键键合酰胺基);KH-500DB型数控超声波清洗器(500 W, 昆山禾创超声仪器有限公司);Sartorius BT125D十万分之一电子天平和ME36S型百万分之一电子天平(Sartorius公司);TGL-16B型离心机(上海安亭科学仪器厂)。
1.2 试药对照品腺嘌呤(批号110886-200001)、尿嘧啶(批号100469-200401)、鸟嘌呤(批号140631-200904)、腺苷(批号110879-200202)、肌苷(批号140669-201104)和尿苷(批号110887-200202)均购于中国食品药品检定研究院(纯度均>98%), 次黄嘌呤(批号B20211, 纯度>98%)购于源叶生物科技有限公司, 胸苷(批号1001182663)、2′-脱氧鸟苷(批号1000943454)和鸟苷(批号1001103046)购自美国SIGMA公司(纯度均>98%);水为超纯水, 甲醇为色谱纯, 其余试剂为分析纯。
不同产地批号的绞股蓝样品经南京中医药大学陈建伟教授鉴定为葫芦科植物绞股蓝Gynostemma pentaphyllum(Thunb.)Makino的全草, 样品信息见表 1。
|
|
表 1 样品信息 Table 1 Sample information |
分别精密称取胸苷、尿苷、腺苷、肌苷、2′-脱氧鸟苷、鸟苷、腺嘌呤、次黄嘌呤、尿嘧啶、鸟嘌呤的对照品适量, 加纯化水超声助溶, 制成质量浓度分别为100.00、101.60、98.60、99.20、99.00、98.00、98.20、99.20、98.40、98.40 μg·mL-1的各对照品储备溶液;取各对照品储备液适量, 加纯化水定容至100 mL制成混合对照品溶液, 其中各成分浓度分别为3 936.00、200.00、3 048.00、1 984.00、1 016.00、990.00、1 972.00、2 940.00、196.00、1 476.00 ng·mL-1, 并逐级梯度稀释, 得到5种系列浓度的混合对照品溶液, 用于建立回归方程及线性范围检测。
2.1.2 供试品溶液取使用石油醚脱脂后的绞股蓝粉末1.0 g, 过60目筛, 精密称定, 置于50 mL具塞锥形瓶中, 精密加入超纯水20 mL, 室温下超声(50 W, 40 kHz)处理60 min, 过滤, 滤液以12 000 r·min-1离心, 取上清液, 过0.22 μm滤膜, 即得供试品溶液。
2.2 分析条件 2.2.1 色谱条件采用Waters XBridge Amide氨基色谱柱(2.1 mm×100 mm, 3.5 μm), 以0.2%甲酸水溶液(A)-0.2%甲酸乙腈(B)为流动相, 0.6 mL·min-1流速梯度洗脱(0~2.5 min, 15%A;2.5~5 min, 15%A→50%A;5~7 min, 50%A;7~8 min, 50%A→15%A;8~11 min, 15%A), 进样量2 μL。
2.2.2 质谱条件使用AB Sciex QTRAP 5500三重四极杆-线性离子肼串联质谱仪在电喷雾正离子(ESI+)模式下进行多反应监测(MRM)检测, 气帘气(curtain gas)为0.24 MPa, Gas 1为0.38 MPa, Gas 2为0.38 MPa, 温度为550 ℃, 喷雾电压(ionspray pressure)为5 500 V, 同时对检测离子对、去簇电压(DP)、碰撞能量(CE)、进行优化, 优化后的质谱条件参数见表 2。
|
|
表 2 优化的质谱条件参数 Table 2 Optimum parameters for mass spectrometry |
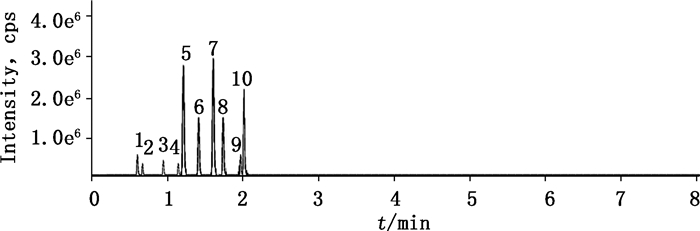
精密吸取“2.1.1”项下5种浓度系列的混合对照品溶液2 μL, 按“2.2”项下分析条件进行测定, 以峰面积Y对相应浓度X进行回归计算, 回归方程见表 3。混合对照品溶液的MRM图见图 1。10个成分的混合对照品通过梯度洗脱在3 min内得到完全分离, 各成分保留时间:尿嘧啶, 0.61 min;胸苷, 0.68 min;尿苷, 0.95 min;次黄嘌呤, 1.15 min;肌苷, 1.21 min;2′-脱氧鸟苷, 1.43 min;腺苷, 1.62 min;鸟苷, 1.77 min;腺嘌呤, 1.93 min;鸟嘌呤, 2.06 min。
|
|
表 3 10个分析物的回归方程、相关系数、线性范围、定量限和检测限 Table 3 Regression equations, correlation coefficients, linear ranges, quantitation limit and detection limit of 10 components |
|
1.尿嘧啶(uracil)2.胸苷(thymidine)3.尿苷(uridine)4.次黄嘌呤(hypoxanthine)5.肌苷(inosine)6. 2′-脱氧鸟苷(2′-dideoxyguanosine)7.腺苷(adenosine)8.鸟苷(guanosine)9.腺嘌呤(adenine)10.鸟嘌呤(guanine) 图 1 混合对照品10个分析物的MRM图 Figure 1 MRM chromatograms of 10 analytes in mixed reference substances |
精密吸取混合对照品溶液适量, 加纯化水逐级稀释, 进样测定, 以S/N≥10测得各成分定量限, 以S/N≥3测得各成分检测限, 结果见表 3。
2.3.2 精密度试验取“2.1.1”项下混合对照品溶液, 按“2.2”项下分析条件分别连续进样测定6次, 计算10个分析物峰面积的RSD。结果尿嘧啶、胸苷、尿苷、次黄嘌呤、肌苷、2′-脱氧鸟苷、腺苷、鸟苷、腺嘌呤、鸟嘌呤的RSD分别为3.3%、1.9%、2.2%、3.3%、2.1%、1.9%、2.5%、3.2%、1.0%、1.0%, 表明仪器精密度良好。
2.3.3 稳定性试验取“2.1.2”项下供试品溶液, 按“2.2”项下分析条件分别于0、2、4、8、12、24 h进样测定, 计算10个分析物峰面积的RSD。结果尿嘧啶、胸苷、尿苷、次黄嘌呤、肌苷、2′-脱氧鸟苷、腺苷、鸟苷、腺嘌呤、鸟嘌呤的RSD分别为2.1%、3.3%、4.0%、1.7%、3.7%、2.7%、2.7%、1.2%、3.9%、3.7%, 表明它们在24 h内稳定性良好。
2.3.4 重复性试验取S8样品(湖南20150109)6份, 按“2.1.2”项下方法制备供试品溶液, 按“2.2”项下分析条件进样测定, 计算10个分析物的含量及其RSD。结果尿嘧啶、胸苷、尿苷、次黄嘌呤、肌苷、2′-脱氧鸟苷、腺苷、鸟苷、腺嘌呤、鸟嘌呤的平均含量分别为441.07、8.08、459.84、23.21、5.03、4.61、338.63、350.69、40.58、166.24 μg·g-1, RSD分别为2.4%、2.2%、3.2%、3.3%、1.6%、3.4%、3.9%、2.0%、2.8%、4.0%, 表明方法重复性良好。
2.3.5 加样回收率试验取已知含量的绞股蓝S8样品0.5 g(6份), 精密称定, 分别加入尿嘧啶、胸苷、尿苷、次黄嘌呤、肌苷、2′-脱氧鸟苷、腺苷、鸟苷、腺嘌呤、鸟嘌呤单一成分的对照品溶液适量, 按“2.1.2”项下方法制备加样回收率供试溶液, 按“2.2”项下分析条件进样测定, 根据测得量和加入量计算回收率, 结果见表 4。
|
|
表 4 加样回收率试验结果(n=6) Table 4 Recovery test results |
取不同产地的绞股蓝原药材和商品药材粉末1.0 g, 按“2.1.2”项下方法制备供试品溶液, 根据相应回归方程计算供试样品中10个分析物的含量, 结果见表 5。
|
|
表 5 绞股蓝不同产地及商品药材中10个分析物的含量(μg·g-1,n=2) Table 5 Results of content determination of 10 analytes in G. pentaphyllum from different habitats and commercial sources |
通过查阅相关文献[10-11], 分别考察了提取溶剂(水、甲醇)、料液比(1:10、1:20和1:40)、提取方法(回流、超声处理)及提取时间(30、60和120 min)。结果表明, 超声提取与回流提取效果差异不大, 但超声更加方便易行;提取溶剂以水作为溶剂效果更好, 可以提取出更多待测物, 因此选择水作溶剂;提取时间以60 min较适宜, 料液比为1:20。
3.2 色谱-质谱条件的优化待测的成分极性大, 呈弱碱性, 较难分离。本试验采用Waters XBridge Amide色谱柱进行分离, 分别对甲醇-甲酸水和乙腈-甲酸水, 甲酸乙腈-甲酸水为流动相进行考察, 结果表明, 核苷类成分在甲酸乙腈-甲酸水梯度系统的分离效果更好, 且化合物的峰形能得到改善, 响应值有所提高。核苷酸中同时存在氨基和磷酸基团, 其正负离子形式都比较稳定, 考虑到同时检测多种核苷及碱基, 因此选择正离子模式作为质谱的离子化模式。
3.3 实验结果分析从表 5中可看出, 绞股蓝核苷类成分中以尿嘧啶、尿苷、鸟苷、鸟嘌呤含量较高, 以尿嘧啶含量居首, 远高于其他成分, 肌苷、胸苷、2′-脱氧鸟苷的含量较低, 不同产地及商品药材中核苷类成分含量有所差异, 其中, 核苷类成分总量以江苏苏州产绞股蓝(S13号样品)中较高, 陕西产绞股蓝(S1号样品)较低, 其成分的含量的差异可能与当地气候条件, 土壤情况, 以及采收时期有关[12], 值得进一步研究绞股蓝化学成分的差异, 以便更好地控制绞股蓝质量。
随着近年来人们生活水平的不断提高, 以及人们健康保健意识的增强, 对保健品的需求也与日俱增。作为药食同源的绞股蓝是不可替代的天然植物, 其抗氧化, 改善心脑血管循环, 保护心脏等作用[13-14]正在不断为消费者所喜爱。因此, 以绞股蓝为基础的药品、保健品、食品的开发应注重质量评价方法与药效物质组成的相关性[15]。本实验建立了UFLC-QTRAP-MS/MS同时测定绞股蓝药材中10个分析物含量的方法, 对国内主要产区及商品药材进行比较分析, 为绞股蓝药材内在质量的综合评价和全面控制提供科学依据。
| [1] |
国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999, 532. State Administration of Traditional Chinese Medicine "Chinese Material Medica" Editorial Board. Chinese Material Medica[M]. Shanghai: Shanghai Science and Technology Publisher, 1999, 532. |
| [2] |
黄平, 钱康. 绞股蓝颗粒对早期糖尿病肾病肾脏肾素-血管紧张素系统的影响[J]. 中华中医药杂志, 2010(3): 434. HUANG P, QIAN K. Experimental study of gold theragran on rennin angiotensin system in diabetic nephropathy[J]. China J Tradit Chin Med Pharm, 2010(3): 434. |
| [3] |
王尧, 程宗琦, 吴憩. 正交试验优选绞股蓝口服液的最佳工艺[J]. 中成药, 2015, 37(12): 2767. WANG Y, CHENG ZQ, WU Q. Optimizing the production processes of Gynostemma pentaphyllum oral liquid by orthogonal experiment[J]. Chin Tradit Pat Med, 2015, 37(12): 2767. |
| [4] |
李风华, 陈素红, 吕圭源. 7个不同产地绞股蓝皂苷含量测定[J]. 中华中医药学刊, 2012, 30(4): 887. LI FH, CHEN SH, LÜ GY. Gynostemma determination of seven different areas[J]. Chin Arch Tradit Chin Med, 2012, 30(4): 887. |
| [5] |
彭亮, 李诒光, 陈杰, 等. 不同产地、不同品种绞股蓝总黄酮含量比较研究[J]. 亚太传统医药, 2015, 11(21): 33. PENG L, LI YG, CHEN J, et al. Study of total flavounes content in Gynostemma pentaphyllum(Thunb.)Makino from different producing areas and different varieties[J]. Asia-Pac Tradit Med, 2015, 11(21): 33. |
| [6] |
刘芳, 胡坪, ANNIKAK, 等. 绞股蓝药材黄酮类化合物的HPLC指纹图谱研究[J]. 中成药, 2009, 31(4): 493. LIU F, HU P, ANNIKA K, et al. HPLC fingerprinting of flavones in Gynostemma pentaphyllum[J]. Chin Tradit Pat Med, 2009, 31(4): 493. |
| [7] |
吕爱娟, 张志澄, 张科卫, 等. RP-HPLC法同时测定半夏中5种核苷含量的研究[J]. 药物分析杂志, 2007, 27(7): 1051. LÜ AJ, ZHANG ZC, ZHANG KW, et al. RP-HPLC determination of five nucleosides in Rhizoma Pinelliae[J]. Chin J Pharm Anal, 2007, 27(7): 1051. |
| [8] |
李进, 冯成强, 倪雪梅, 等. 毛细管电泳法测定青海不同产地冬虫夏草核苷类的含量[J]. 中国药学杂志, 2008, 43(14): 1105. LI J, FENG CQ, NI XM, et al. Determination of nucleosides of natural cordyceps sinensis in Qinghai Province by capillary electrophoresis[J]. Chin Pharm J, 2008, 43(14): 1105. |
| [9] |
郑丽红, 黄丽英, 陈瑜, 等. LC-MS法分析野生、种植和组培3种金线莲药材中的核苷类物质[J]. 中药材, 2015, 38(11): 2269. ZHENG LH, HUANG LY, CHEN Y, et al. Nucleobases in natural, cultured and tissue culture Anoectochilus ro roxburghii using LC-MS[J]. J Chin Med Mater, 2015, 38(11): 2269. |
| [10] |
叶斌, 李婷菲, 刘浩, 等. 人工蛹虫草总核苷提取工艺优化考察[J]. 中药材, 2011, 34(4): 644. YE B, LI TF, LIU H, et al. Optimization of extraction process of total nucleoside from artificial Cordyceps militaris[J]. J Chin Med Mater, 2011, 34(4): 644. |
| [11] |
张静, 丁博, 张华, 等. 正交试验优化川党参总核苷的提取工艺[J]. 中国实验方剂学杂志, 2016, 22(11): 34. ZHANG J, DING B, ZHANG H, et al. Optimization of extraction technology for total nucleosides from Codonopsis tangshen by orthogomal test[J]. Chin J Exp Tradit Med Form, 2016, 22(11): 34. |
| [12] |
李馨芸, 刘世彪, 易浪波, 等. 绞股蓝属3种植物的总皂苷、总黄酮和矿质元素含量的季节性变化[J]. 中药材, 2012, 35(1): 26. LI XY, LIU SB, YI LB, et al. Seasonal changes of total saponins, flavonoids and mineral elements content in 3 species of genus Gynostemma plants[J]. J Chin Med Mater, 2012, 35(1): 26. |
| [13] |
LIU J, ZHANG L, REN Y, et al. Anticancer and immunoregulatory activity of Gynostemma pentaphyllum polysaccharides in H22 tumor-bearing mice[J]. Int Biol Macromol, 2014, 69(6): 1. |
| [14] |
XIE Z, HUANG H, ZHAO Y, et al. Chemical composition and anti-prol iferative and anti-inflammatory effects of the leaf and whole-plant samples of diploid and tetraploid Gynostemma pentaphyllum(Thunb.)Makino[J]. Food Chem, 2012, 132(1): 125. DOI:10.1016/j.foodchem.2011.10.043 |
| [15] |
杜正彩, 邓家刚. 复方绞股蓝益智颗粒改善记忆作用临床观察[J]. 中国实验方剂学杂志, 2012, 18(12): 262. DU ZC, DENG JG. Clinical observation of compound Jaogulan granules on memory improvement in human[J]. Chin J Exp Tradit Med Form, 2012, 18(12): 262. DOI:10.3969/j.issn.1005-9903.2012.12.075 |
 2017, Vol. 37
2017, Vol. 37 
