乳酶生(别名:表飞鸣)为乳酸菌制剂, 是一种助消化药, 用于治疗肠内异常发酵引起的肠胀气以及消化不良引起的腹泻等[1]。现收载于《中华人民共和国药典》2015年版二部[2], 其生产过程应符合微生态活菌制品总论项下的要求, 生产用菌种需进行脂肪酸测定[3]。脂肪酸是生物体的基本结构成分之一, 在细胞中绝大部分脂肪酸以结合形式存在, 构成具有重要生理功能的脂类, 它们是构成生物膜的重要物质[4]。现代微生物学研究表明:细菌的细胞结构中普遍含有的脂肪酸成分与细菌的DNA具有高度的同源性, 不同种属的细菌, 其脂肪酸的组成和含量表现出不同程度的差异, 并且这种差异是比较稳定的, 各种细菌具有其特征性的细胞脂肪酸指纹图谱[5]。并且脂肪酸分析可区分属、种并进行聚类, 其结果与16S rRNA基因序列分析有较好的一致性[6]。该方法在微生物鉴定及分型中已得到广泛应用[7-10]。本研究运用气相色谱-质谱(GC-MS)联用技术测定肠球菌属中6个标准菌株和乳酶生片菌株的脂肪酸组分, 并考察各菌株之间的同源性。
1 材料与仪器 1.1 材料粪肠球菌140623(中国食品药品检定研究院, 乳酶生生产用), 粪肠球菌CGMCC 1.2135、海氏肠球菌CGMCC 1.595、屎肠球菌CGMCC 1.131(中国普通微生物菌种保藏管理中心), 屎肠球菌CICC 21605、粪肠球菌CICC 23658(中国工业微生物菌种保藏管理中心);乳酶生片20批, 分别来源于6家生产企业, SMX公司(批号20100922、20101001、20101124、20101212)、GL公司(批号100601、101102)、HB公司(批号20101012、20101101、20101016、20101110)、LY公司(批号101008、110302)、SD公司(批号100503、110101、110503、100703)、LH公司(批号10090903、10091403);MRS培养基(广东环凯生物科技有限公司), 十二烷酸(C 12:0)对照品(纯度 > 99%, 批号N-12A-S8-T、NU-CHEK)、脂肪酸甲酯(C4~C24)混合对照品(纯度 > 99%, 批号014-U、NU-CHEK), 14%三氟化硼甲醇溶液(CNW Technology), 硫酸、甲醇、正己烷(Fisher scientific)。
1.2 仪器5975C质谱仪(安捷伦科技有限公司), Agilent 6890气相色谱仪(安捷伦科技有限公司), HP-5MS色谱柱(30 m×0.25 mm×0.25 μm;固定相:(5%-苯基)-甲基聚硅氧烷;安捷伦科技有限公司), AC2-6S1生物安全柜(ESCO公司), MSL3768高压灭菌锅(松下电器产业株式会社), HH-W600恒温电热三用水箱(北京医疗设备厂), KQ-500DR超声波清洗仪(江苏昆山市超声仪器有限公司), WGP-500电热恒温培养箱(上海安亭科学仪器厂), VD23电热真空干燥箱(BINDER公司), N-EVAP112氮吹仪(Organomation公司), 320R高速冷冻离心机(Hettich公司), BP211D电子天平(赛多利斯公司)。
2 试验方法 2.1 菌体的收集和干燥[11]将标准菌株及由原料分离得到的菌株转接入100 mL MRS培养基中, 37 ℃培养48~72 h, 于4 000 r·min-1离心10 min, 离心温度8 ℃, 倒去上清液, 用去离子水反复洗涤3次, 收集得到的菌体于60 ℃真空干燥3 h, 干燥菌体置于干燥器中, 备用。
2.2 气相色谱-质谱的条件[11]色谱条件:HP-5MS色谱柱(30 m×0.25 mm× 0.25 μm);载气为氦气;程序升温为120 ℃保持5 min;6 ℃·min-1升温至240 ℃, 保持10 min;10 ℃·min-1至260 ℃, 保持2 min;进样口温度250 ℃;分流比10:1;流量1.0 mL·min-1;进样量1 μL。
质谱条件:离子源EI;电子能量70 eV;溶剂延迟3 min;EMV模式为增益系数1;全扫描m/z 35~450;采样频率2。
2.3 脂肪酸甲酯化[11-12]精密称取干燥菌体或脂肪酸对照品50 mg于螺口试管中, 向试管加入14%三氟化硼-甲醇(或1%硫酸-甲醇)溶液2 mL, 立即充入N2密封, 并进行超声波震荡10 min, 置于70 ℃水浴30 min, 取出, 加入正己烷2 mL, 震荡约5 min, 取上清液, 再用1 mL正己烷洗涤, 合并上清液, 用0.22 μm滤膜过滤于干净进样瓶中, 用于GC-MS分析。
3 试验结果 3.1 色谱条件的确定将脂肪酸甲酯(C4~C24)混合对照品(25 mg)用正己烷定容于10 mL量瓶中, 进行GC-MS分析。脂肪酸甲酯(C4~C24)混合对照品有40个组分。在GC-MS条件下, 保留时间由6 min至35 min之间分离得到C10~C24共33个脂肪酸组分, 并且均具有较高的丰度(见图 1)。其中C18组分的含量最高, 各主要脂肪酸组分与质谱数据库的匹配度均在95%以上(见表 1)。试验表明, 该GC-MS条件能够鉴别出C10~C24的脂肪酸组分。
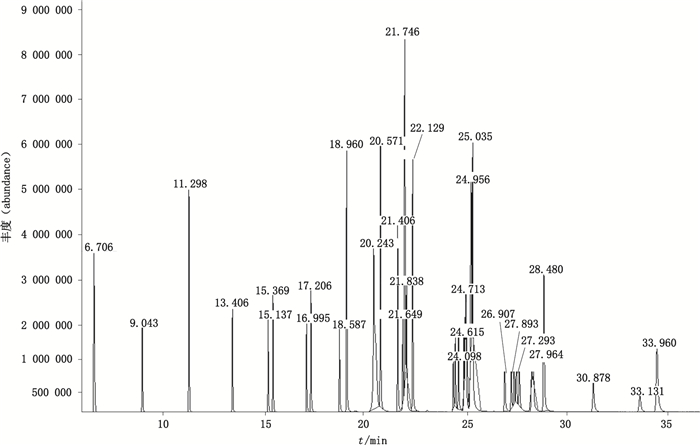
|
图 1 脂肪酸甲酯混合对照品气相色谱质谱总离子流图 Figure 1 GC-MS total ion chromatogram of mixed fatty acid methyl ester(FAME)reference standards |
|
|
表 1 脂肪酸甲酯混合对照品中主要脂肪酸组分的保留时间及相对含量 Table 1 Retention time and relative content of major fatty acid composition in mixed FAME reference standards |
为考察甲酯化方法的可靠性, 取同一批C12:0脂肪酸对照品6份, 分成A、B两组, 每组3份, 并各设1份空白组;按“2.3”项下方法, A组用14%三氟化硼-甲醇进行甲酯化, B组用1%硫酸-甲醇进行甲酯化, 将制备好的样品用上述建立的GC-MS条件进行分析。
在样品量和萃取的有机溶剂体积均相同的条件下, GC-MS图中保留时间相同的峰高和面积可以直接反映出待测样品中各个脂肪酸甲酯的含量, 通过比较它们之间的含量反映出甲酯化效果。A组的平均保留时间为11.329 min, RSD为0.00%(n=3);平均峰面积为1 334 436 394, RSD为3.12%(n=3)。B组平均保留时间为11.328 min, RSD为0.01%(n=3);平均峰面积为1 140 212 025, RSD为3.04%(n=3)。A组平均峰面积明显大于B组, 说明14%三氟化硼-甲醇甲酯化优于1%硫酸-甲醇甲酯化。因此, 采用14%三氟化硼-甲醇甲酯化法作为菌株脂肪酸甲酯化的方法。
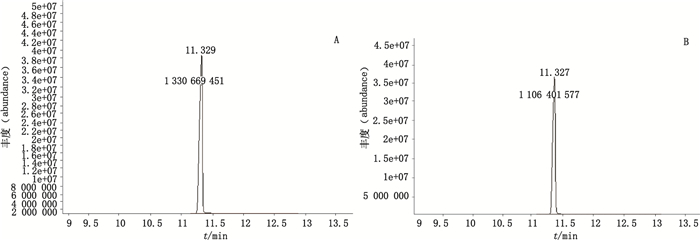
|
A. 14%三氟化硼-甲醇甲酯化法(14% boron fluoride-methanol methyl esterification)B. 1%硫酸-甲醇甲酯化法(1% sulphuric acid-methanol methyl esterification) 图 2 C12:0脂肪酸对照品气相色谱质谱总离子流图 Figure 2 GC-MS total ion chromatograms of C12:0 fatty acid reference standard |
取同一批次相同浓度的脂肪酸甲酯混合对照品5份, 平行进样。以第3个峰作为基准, 平均保留时间为11.437 min, RSD为0.01%(n=5);平均峰面积为258 799 329, RSD为2.07%(n=5)。说明仪器具有较好的稳定性。
3.3.2 甲脂化方法的重复性取相同质量的粪肠球菌140623干燥菌体5份, 按“2.3”项下方法, 进行14%三氟化硼-甲醇进行甲酯化的平行实验。以第3个峰与第1个峰的组分含量比值作为基准, 它们的平均值为2.864, RSD为1.30%(n=5)。说明14%三氟化硼-甲醇的甲酯化法具有较好的重复性。
3.4 菌株脂肪酸的GC-MS检测将标准菌株及6家生产企业的乳酶生片菌株脂肪酸甲酯化后, 进行GC-MS分析, 结果见图 3-9。

|
A.粪肠球菌(Enterococcus faecalis 140623) B.粪肠球菌(Enterococcus faecalis CGMCC1.2135) C.屎肠球菌(Enterococcus faecium CGMCC1.131) D.海氏肠球菌(Enterococcus hirae CGMCC1.595) E.屎肠球菌(Enterococcus faecium CICC21605) F.粪肠球菌(Enterococcus faecalis CICC23658) 图 3 标准菌株气相色谱质谱总离子流图 Figure 3 GC-MS total ion chromatograms of standard strains |
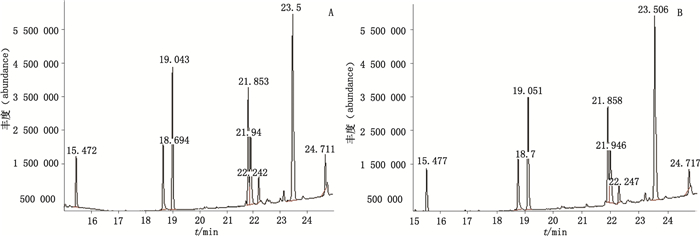
|
A.批号10090903(batch number 10090903)B.批号10091403(batch number10091403) 图 4 LH公司的乳酶生片菌株气相色谱质谱总离子流图 Figure 4 GC-MS total ion chromatograms of the strains of lactasin tablets produced by LH company |
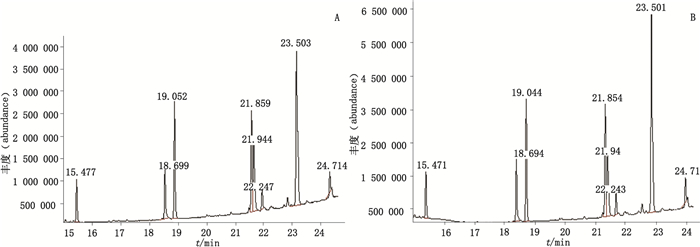
|
A.批号100601(batch number 100601)B.批号101102(batch number 101102) 图 5 GL公司的乳酶生片菌株气相色谱质谱总离子流图 Figure 5 GC-MS total ion chromatograms of strains of lactasin tablets produced by GL company |
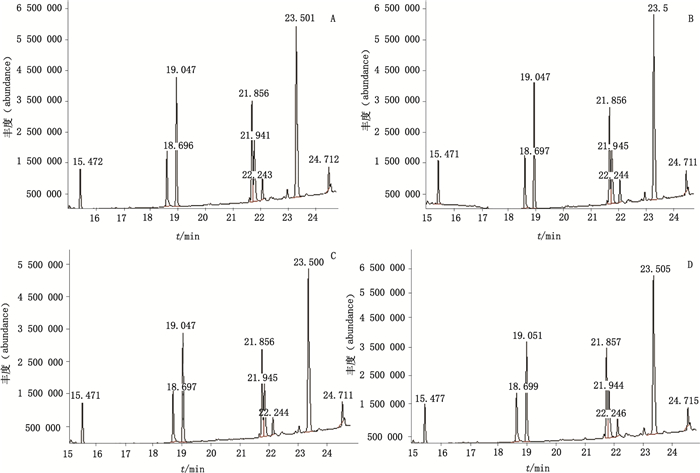
|
A.批号20101012(batch number 20101012)B.批号20101101(batch number 20101101)C.批号20101016(batch number 20101016)D.批号20101110(batch number 20101110) 图 6 HB公司的乳酶生片菌株气相色谱质谱总离子流图 Figure 6 GC-MS total ion chromatograms of strains of lactasin tablets produced by HB company |
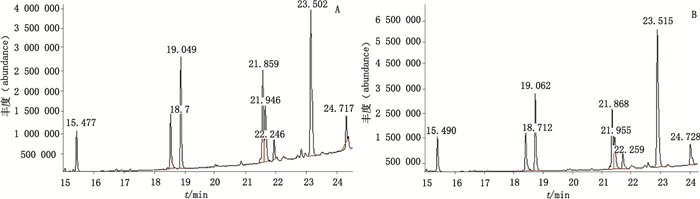
|
A.批号101008(batch number 101008)B.批号110302(batch number 110302) 图 7 LY公司的乳酶生片菌株气相色谱质谱总离子流图 Figure 7 GC-MS total ion chromatograms of strains of lactasin tablets produced by LYcompany |
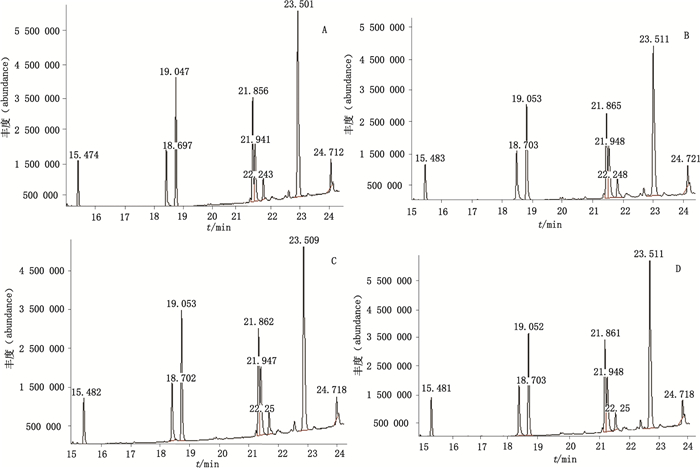
|
A.批号100503(batch number 100503)B.批号110101(batch number 110101)C.批号110503(batch number 110503)D.批号100703(batch number 100703) 图 8 SD公司的乳酶生片菌株气相色谱质谱总离子流图 Figure 8 GC-MS total ion chromatograms of strains of lactasin tablets produced by SD company |
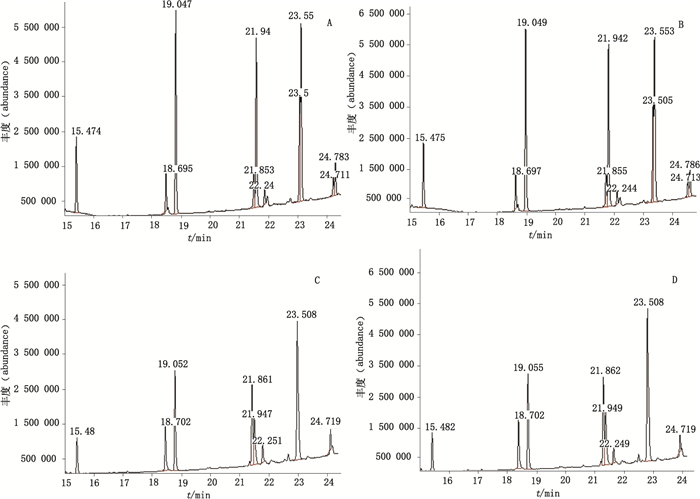
|
A.批号20100922(batch number 20100922)B.批号20101001(batch number 20101001)C.批号20101124(batch number 20101124)D.批号20101212(batch number 20101212) 图 9 SMX公司的乳酶生片菌株总离子流气相色谱图 Figure 9 GC-MS total ion chromatograms of strains of lactasin tablets produced by SMX company |
结果显示, 6个标准菌株与6家生产企业的乳酶生菌株气相色谱图中均出现了十四碳烷酸、十六碳烷酸、十六碳烯酸、十八碳烷酸以及十八碳烯酸等主要甲酯峰, 并且与脂肪酸甲酯混合对照品的相一致;同时, 还有十九碳烷酸的特征峰, 质谱数据库的匹配度均在94%以上。
6个标准菌株中屎肠球菌CGMCC 1.131和粪肠球菌140623的气相色谱图及各脂肪酸组分的比值相近, 而与其他4个标准菌株有较大差异。海氏肠球菌CGMCC 1.595与SMX公司批号为20100922和20101001的乳酶生菌株的气相色谱图相似;粪肠球菌140623与6家生产企业的其他乳酶生菌株的气相色谱图相似, 用面积归一化法计算各脂肪酸组分相对百分含量, 得到的各脂肪酸组分的比值相近, 见表 2。
|
|
表 2 标准菌株及乳酶生片菌株脂肪酸组分的相对含量(%) Table 2 Relative content of fatty acids in standard strains and lactasin tablets strains |
本研究建立了细菌脂肪酸甲酯化及GC-MS检测方法, 并对肠球菌属部分标准菌株和乳酶生片菌株进行脂肪酸组分分析。实验发现所有菌株均具有十四碳烷酸、十六碳烷酸、十六碳烯酸、十八碳烷酸、十八碳烯酸及十九碳烷酸特征峰, 脂肪酸组分基本一致, 说明这6个组分为肠球菌属的主要特征脂肪酸。6个标准菌株虽然同属于肠球菌属, 但是其来源或菌名各不相同。从脂肪酸各组分气相色谱图及比值上分析, 除了粪肠球菌140623与屎肠球菌CGMCC 1.131相似外, 其他菌株间均有较大差异;SMX公司批号为20100922和20101001的乳酶生片菌株与海氏肠球菌CGMCC 1.595之间, 6家生产企业的其他乳酶生片菌株与粪肠球菌140623之间, 具有相似的气相色谱图及相近的脂肪酸组分比值。说明它们相互间具有较高的同源性, 与文献报道[13]的相同。在测定细菌的细胞脂肪酸组分时, 应注意控制培养条件(如培养基、培养时间等), 避免培养体系差异对结果的影响[14]。
粪肠球菌140623为乳酶生生产用菌株, 经鉴定分析应为屎肠球菌[13];海氏肠球菌CGMCC 1.595在2012年之前曾命名为“粪肠球菌”, 现已更正。由于乳酶生原质量标准[15]的生产菌株命名错误, 且未收载相关鉴定方法, 导致部分生产企业误用生产菌株。现行标准[2]虽已更正生产菌种名称, 但是尚未指定菌株来源及编号, 供乳酶生生产用菌株的名称也未及时更正, 势必导致标准在执行中出现生产菌株误用等问题, 影响乳酶生片的质量及安全性, 望监管部门加强并规范管理该品种的生产菌种。
| [1] |
甘永琦, 庞浩元, 朱斌. 乳酶生菌种安全性的研究[J]. 中国现代应用药学杂志, 2015, 32(8): 951. GAN YQ, PANG HY, ZHU B. Study on the safety of the strain of lactasin[J]. Chin J Mod Appl Pharm, 2015, 32(8): 951. |
| [2] |
中国药典2015年版. 二部[S]. 2015: 677 ChP 2015.Vol Ⅱ[S].2015:677 |
| [3] |
中国药典2015年版. 三部[S]. 2015: 44 ChP 2015.Vol Ⅲ[S].2015:44 |
| [4] |
张国赏, 吴文鹃, 潘仁瑞. 气相色谱-质谱法检测细胞脂肪酸及其在细菌鉴定上的应用[J]. 合肥联合大学学报, 2000, 10(4): 92. ZHANG GS, WU WJ, PAN RR. Determination of fatty acids in cells by GC-MS and its application in bacterium identification[J]. J Hefei Union Univ, 2000, 10(4): 92. |
| [5] |
秦巧玲, 粟婉媛, 吕均, 等. GC-MS联用分析测定志贺菌全细胞脂肪酸组成[J]. 中国卫生检验杂志, 2008, 18(3): 426. QIN QL, SU WY, LÜ J, et al. GC-MS analysis of fatty acid from whole cell of Shigella[J]. Chin J Health Lab Technol, 2008, 18(3): 426. |
| [6] |
张晓霞, 王直强, 李世贵, 等. 脂肪酸组分分析在不动杆菌鉴定中的应用[J]. 生物技术通报, 2009(6): 151. ZHANG XX, WANG ZQ, LI SG, et al. Identification of Acinetobacter spp.using fatty acid compositions analysis[J]. Biotechnol Bull, 2009(6): 151. |
| [7] |
狄慧玲, 张耀祺, 单潇潇, 等. 河北地区食源性单核细胞增生李斯特菌脂肪酸的分型研究[J]. 现代食品科技, 2014, 30(11): 65. DI HL, ZHANG YQ, SHAN XX, et al. Fatty aacid typing analysis of food-borne Listeria monocytogenes in Hebei area[J]. Mod Food Sci Technol, 2014, 30(11): 65. |
| [8] |
WANG X, YAO J, YU Z. GC-MS determination of fatty acids in arachidonic acid high-yield strain induced by low-energy ion implantation[J]. Chem Papers, 2005, 59(4): 240. |
| [9] |
赵晖, 李家勇, 李晶, 等. 单核细胞增生李斯特菌脂肪酸组分的气相色谱-质谱分析[J]. 化学与生物工程, 2008, 25(11): 68. ZHAO H, LI JY, LI J, et al. Analysis of fatty acid from Listeria monocytogenes by gas chromatography-mass spectrometry[J]. Chem Bioeng, 2008, 25(11): 68. DOI:10.3969/j.issn.1672-5425.2008.11.020 |
| [10] |
徐敏, 王静, 柴子涵, 等. 海洋细菌脂肪酸的气相色谱分析[J]. 海洋科学, 2013, 37(2): 76. XU M, WANG J, CHAI ZH, et al. Analysis of cellular fatty acid composition of marine bacteria by gas chromatography[J]. Marine Sci, 2013, 37(2): 76. |
| [11] |
崔昌浩, 田晶, 徐龙权. 气相色谱法在检测细胞脂肪酸及菌种鉴定中的应用[J]. 大连轻工业学院学报, 2007, 26(7): 104. CUI CH, TIAN J, XU LQ. Application of gas chromatography in identification of bacteria by analyzing fatty acid in cells[J]. J Dalian Inst Light Ind, 2007, 26(7): 104. |
| [12] |
韩旭, 霍贵成, 李春, 等. 气相色谱法测定乳酸乳球菌脂肪酸[J]. 东北农业大学学报, 2009, 40(9): 92. HAN X, HUO GC, LI C, et al. Analysis of fatty acid from Lactococcus lactis by gas chromatography[J]. J Northeast Agric Univ, 2009, 40(9): 92. |
| [13] |
甘永琦, 朱斌, 刘涛, 等. 乳酶生菌种鉴定方法的研究[J]. 华西药学杂志, 2013, 28(5): 529. GAN YQ, ZHU B, LIU T, et al. Study of identification method of the strain of lactasin[J]. West China J Pharm Sci, 2013, 28(5): 529. |
| [14] |
何蔚荭, 安明理, 陈国参, 等. 血液杆菌Haematobacter sp.细胞脂肪酸测定的影响因素[J]. 生物技术通报, 2015, 31(2): 217. HE WH, AN ML, CHEN GC, et al. The influence factors of determination of Haematobacter sp.cellular fatty acids[J]. Biotechnol Bull, 2015, 31(2): 217. |
| [15] |
卫生部药品标准. 二部第六册. 生化药品第一分册[S]. 1998: 64 Drug Specifications Promulgated by the Ministry of Public Health, P R China.Part 2, Vol 6.Biochemical Drug, Book One[S].1998:64 |
 2017, Vol. 37
2017, Vol. 37 
