2. 中药品质评价北京市重点实验室, 北京 100102;
3. 内蒙古医科大学药学院, 内蒙古 010110
2. Beijing Key Laboratory for Quality Evaluation of Chinese Materia Medica, Beijing 100102, China;
3. College of Pharmacy Inner Mongolia Medical University, Hohhot 010110, China
鸡血藤是常用的活血化瘀中药, 中国药典(2015年版)收载其为豆科植物密花豆SpatholobussuberectusDunn的干燥藤茎, 常用于治疗月经不调、痛经、经闭、风湿痹痛、麻木瘫痪、血虚萎黄等症[1], 主产于广东、广西两地;正品药材生长慢, 少有人工种植;随着药用需求量的增加, 野生资源蕴藏量逐渐减少, 目前商品药材多从越南、缅甸、柬埔寨、老挝等国家进口。另外, 其基原植物除中国药典记载的密花豆外, 还有6个属15种和变种的植物, 如丰城鸡血藤、大血藤、常春油麻藤等, 它们的化学成分、主治功效各不相同, 临床上不可混淆[2]。
鸡血藤主要含有黄酮类、萜类、木脂素类、甾醇类、酚酸类及其苷类等化学成分[3-4], 现代药理研究表明[5], 鸡血藤具有改善造血系统[6], 抗血栓[7], 抗肿瘤[8], 抗病毒[9], 抗关节炎[10], 抑制络氨酸酶[11]等多种药理作用。中国药典(2015年版)中仅规定了显微鉴别、水分灰分检查和醇溶性浸出物的测定项目, 无含量测定项。目前大多学者只测定了鸡血藤中的1个或2个指标性成分的含量[12-14], 不能全面地为鸡血藤的质量控制提供科学依据。因此本实验建立了HPLC同时测定原儿茶酸、儿茶素、表儿茶素、甘草素、芒柄花素和美迪紫檀素6个黄酮类化合物的方法, 并比较11批不同产地鸡血藤中这6个黄酮类化合物的含量差异, 为综合评价鸡血藤药材提供科学依据。
1 仪器与试药沃特世公司Waters 2695高效液相色谱仪(包括2695四元梯度泵, 在线脱气机, 自动进样器, 柱温箱, 2489紫外检测器, Empower色谱工作站);安捷伦公司AgilentZORBAX SB-C18色谱柱(4.6 mm×150 mm, 5 μm;填料:二异丁基稳定键合十八烷基硅烷键合硅胶);昆山市超声仪器有限公司KQ-250DE型医用数控超声仪;梅特勒-托利多公司NewClassic MF电子分析天平;上海爱朗仪器有限公司N-1000型旋转蒸发仪。
对照品原儿茶酸(批号PS001118, 纯度>98.0%)、儿茶素(批号PS1000-002, 纯度>99.0%)、表儿茶素(批号PS000001, 纯度>99.0%)、芒柄花素(批号PS0215-0025, 纯度>98.0%)均购自成都普思生物科技有限公司, 甘草素(批号CHB160309, 纯度≥98.0%)、美迪紫檀素(批号CHB160910, 纯度≥98.0%)均购自成都克洛玛生物科技有限公司;乙腈为色谱纯, 磷酸为色谱纯, 其他试剂均为分析纯, 蒸馏水为广州屈臣氏公司生产。1~11号样品为产自广西、广东、越南、云南的鸡血藤药材, 经北京中医药大学中药学院中药鉴定系刘春生老师鉴定为鸡血藤正品。
2 方法与结果 2.1 溶液的制备 2.1.1 供试品溶液鸡血藤干燥药材粉碎过40目筛, 取约1 g, 精密称定, 置具塞锥形瓶中, 精密加入三氯甲烷-甲醇(4:1)50 mL, 称量, 控温28 ℃超声处理(功率120 W, 频率100 kHz)60 min, 放冷, 再称量, 用三氯甲烷-甲醇(4:1)补足减失的量, 摇匀, 过滤, 减压浓缩至干, 甲醇溶解并定容至5 mL, 0.22 μm微孔滤膜过滤, 即得。
2.1.2 对照品储备液精密称取原儿茶酸、儿茶素、表儿茶素、甘草素、芒柄花素、美迪紫檀素的对照品适量, 分别用甲醇超声(功率200 W, 频率100 kHz)溶解并定容, 制得上述6个成分质量浓度分别为1.143、1.087、1.395、0.530、1.213、0.424 mg·mL-1的对照品储备液。
2.1.3 混合对照品溶液分别精密量取原儿茶酸、儿茶素、表儿茶素、芒柄花素的对照品储备液各5 mL, 甘草素、美迪紫檀素的对照品储备液各2 mL, 置同一25 mL量瓶中, 甲醇定容至刻度, 即得。
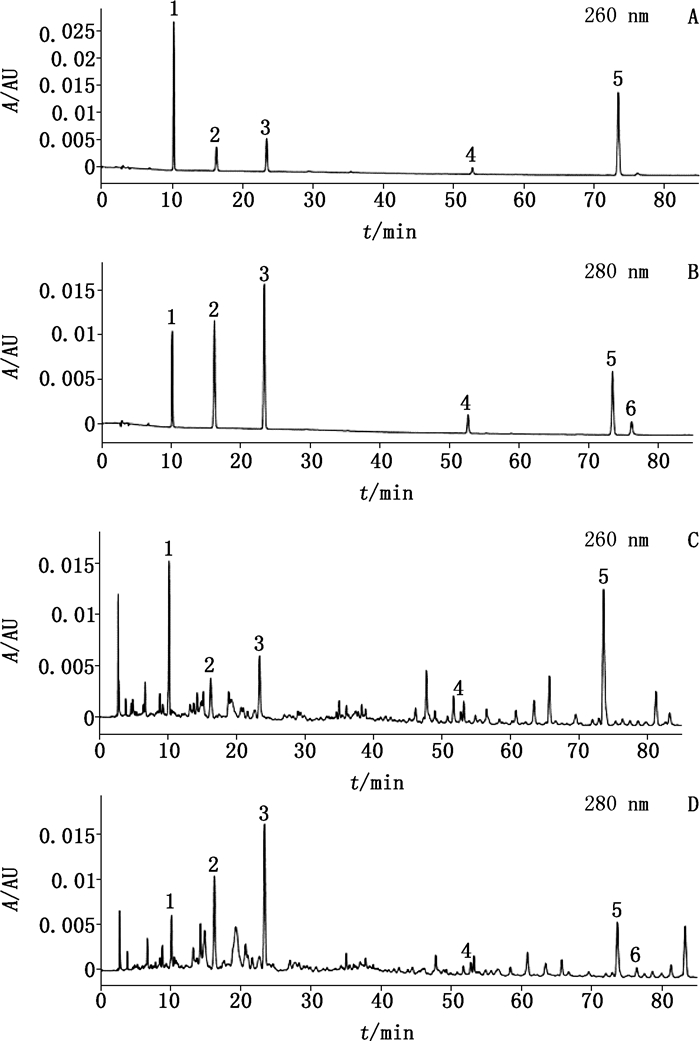
2.2 色谱条件采用Agilent ZORBAX SB-C18色谱柱(4.6 mm×150 mm, 5 μm), 柱温30 ℃, 以乙腈(A)-0.2%磷酸(B)为流动相, 梯度洗脱, 洗脱程序见表 1, 流速1 mL·min-1, 进样量10 μL, 检测波长260 nm(检测原儿茶酸、芒柄花素)、280 nm(检测儿茶素、表儿茶素、甘草素、美迪紫檀素);各峰分离度均大于1.5, 理论塔板数均大于10 000。对照品及1号样品色谱图见图 1。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution program |
|
1.原儿茶酸(protocatechuic acid) 2.儿茶素(catechol) 3.表儿茶素(L-epicatechin) 4.甘草素(liquiritigenin) 5.芒柄花素(formononetin) 6.美迪紫檀素(medicarpin) 图 1 混合对照品(A、B)和鸡血藤样品(C、D)色谱图 Figure 1 HPLC chromatograms of mixed reference substances(A, B)and Spatholobi Caulis samples(C, D) |
精密量取混合对照品溶液0.10、0.25、0.50、1.00、2.00、2.50、5.00、10.00 mL, 分别置10 mL量瓶中, 甲醇定容, 按“2.2”项下色谱条件测定, 以对照品质量浓度X为横坐标, 峰面积Y为纵坐标, 绘制标准曲线, 得回归方程、相关系数及线性范围, 结果见表 2。
|
|
表 2 6个黄酮类成分的线性关系实验结果 Table 2 Linarites of the six flavonoids |
取1号样品的供试品溶液, 按“2.2”项色谱条件, 分别在供试品溶液制备后0、4、8、14、20、24 h进样测定, 记录峰面积, 计算原儿茶酸、儿茶素、表儿茶素、甘草素、芒柄花素、美迪紫檀素的RSD分别为3.9%、4.5%、2.8%、2.7%、2.9%、2.4%。结果表明供试品溶液在24 h内稳定性良好。
2.5 精密度试验取混合对照品溶液, 按“2.2”项下色谱条件连续进样6次, 记录峰面积, 计算原儿茶酸、儿茶素、表儿茶素、甘草素、芒柄花素、美迪紫檀素的RSD分别为2.0%、2.1%、2.1%、2.1%、2.0%、1.9%。结果表明仪器精密度良好。
2.6 重复性试验取1号样品粉末约1 g共6份, 精密称定, 分别按“2.1.1”项下方法制备供试品溶液, 按“2.2”项下色谱条件进行分析, 结果原儿茶酸、儿茶素、表儿茶素、甘草素、芒柄花素、美迪紫檀素含量平均值(n=6)分别为0.250、1.430、1.711、0.034、0.240、0.113 mg·g-1, RSD分别为2.6%、2.8%、2.7%、1.9%、3.8%、3.4%。结果表明方法的重复性较好。
2.7 加样回收率试验取同一批已测知含量的1号样品粉末约0.5 g共6份, 精密称定(分别为0.499 8、0.499 6、0.500 1、0.499 8、0.500 4、0.500 3 g), 分别精密加入原儿茶酸、儿茶素、表儿茶素、甘草素、芒柄花素、美迪紫檀素的对照品溶液一定量, 按“2.1.1”项下方法制成供试溶液, 按“2.2”项下色谱条件进样测定, 计算加样回收率, 结果见表 3。
|
|
表 3 加样回收率试验结果(n=6) Table 3 Recoveriesof the six flavonoids |
取11批不同产地鸡血藤药材, 按“2.1.1”项下方法制备供试品溶液, 按“2.2”项色谱条件测定, 采用回归方程法计算, 结果见表 4。
|
|
表 4 鸡血藤中6个成分的含量测定结果(mg·g-1, n=3) Table 4 Results of content determination of six flavonoids inSpatholobi Caulis |
鸡血藤中所含的化学成分极性差别较大, 分别选择了三氯甲烷、乙酸乙酯、不同浓度甲醇水(50%、70%、90%、100%)、乙醇以及不同比例三氯甲烷与甲醇、不同比例二氯甲烷与甲醇为提取溶剂为提取溶剂, 发现以三氯甲烷-甲醇(4:1)为提取溶剂时, 色谱峰基线较为平稳, 提取率最高, 杂质干扰较少。因此选择三氯甲烷-甲醇(4:1)为提取溶剂。
实验测得的儿茶素与表儿茶素互为同分异构体, 据文献报道[15], 表儿茶素经长时间加热易发生差向异构化效应, 即向儿茶素转化。因此本实验不适合加热回流的方法, 分别比较超声(控温28 ℃)和冷浸2种提取方法, 结果表明超声处理法测得的各成分含量较冷浸法高, 且冷浸法时间较长, 因此本实验选择超声处理(控温28 ℃)。
以三氯甲烷-甲醇(4:1)为提取溶剂的前提下, 分别比较了超声30、45、60、75、90 min不同提取时间, 提取1、2、3次, 通过比较6个成分含量, 结果表明超声60 min, 提取1次即可提取完全。
3.2 流动相的选择由于鸡血藤中含有的化学成分种类较多, 极性跨度较大, 等度洗脱不能有效地分离药材中的所有化学成分, 因此本实验选择梯度洗脱。比较了甲醇-水、乙腈-水、甲醇-甲酸水、乙腈-甲酸水、甲醇-磷酸水、乙腈-磷酸水等流动相系统, 实验结果表明乙腈-磷酸水的分离效果较好;本实验又进一步比较了乙腈-0.1%磷酸水、乙腈-0.2%磷酸水、乙腈-0.3%磷酸水的影响, 发现乙腈-0.2%磷酸水作为流动相时, 色谱峰的分离度及对称性最好。因此本实验选择乙腈-0.2%磷酸水作为流动相进行梯度洗脱。
3.3 检测波长的选择本实验利用PDA检测器在210~400 nm范围内扫描, 发现原儿茶酸、儿茶素、表儿茶素、甘草素、芒柄花素、美迪紫檀素的最大吸收波长分别为260、279、279、249、277、280 nm, 因此本实验选择在260 nm下对原儿茶酸和芒柄花素2个成分进行测定, 在280 nm下对儿茶素、表儿茶素、甘草素、美迪紫檀素4个成分进行测定。
3.4 不同生药样品含量的比较从表 4数据可以看出, 不同产地药材中各成分的含量有一定的差异, 同一产地不同批次药材中各成分也有一定的差异。原儿茶酸、儿茶素、表儿茶素、甘草素、芒柄花素、美迪紫檀素的含量分别为0.250~0.898、1.447~5.662、1.759~11.925、0.035~0.134、0.218~0.535、0.065~0.585 mg·g-1。表儿茶素和儿茶素的含量较高, 均已高达1 mg·g-1, 其他4个成分含量相对较低。
3.5 小结本实验建立的HPLC-UV分析方法成功地用于定量分析11批鸡血藤药材中原儿茶酸、儿茶素、表儿茶素、甘草素、芒柄花素、美迪紫檀素的含量, 对该分析方法的方法学进行了验证, 其精密度、稳定性、重复性、回收率等均符合中国药典相关要求[16]。中国药典(2015年版)中尚未规定含量测定项, 此方法不仅可为综合评价鸡血藤药材的质量提供参考, 也可为中国药典收载该药提供科学数据。
| [1] |
中国药典2015年版. 一部[S]. 2015: 194 ChP 2015.VolⅠ[S].2015:194 |
| [2] |
翟明. 鸡血藤种质资源的鉴定与品质评价[D]. 广州. 广州中医药大学, 2010 ZHAI M.Studies on the Germplasm Identification and Quality Evaluation of Jixueteng[D]. Guangzhou:Guangzhou University of Chinese Medicine, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10572-2010125470.htm |
| [3] |
滕婧, 梁敬钰, 陈莉. 鸡血藤的研究进展[J]. 海峡药学, 2015, 27(3): 1. TENG J, LIANG JY, CHEN L. Advances in studies of Spatholobus-suberectusDunn[J]. Strait Pharm J, 2015, 27(3): 1. |
| [4] |
CHENG XL, WAN JY, LI P, et al. Ultrasonic/microwave assisted extraction and diagnostic ion filtering by liquid chromatog raphy quadrupole time of flight mass spectrometry for rapid characterization of flavonoid in Spatholobussuberectus[J]. J Chromatogr A, 2011, 28(2): 5777. |
| [5] |
符影, 程悦, 陈建萍, 等. 鸡血藤化学成分及药理作用研究的进展[J]. 中草药, 2011, 42(6): 1229. FU Y, CHENG Y, CHEN JP, et al. Advances in studies on chemical constituents in Spatholobi Caulis and their pharmacological activities[J]. Chin Tradit Herb Drugs, 2011, 42(6): 1229. |
| [6] |
BURGESS AW, METCALFD, KOZKA IJ, et al. Purification of two forms of colony-stimulating factor form mouse L-cell-conditioned medium[J]. J Biol Chem, 1985, 260(29): 16004. |
| [7] |
NISHIO T, IWASAKI T, KOBAYAKAWA J, et al. Effect of "Ji-Xue-teng"(non-Roman script word:Spatholobussubrectus Dunn, Leguminosae)on platelet[J]. Chin J Nat Med, 2000, 54(5): 268. |
| [8] |
KANG IC, KIM SA, SONG GY, et al. Effects of the ethyl acetate fraction of Spatholobi Caulis on tumor cell aggregation and migration[J]. Phytother Res, 2003, 17(2): 163. DOI:10.1002/(ISSN)1099-1573 |
| [9] |
庞佶, 郭金鹏, 金敏, 等. 鸡血藤水提物抗流感病毒作用的研究[J]. 中国卫生检验杂志, 2015, 25(4): 489. PANG J, GUO JP, JIN M, et al. Anti-influenza virus effects of aqueous extract from Spatholobussuberectus[J]. Chin J Health Lab Technol, 2015, 25(4): 489. |
| [10] |
刘仰斌, 张志华. 鸡血藤总黄酮对大鼠佐剂关节炎作用的实验研究[J]. 医学研究与教育, 2014, 31(5): 3. LIU YB, ZHANG ZH. Experimental study of net cliffbean total flavonoids on adjuvant arthritis in rats[J]. Med Res Educ, 2014, 31(5): 3. |
| [11] |
LEE MH, LIN YP, HSU FL, et al. Bioactive constituents of Spatholobussuberectus in regulating tyrosinase related proteins and mRNA in HEMn cells[J]. Phytochem Lett, 2006, 67(12): 1262. DOI:10.1016/j.phytochem.2006.05.008 |
| [12] |
黄灿辉. HPLC法测定不同产地鸡血藤中原儿茶酸的含量[J]. 中医药导报, 2009, 15(3): 84. HUANG CH. Determination of dihydroxybenzoic acid in Suberect Spatholobus of different places of production with HPLC method[J]. Guiding J TCM, 2009, 15(3): 84. |
| [13] |
边宝林, 王宏洁, 司南. 鸡血藤药材中表儿茶素的含量测定[J]. 中国实验方剂学杂志, 2004, 10(6): 31. BIAN BL, WANG HJ, SI N. Determination of L-epicatechin in Spatholobi Caulis[J]. Chin J Exp Tradit Med Form, 2004, 10(6): 31. |
| [14] |
仰铁锤, 林振坤, 丁平, 等. 鸡血藤药材质量评价研究[J]. 中国药学杂志, 2009, 44(23): 1766. YANG TC, LIN ZK, DING P, et al. Studies on systematical quality evaluation of Spatholobi Caulis[J]. Chin Pharm J, 2009, 44(23): 1766. |
| [15] |
陆蕴茹. 中药化学[M]. 北京: 学苑出版社, 1997, 135. LU YR. Chemistry of Chinese Medicine[M]. Beijing: Xueyuan Press, 1997, 135. |
| [16] |
中国药典2015年版. 四部[S]. 2015: 9101 ChP 2015.VolⅣ[S].2015:9101 |
 2017, Vol. 37
2017, Vol. 37 
