2. 北京昭衍新药研究中心股份有限公司, 北京 102600
2. JOINN Laboratories, Beijing 102600, China
在样品分析过程中, 样品前处理起着非常重要的作用。据统计, 人们常常将60%的时间花在样品前处理上, 且在前处理过程中萃取液的转移、稀释、混合等步骤也是实验误差的主要来源;因此, 样品前处理在整个分析过程中举足轻重。这不仅涉及工作效率的问题, 同时也关系到分析结果的可靠性。
为了获取准确、可靠的数据, 使实验能够顺利进行, 建立一个易操作、低成本、高效率的样品前处理步骤对于整个分析过程至关重要。
电膜微萃取(electromembrane microextraction, EME)是Pedersen-Bjergaard等[1]在2006年提出的新颖的前处理技术, 它以电场力作为主要驱动力, 最早应用于不需要沉淀蛋白就可以萃取的血浆或是其他复杂的生物基质待测物, 萃取过程中, 离子化被测物从供体相通过中空纤维孔壁的有机液膜萃取进入有机相, 由于中空纤维的孔壁阻碍了生物大分子、亲水性化合物等杂质进入到有机相内, 因此该方法起到了很好的富集与纯化作用。示意图[2]见图 1。
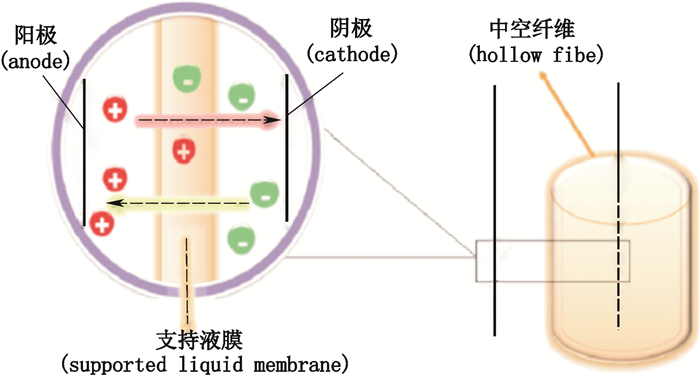
|
图 1 中空纤维电膜微萃取原理图 Figure 1 Schematic illustration of HF-EME |
EME法快速、灵活, 样品净化能力突出, 与液液萃取、固相萃取等相比, 不仅简单、经济、环保, 避免了大量溶剂的使用, 而且本方法以电场驱动力代替被动扩散, 成为萃取主要动力的一种电萃取模式, 无论对于环境等基质还是复杂的生物基质都有广泛应用。本文对近几年内EME及其改进技术进行了综述, 还对其在分析领域中的应用前景进行了总结与预测。
1 以中空纤维为支持液膜(SLM)的EME技术以中空纤维为支持液膜(support liquid membrane, SLM)的中空纤维EME(hollow fiber membrane micro-extraction, HF-EME)技术是在中空纤维液相微萃取的基础上, 应用电场力驱动离子被测物, 通过SLM进入接收相的过程。这种技术应用电势差作为强驱动力, 与传统的中空纤维液相微萃取(HF-LPME)技术相比, 显著提高了萃取效率。HF-EME方法将电压加在液膜两侧, 促进了被测离子的迁移, 萃取时间显著缩短, EME装置如图 2所示。
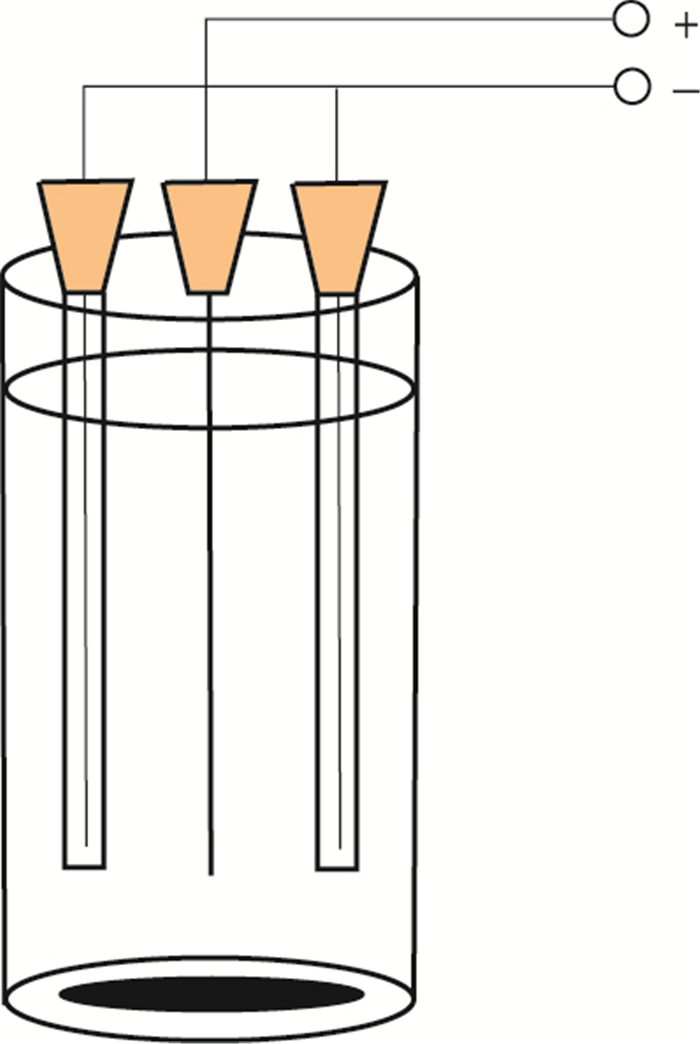
|
图 2 HF-EME装置图 Figure 2 Installation illustration of HF-EME |
Chanthasakda等[3]采用HF-EME前处理手段对饮用水中的金属含氧阴离子进行了研究;铬由于其环境毒性, 在本实验中作为模型被测物。实验过程中, 作者对影响待测物萃取效率的因素等参数进行了考察。研究发现, SLM的性质是影响待测物跨膜进入接收相的重要因素, 例如中空纤维壁上的溶剂, 应利于待测物的转移同时也应具有较低的电流, 以防止在实验过程中由于电解的作用在电极两侧产生气泡而降低萃取效率。基于前期研究, 作者选择正庚醇作为有机溶剂, 同时, 在SLM中加入离子对试剂季铵氯化物336作为离子载体, 因此, 在接收相中阴离子与季铵氯化物336形成离子对, 在电场力作用下, 通过SLM进入接收相。这种方法显著地提高了萃取效率。
Chanthasakda等[3]还对季铵氯化物336的浓度进行了考察。由于季铵氯化物336相对粘稠, 当其浓度增加, 它的粘稠度同时增加, 离子待测物的转运受到了影响;当它的浓度降低, SLM的电阻也降低。实验时, 电极两侧由于电解作用产生气泡造成萃取效率降低。最终选择5%的季铵氯化物336加在有机溶剂中作为SLM, 待测物萃取效率增加了100倍, 灵敏度达到1.0 ng·mL-1。
HF-EME作为环保、新型、简单的样品前处理方法, 不仅可以应用于碱性化合物、重金属离子、多肽类化合物[4]与无机阴离子[5], 还可用于测定水中的酸性药物[6]。
然而, HF-EME方法的局限性在于电极两侧电压过大时, 电解反应发生, 离子载体季铵氯化物336的加入促进了待测物离子的转运;当样品基质中离子浓度较大时, 电解反应产生的几率也越大。本方法较适用于含有低离子浓度的样本, 例如水基质等, 因此本方法对于简单基质中化合物的测定具有很好的应用前景。
2 脉冲EME前处理技术在普通的EME方法中, 在直流电源的作用下, 由于电阻与双电层的存在, 一旦增加电压, 将造成整个萃取系统不稳定。脉冲EME(pulsed electromembrane microextraction, PEME)技术是利用直流电源产生脉冲电压获得驱动力, 与普通的EME方法相比, PEME方法是通过降低SLM两侧双电层的厚度提高萃取装置的稳定性, 进而提高方法的萃取回收率。在EME方法中, 萃取电压与萃取时间是提高萃取效率的重要因素;电压增加, 萃取时间减少, 纯化效率提高。Rezazadeh等[7]建立了PEME前处理方法, 由于PMEM系统的稳定性, 他应用加有10%二-(2-乙基己基)磷酸酯(DEHP)的2-硝基苯基辛基醚(NPOE)溶剂作为SLM, 在350 V的高电压下仅用2 min就可从尿样和血浆中检测到10 ng·mL-1的浓度水平。为了防止实验过程中双电层产生, 选择2 s作为脉冲持续时间, 且全程未见气泡产生。实验结果表明, PEME方法即使在高的萃取电压下也是非常稳定的, 非常适合于萃取复杂基质中的待测物。
在前期研究的基础上, Arjomandi-Behzad等[8]开发出具有2个阴极, 1个阳极的新型的PEME装置, 用于测定水样、尿样和血浆中的阿替洛尔(ATE)和倍他洛尔(BET)。由于这2种化合物具有不同的性质, 为了能够同时萃取它们且保证萃取过程中的系统稳定性, 作者应用2种SLM, 萃取BET和ATE的有机溶剂分别为2-硝基苯基辛基醚(NPOE)和混有10%DEHP的NPOE有机溶剂。最终该研究应用的萃取电压为100 V, 富集倍数在69~363之间。
虽然研究者们建立了同时萃取不同极性的待测物的PEME前处理方法, 并最终获得了满意的结果, 但是对于不同性质的待测物(酸性物质、碱性物质)仍存在局限。为了解决这一难题, Koruni等[9]于2014年建立了能够同时高效萃取很大极性范围的一系列酸性和碱性化合物的新颖的EME装置;本方法另外增加2个辅助电极, 共使用了4个电极, 当萃取酸性化合物时, 萃取溶剂分别为正辛醇和含有4%十六烷基三甲基溴化铵(CTAB)的正辛醇溶剂, 当萃取碱性化合物时, 萃取溶剂分别为NPOE和NPOE+10% DEHP+10%三-(2-乙基己基)磷酸酯(TEHP)。Koruni等[9]同时对影响萃取效率的电压、时间、pH等做了详细的考察, 几种待测的富集倍数达到66~132之间。
研究者建立的在单一EME前处理装置中同时萃取不同极性不同性质的化合物的方法, 是样品前处理领域的一项重大突破, 具有很好的应用前景。
3 以离子液体为SLM的EME前处理技术萃取电压在EME前处理方法中必不可少, 然而电压升高, 造成SLM不稳定, 中空纤维孔壁上的有机溶剂丢失, 萃取效率下降, 因此, 寻找合适的SLM至关重要。离子液体(IL)由于具有明显的物理和化学优势, 例如高粘度、低蒸汽压与低毒性, 可调节极性和对于有机和无机化合物的高萃取性, 在药物分析领域被广泛应用。基于以上优点, Sun[10]建立了离子液体为SLM的EME(IL-EME)的新颖的微萃取方法, 将IL固定在中空纤维孔壁作为SLM, 电场力作为驱动力促进被测物的转移, 最终与传统的EME方法(以NPOE、DEHP、CTAB等为萃取溶剂的EME技术)进行了比较。结果表明, IL-EME方法应用更小的电压, 获得了更高的萃取效率, 解决了传统EME方法应用, 高的萃取电压造成溶剂丢失的不足。这种方法为生物样本中生物碱的测定提供了很好的选择。
4 以非离子型表面活性剂为SLM的EME前处理技术表面活性剂分子具有明显的两亲性质, 在水相与有机相中均可溶解, 由于其特殊的优势, 表面活性剂在样品前处理领域越来越受到关注。在EME方法中, 作者将非离子表面活性剂加入到供体相中, 由于SLM有机溶剂的体积少于样品瓶中有机溶剂的体积, 表面活性剂其疏水端进入SLM形成反向胶束, 当达到临近胶束浓度时, 被测物很容易通过这些胶束快速地从供体相转入到SLM, 然后在电压的作用下, 胶束释放被测物进入接收相[11], 以非离子型表面活性剂为辅助的EME方法是近年来建立的一种新模式。实验结果表明, 本方法非常适合检测生物样品中痕量的碱性药物。该方法测定范围广且重现性好, 为碱性药物的测定又提供了一种新颖的前处理SLM方法。
5 以游离液膜作为支撑体的μ-EME前处理技术在EME方法中, SLM对于被测物的测定至关重要, 它不仅对基质中的杂质大分子起到隔绝作用, 而且其膜厚度也直接影响待测物的萃取效率[12]。
| $ {J_{\rm{i}}} = \frac{{- {D_{\rm{i}}}}}{h}\left( {1 + \frac{\upsilon }{{\ln \chi }}} \right)\left( {\frac{{\chi- 1}}{{\chi- \exp \left( { - \upsilon } \right)}}} \right)\left[{{C_{{\rm{ih}}}}-{C_{{\rm{io}}}}{\rm{epx}}\left( {-\upsilon } \right)} \right] $ |
Di、h、χ分别为被测物的扩散常数、中空纤维膜壁厚和供体相与接收相离子浓度比率, Cih表示在SLM与供体相待测物的浓度, Cio表示在SLM与接受相待测物的浓度, υ表示驱动力, 因此SLM的规模也是被测物萃取的关键因素。
Kubáň等[13]则对常用的EME装置进行了改良, 采用可以准确定量、厚度精准的游离液膜作为SLM, 而且能够全程监测萃取过程, 接收相、供体相与游离液膜的体积也可轻松调节, 最终萃取时间仅用5 min, 萃取电压为100 V。该研究建立的萃取系统稳定, 仅需要μL或低于μL级的有机溶剂和样品溶液, 高效、环保。因此Kubáň等所建立游离液膜作为支撑体的μ-EME的微萃取方法, 具有仪器简单, 用时较短, 有机溶剂用量少, 样品溶液用量低等优势, 但由于供体相与接收相体积较小, 未来研究者们需要进一步考察。
6 以聚丙烯薄片放在管内作为支持体的EME前处理技术SLM的厚度是影响待测物跨膜转运的重要因素。研究表明, 液膜的厚度增加, 被测物通过SLM的流量降低, 被测物在SLM的摩尔比率减少。传统的EME(HF-EME)装置的支撑体大都是由多孔内嵌支撑材料构成, 常用纤维材料内径大约为600 μm, 壁厚为200 μm, 孔径为0.2 μm, 需要大约25 μL的有机溶剂。且实验的前期准备:中空纤维膜的浸润与封口以及有机溶剂的去除等步骤烦琐耗时。Bazregar等[14]建立了一个简单、高效、环境友好的新颖的管内EME(IEME)方法, 将一个薄的聚丙烯薄片放在管内作为膜溶剂的支持体, 一次性的聚丙烯薄片消除了普通的EME方法残留的难题, 实验结果准确、可靠。对真实样品萃取结束后, 萃取液进行HPLC-UV分析, 萃取回收率在91%~108%之间。Bazregar等所建立的IEME方法简单、方便、环保, 是一个高度自动化的前处理方法。
7 扩大接受相体积的EME前处理技术EME方法高效、快速, 富集倍数高, 在生物分析领域广受关注。然而, 目前EME方法的回收率平均在50%~80%之间, 对待测物完全萃取还未见报道。在前期研究的基础上, Eibak等[15]建立了应用3根中空纤维作为接受相对被测物进行完全萃取的EME方法。作者将阴极加入到3根中空纤维内腔中, 一旦萃取开始, 离子待测物源源不断地转移至中空纤维内腔中, 萃取完成后, 合并接收相溶液进样分析, 最终对血浆样品中的6种化合物达到了完全的萃取, 萃取回收率在97%~115%。唯一的不足的是, 此方法采用3根中空纤维, SLM操作更加复杂, 因此, 开发出更加新颖、简单的EME法势在必行。
基于以上研究, Huang等[16]建立了应用多孔的平膜的EME装置, 其壁厚为100 μm, 接收相溶液的体积增加到600 μL, 更是将装置设置为L型, 使萃取装置更加简单。这个新的EME装置提供了更大的接受相体积及更高的萃取回收率, 同样达到了萃取完全的目的。
Mamat等[17]应用聚合物内含膜(HPIM)作为SLM。聚合物内嵌膜是一种均匀的通过一定比例的醋酸纤维素(CTA)、TEHP及2-(2-乙基己基)磷酸(D2EHPA)混合而成增塑的聚合物膜, 它被认为是非常适合于萃取亲水性有机离子。该膜厚度仅为20 μm, 作者应用中空聚合物内嵌膜作为SLM来萃取血浆中的药物, 并将它与普通的EME方法进行了比较, 本技术提供了更高的萃取回收率, 重现性好, 操作简单, 实验设备低廉, 非常适合于检测带电物质;在优化的萃取条件下, 本方法的富集倍数为93~103倍, 供体相的体积为3 mL, 未来的发展趋势是通过增加供体相与接收相的体积比率, 进一步的扩大富集倍数。
8 EME结合低密度溶剂的超声辅助的乳化微萃取技术将EME与其他前处理方法的联合应用, 是对EME方法的进一步发展。Guo[18]将EME方法同超声辅助的乳化微萃取前处理方法结合起来用于测定水环境中的氯酚。首先, 待测物通过EME方法从样品相转移至接收相, 然后被萃取的化合物在超声波的辅助下分散在供体相中的低密度溶剂中。用最终萃取液进样分析, 6种待测物的富集倍数最高达到2 198倍。作者利用了EME方法净化、高效的浓缩优势, 消除了应用单一的萃取前处理技术的不足, 且该研究是以正辛醇作为SLM, 萃取时间仅为10 min, 证明此2种前处理技术的结合, 简单、快速、低廉、萃取效率高, 非常适用于环境水样品中的待测物浓度的测定。
9 电强化的固相微萃取的复合前处理技术电强化的固相微萃取的复合方法是将驱动力加在固相微萃取(SPME)纤维上, 加速离子被测物的迁移, 提高了待测物的萃取速度。Xu等[19]以不锈钢的SPME针头套管作为阴极, 萃取时间为10 min, 实验结束后, 针头吸取液体进行GC分析。本方法的检测限在0.079~0.296 μg·mL-1之间, 表明该法适合于分离、富集、纯化水样品中离子化合物。与普通的EME方法相比, 检测限更低, 且避免了SLM的选择难题, 前处理方法更加快速、简单。在样品前处理领域, 将2种不同的方法有效地结合是一种具有创新性的发展趋势。Tabani[20]建立了将固相萃取(SPE)方法与EME方法结合用于检测环境水样中的氯酚类化合物, 这2种技术具有单一方法的所有优势, 包括更优的样品净化能力, 更高的富集倍数, 较低的检测限, 同时也证明了SPE-EME方法在未来的前处理领域具有较好的应用前景。
10 EME结合分散液液微萃取的复合前处理技术EME方法简单、快速, 可应用于不同基质的众多样本, 但萃取液大都以离子形式存在, 不能直接进行GC等仪器分析, 为解决这一难题。Seidi等[21]尝试结合EME与分散液液微萃取方法, 充分利用它们的优势, 用于分析生物基质中的三环类化合物。这种方法避开了EME方法的局限性, 且由于接收相的体积低于3 μL, 提高了方法的灵敏度。该方法解决了检测技术不兼容的难题, 2种前处理方法优势互补, 富集倍数最高可达1 065倍。
总之, 这种复合技术为生物样品中待测物的测定提供了快速、简单、灵敏的新手段, 也为样品分析中EME与新型的其他前处理方法的有效联合提供了新思路。
11 结论EME前处理方法是在液相微萃取方法上发展起来的新型前处理方法, 它与传统的方法相比(液液萃取、固相萃取), 优势显著, 例如快速、简单、突出的净化能力。目前, 这种方法在药物分析领域中得到广泛的应用, 尤其对于生物样品来说, 基质复杂, 其中不仅含有脂肪、蛋白质, 还具有无机盐、葡萄糖、激素等小分子, 前处理方法相对烦琐, 然而EME方法可破坏药物与血浆之间的结合力, 未稀释的血浆可直接用于测定, 避免了烦琐的前处理步骤, 而且无论是环境样品还是金属离子, 无机阴离子都可达到萃取的目的。同时, 研究学者们推陈出新, 不断探索, 在普通的EME基础上不断改造, 例如增加接受相体积, 降低SLM的厚度, 开发新型的SLM, 通过影响待测物的传质效率, 使待测物的回收率接近100%, 为了使待测物更加快速地被萃取, 科学家们大胆采用新型SLM溶剂, 例如表面活性剂、离子液体等, 萃取效率显著提高, 这些都丰富了生物样本分析的手段。
然而, 在较高的萃取电压下, 可能会造成SLM不稳定, 影响待测物的传质, 进而降低萃取效率。因此, 为克服EME前处理方法的不足, 未来的趋势是:寻找新型、稳定的SLM溶剂, 实现样品分析的超高灵敏化及完全自动化, 新型前处理技术刻不容缓。其次, 为了防止在萃取过程中SLM两侧双电层的产生, 建立脉冲电压进行萃取必不可少。总之, 未来的样品分析进程中, 以电场力作为驱动力的简单、快速、环保的前处理方法在前处理技术领域中具有良好的发展前景。
| [1] |
PEDERSEN BS, RASMUSSEN KE. Electrokinetic migration across artificial liquid membranes:new concept for rapid sample preparation of biological fluids[J]. J Chromatogr A, 2006, 1109(2): 183. DOI:10.1016/j.chroma.2006.01.025 |
| [2] |
SHAHRAM S, YADOLLAH Y, MARYAM R. Electrically enhanced microextraction for highly selective transport of three-blocker drugs[J]. J Pharm Biomed Anal, 2011, 56(5): 859. DOI:10.1016/j.jpba.2011.07.029 |
| [3] |
CHANTHASAKDA N, NITIYANONTAKIT S, VARANUSUPAKUL P. Electro-enhanced hollow fiber membrane liquid phase microextraction of Cr(Ⅵ) oxoanions in drinking water samples[J]. Talanta, 2016, 148: 680. DOI:10.1016/j.talanta.2015.04.080 |
| [4] |
HUANG C, EIBAK LE, GJELSTAD A, et al. Development of a flat membrane based device for electromembrane extraction:A new approach for exhaustive extraction of basic drugs from human plasma[J]. J Chromatogr A, 2014, 1326(1): 7. |
| [5] |
HUANG C, GJELSTAD A, PEDERSEN-BJERGAARD S. Exhaustive extraction of peptides by electromembrane extraction[J]. Anal Chim Acta, 2015, 853: 328. DOI:10.1016/j.aca.2014.10.017 |
| [6] |
BALCHEN M, GJELSTAD A, RASMUSSEN KE, et al. Electrokinetic migration of acidic drugs across a supported liquid membrane[J]. J Chromatogr A, 2007, 1152(1-2): 220. DOI:10.1016/j.chroma.2006.10.096 |
| [7] |
REZAZADEH M, YAMINI Y, SEIDI S, et al. Pulsed electromembrane extraction:A new concept of electrically enhanced extraction[J]. J Chromatogr A, 2012, 1262(21): 214. |
| [8] |
ARJOMANDI-BEHZAD L, YAMINI Y, REZAZADEH M. Pulsed electromembrane method for simultaneous extraction of drugs with different properties[J]. Anal Biochem, 2013, 438(2): 136. DOI:10.1016/j.ab.2013.03.027 |
| [9] |
KORUNI MH, TABANI H, GHARARI H, et al. An all-in-one electro-membrane extraction:Development of an electro-membrane extraction method for the simultaneous extraction of acidic and basic drugs with a wide range of polarities[J]. J Chromatogr A, 2014, 1361: 95. DOI:10.1016/j.chroma.2014.07.075 |
| [10] |
SUN JN, CHEN J, SHI YP. Ionic liquid-based electromembrane extraction and its comparison with traditional organic solvent based electromembrane extraction for the determination of strychnine and brucine in human urine[J]. J Chromatogr A, 2014, 1352: 1. DOI:10.1016/j.chroma.2014.05.037 |
| [11] |
HASHEMINASAB KS, FAKHARI AR. Application of nonionic surfactant as a new method for the enhancement of electromembrane extraction performance for determination of basic drugs in biological samples[J]. J Chromatogr A, 2015, 1378: 1. DOI:10.1016/j.chroma.2014.11.061 |
| [12] |
TABANI H, FAKHAR AR, SHAHSAVANI A, et al. Combination of graphene oxide-based solid phase extraction and electro membrane extraction for the preconcentration of chlorophenoxy acid herbicides in environmental samples[J]. J Chromatogr A, 2013, 1300: 227. DOI:10.1016/j.chroma.2013.04.026 |
| [13] |
KUBAN P, BOCEK P. Micro-electromembrane extraction across free liquid membranes.Instrumentation and basic principles[J]. J Chromatogr A, 2014, 1346: 25. DOI:10.1016/j.chroma.2014.04.047 |
| [14] |
BAZREGAR M, RAJABI M, YAMINI Y, et al. N-Tube electro-membrane extraction with a sub-microliter organic solvent consumption as an efficient technique for synthetic food dyes determination in foodstuff samples[J]. J Chromatogr A, 2015, 1410: 35. DOI:10.1016/j.chroma.2015.07.084 |
| [15] |
EIBAK LE, GJELSTAD A, RASMUSSEN KE, et al. Exhaustive electromembrane extraction of some basic drugs from human plasma followed by liquid chromatography-mass spectrometry[J]. J Pharm Biomed Anal, 2012, 57: 33. DOI:10.1016/j.jpba.2011.08.026 |
| [16] |
HUANG C, EIBAK LE, GJELSTAD A, et al. Development of a flat membrane based device for electromembrane extraction:A new approach for exhaustive extraction of basic drugs from human plasma[J]. J Chromatogr A, 2014, 1326: 7. DOI:10.1016/j.chroma.2013.12.028 |
| [17] |
MAMAT NA, SEE HH. Development and evaluation of electromembrane extraction across a hollow polymer inclusion membrane[J]. J Chromatogr A, 2015, 1406: 34. DOI:10.1016/j.chroma.2015.06.020 |
| [18] |
GUO L, LEE HK. Electro membrane extraction followed by low-density solvent based ultrasound-assisted emulsification microextraction combined with derivatization for determining chlorophenols and analysis by gas chromatography-mass spectrometry[J]. J Chromatogr A, 2012, 1243: 14. DOI:10.1016/j.chroma.2012.04.054 |
| [19] |
XU R, LEE HK. Application of electro-enhanced solid phase microextraction combined with gas chromatography-mass spectrometry for the determination of tricyclic antidepressants in environmental water samples[J]. J Chromatogr A, 2014, 1350: 15. DOI:10.1016/j.chroma.2014.05.024 |
| [20] |
TABANI H, FAKHARI AR, SHAHSAVANI A, et al. Combination of graphene oxide-based solid phase extraction and electromembrane extraction for the preconcentration of chlorophenoxy acid herbicides in environmental samples[J]. J Chromatogr A, 2013, 1300: 227. DOI:10.1016/j.chroma.2013.04.026 |
| [21] |
SEIDI S, YAMINI Y, REZAZADEH M. Combination of electromembrane extraction with dispersive liquid-liquid microextraction followed by gas chromatographic analysis as a fast and sensitive technique for the determination of tricyclic antidepressants[J]. J Chromatogr B, 2013, 913-914: 138. DOI:10.1016/j.jchromb.2012.12.008 |
 2017, Vol. 37
2017, Vol. 37 