电感耦合等离子体质谱(inductively coupled plasma mass spectrometry, ICP-MS)是20世纪80年代发展起来的一种分析测试技术, 它是以独特的接口技术将电感耦合等离子体的高温(8 000 K)电离特性与四极杆质谱仪的灵敏快速扫描的优点结合而成的一种新型的元素和同位素分析技术, 可同时分析元素周期表上除C、H、O以外几乎所有的元素。近年来, ICP-MS技术的应用已从最初的地质科学研究迅速拓展到医药卫生、食品科学、生物科技、卫生防疫、环境分析、冶金工业、石油和核材料分析等领域。由表 1可知, 与传统无机分析技术如火焰原子吸收光谱法(F-AAS)、石墨炉原子吸收分光光度法(GF-AAS)、电感耦合等离子体原子发射光谱法(ICP-AES)等相比, ICP-MS技术灵敏度更高, 样品干扰更小, 分析速度更快, 线性范围更宽, 精密度更高并能提供精确的同位素信息[1]。ICP-MS不仅可以根据谱线的荷质比进行定性分析, 还可以进行半定量和定量分析, 同位素比测定更是其他元素分析技术所不具备的。本文就ICP-MS在药物分析中的应用做一简单概述。
|
|
表 1 ICP-MS与F-AAS、GF-AAS、ICP-AES的性能比较 Table 1 Performance comparison of ICP-MS, F-AAS, GF-AAS and ICP-AES |
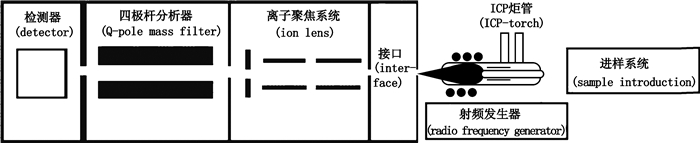
ICP-MS的构造和分析流程如图 1所示。
|
图 1 ICP-MS构造图 Figure 1 The structure of ICP-MS |
微量元素特别是一些必需的微量金属离子, 在许多生物大分子如核酸、蛋白质、酶、激素、维生素结构中具有特异的生理功能, 对人体健康和生命活动起着至关重要的作用, 过量摄入或不足都会不同程度引起人体生理的异常。张伟等[2]建立了人血白蛋白中Cr、Mn、Fe、Co、Ni等14种元素的ICP-MS测定方法。作者用国家标准物质头发成分GBW07601(GSH-1)对方法进行验证, 实验结果表明各微量元素测定值均在标准值的范围内。
作为中药药性物质基础的重要组成部分, 微量元素对中药药性药理和功效的阐明具有不可或缺的作用。ICP-MS技术高灵敏度、较宽的动态线性范围等优点很好地解决了中药的成分复杂、微量元素含量低以及干扰因素多等困难。刘潇潇等[3]应用ICP-MS建立了同时测定清开灵系列制剂(注射液、软胶囊、胶囊、颗粒)中Li、Be、B、V、Cr等17种元素的方法。参照中国药典2010年版第二增补本, 所测95批样品中重金属及有害元素Pb、Cd、As、Hg、Cu的含量基本在合格范围内。
由于土壤养分的不同, 使得中药材对无机元素的吸收不同, 从而促使植物摄取和富集不同元素的生物特性, 最终形成具有生物活性物质的地道中药材。另外, 根据中药材用药部位、采收期和生长期的不同, 会造成所含有的微量元素及药效的差异。老骄阳等[4]采用ICP-MS对5个不同产地的茯苓与猪苓中的Be、Na、Mg、Al等25种元素进行全定量分析, 并对所得到的数据进行统计学分析。实验结果显示, 茯苓与猪苓中各无机元素的含量随原子序数增大呈现相似的规律性分布, 主产地的茯苓与猪苓中无机元素含量高于其他产地。2种药材间无机元素的含量差异大。该研究从元素角度为药材种属亲缘关系的鉴定及药材的资源品质与地域性的相关性提供了参考。中药透骨草为豆科植物山野豌豆、广布野豌豆、假香野豌豆、毛山野豌豆或狭山野豌豆的干燥地上部分。常安等[5]应用ICP-MS对不同来源的18批次透骨草中Be、Na、Mg、Al、K等25种元素的含量进行了测定, 并对测得数据进行了统计学分析。实验结果显示不同来源、不同产地透骨草透骨草无机元素含量有较大差异, K、Ca、Mg、Al、Fe 5种元素含量最高;Be、Na、Al、Cr、Mn、Fe、Co、Zn、As、Ba、Tl、U为透骨草的特征无机元素。
罗益远等[6-7]用ICP-MS对何首乌生品及其炮制品中Al、Mn、Fe、Cu等24种无机元素的含量进行了测定, 对所得数据进行统计分析后发现, 何首乌药材中K、Fe、Mg、Ca、P元素含量较高, Fe、Si、Ca、Al、K、Be、Sb、Mn、Zn、Ba是何首乌的特征无机元素;炮制前后何首乌无机元素差异明显, 其中铝(Al)、铁(Fe)、钾(K)、镁(Mg)、锰(Mn)、锌(Zn)元素的含量在炮制后增加, 而As、Pb、Cd元素的含量在炮制后显著下降。经分析, Al、Fe、K、Mg、Mn、Zn元素含量的升高可能与制何首乌补益功效增强有关, 而As、Pb、Cd元素含量的下降可能是何首乌炮制减毒的原因之一。
2.2 有害重金属元素分析重金属易在人体内蓄积, 与人体组织酶蛋白结合, 超标时会严重影响人体机能, 引发健康问题, 因此, 重金属含量测定成为中药质量评价不可或缺的内容。2001年, 我国开始实施《药用植物及制剂进出口绿色行业标准》, 对有害重金属元素作了相应的限量规定, 如Cu限量≤20 mg·kg-1, As限量≤2.0 mg·kg-1, Hg限量≤2.0 mg·kg-1, Pb限量≤5.0 mg·kg-1, Cd限量≤0.3 mg·kg-1。中国药典2005年版一部也首次将ICP-MS作为中药材中Cu、As、Hg、Pb、Cd等重金属和有害元素的测定法。
岳媛等[8]使用ICP-MS测定了8个川明参主要种植县区采集的33份川明参根中重金属元素含量, 并根据地理位置和生态环境, 将这8个川明参种植县区分为4个产区, 经统计分析比较各产区样品中重金属元素的差异。实验结果显示, 每份川明参样品中各重金属元素含量的最大值分别为Pb 0.256 μg·kg-1, Cd 0.235 μg·kg-1, Hg 0.123 μg·kg-1, Cu 3.963 μg·kg-1, Cr 2.145 μg·kg-1, As未检出, 均低于《药用植物及制剂进出口行业绿色标准》药用植物原料和饮片的标准。说明四川产川明参是安全的, 而且主产区适宜川明参的种植。
陈佳等[9]对ICP-MS测定中药马钱子中Pb、Cd、As、Hg含量的不确定度进行了评定。实验结果显示用ICP-MS法测定Pb、Cd、As、Hg的扩展不确定度分别为0.15 mg·kg-1, 0.039 mg·kg-1, 0.17 mg·kg-1, 0.029 mg·kg-1。杨雪梅等[10]应用ICP-MS测定了中药材预知子及其提取物中重金属元素的含量。实验结果显示, 预知子药材及其提取物中As、Pb、Hg、Cd、Cu的含量均低于药典标准, 其提取物中的Hg、Pb、Cd含量有少许下降, As、Cu基本不变, 说明提取过程不会增加重金属含量, 只要控制好药材的质量, 即可保证提取物中的重金属含量符合标准。
中药饮片多以煎煮所得汤液服用, 且静置冷却后往往有沉淀形成并被患者弃去, 醋制一定程度上会改变饮片的特性, 改变重金属转移至汤液的量。甘彦熊等[11]对蓬莪术醋制前后重金属在煎液及其沉淀中转移率的变化进行了研究, 通过测定6批次蓬莪术生品及其醋制品的饮片、煎液、沉淀中5种重金属的含量, 换算得到重金属由饮片经过煎煮转移到煎液及沉淀中的百分率。实验结果显示, 醋制后Pb和Hg总转移率显著降低, Cd和Cu总转移率略降低, As总转移率略增高, 而沉淀中重金属均有所降低, 表明醋制对各重金属的转移率有不同程度的影响, 继而说明醋制会对蓬莪术起到一定的增效减毒作用。
中药配方颗粒是指在传统中药饮片的基础上, 通过水提、浓缩和干燥之后得到的颗粒状剂型, 具有无需建筑、服用方便的优点。胡麟等[12]采用ICP-MS对丹参、金银花、黄芪3种饮片的配方颗粒重金属转移率进行了研究。实验结果显示, 3种饮片中5种重金属的含量均符合2015年版中国药典的规定, 向配方颗粒的重金属转移率在0%~26.8%之间, 其中Pb的转移率为0%, 说明一些中药饮片的配方颗粒在制备过程中能够降低重金属的含量, 保证用药的安全性。
2.3 元素形态分析微量元素对药物机理功效的阐释不仅与其总量有关, 更与其存在的形态有关。元素不同形态有不同的化学和生物学行为。周天泽[13]将水煎液中微量元素的形态分析分为2个层次:初级形态分析和次级形态分析。初级形态分析主要是研究原生药中微量元素的种类及含量, 考察水煎液中微量元素的浸出情况;次级形态分析是在确定有关微量元素种类的基础上, 进一步考察其发挥作用的形式, 如胶体态和可溶态、有机态与无机态、稳定态与不稳定态等。
2.3.1 元素初级形态分析刘威等[14]采用煎煮法对茯苓中Fe、Mg、Cu、Zn、Al等24种微量元素进行提取, 水煎液经0.45 μm的微孔滤膜过滤后分为悬浮态和可溶态, 对可溶态中的有机态和无机态采用LSA-10大孔树脂进行分离, 以正辛醇-水分配体系, 在模拟人体胃(pH=1.3)和肠(pH=7.6)环境条件下, 用萃取法将水煎液微量元素分离为醇溶态和水溶态, 采用ICP-MS对各种形态的微量元素进行含量测定。实验结果显示各微量元素的溶出率在18.5%~95.5%之间, 可溶态在水中的比例为33.6%~99.9%, 说明茯苓水煎液中微量元素主要以无机态和水溶态的形式存在。
李铮等[15]采用ICP-MS对14个厂家30批朱砂安神丸在人工胃液中可溶性汞的含量进行了测定。作者采用人工胃液保温浸提及超声提取法制备供试品溶液, 按日服最大量0.5 g朱砂计算, 可溶性汞的含有量为0.020~0.047 mg, 基本符合WHO 0.042 mg的限量标准规定。王辰洋等[16]应用ICP-MS对不同厂家牛黄消炎片和小儿化毒散中的砷总量、水中砷溶出率、人工胃液中砷溶出率及人工肠液中砷溶出率进行测定、比较和分析。实验结果显示, 部分厂家的牛黄消炎片和小儿化毒散存在雄黄投药不足的问题, 各厂家牛黄消炎片和小儿化毒散中砷元素在胃肠液中溶出率均小于5%。白国银等[17]模拟人工胃肠液消化牛黄解毒片、救急散、牛黄清火丸3种含雄黄中成药, 所得上清液经微波消解后利用ICP-MS测定其中重金属含量, 以估算可能被人体胃肠溶解吸收的金属含量。实验结果表明, 经人工胃肠液消化处理的可溶性重金属含量低于其重金属总量, 说明中成药中可被人体吸收并发挥生物学作用的重金属含量极低, 大部分不溶性有毒重金属元素均可能直接被排除体外, 更科学地评价了中成药中重金属元素的安全性。
炮制能改变中药药性、药效以及毒性, 是因其物质基础发生了变化。考察中药炮制前后无机元素的含量, 对于阐明其物质基础的变化具有重要的参考价值。金鹏飞等[18]应用ICP-MS技术对黄芪、大黄、黄芩、何首乌、地黄5种中药材炮制前后元素总量和水煎过程溶出特性的改变进行了比较和分析, 黄芪炮制后除Hg、Cu等个别元素外, 其他元素的溶出率都出现了上升;黄芩和地黄炮制后, 溶出率上升的元素数量多于溶出率下降的元素数量;大黄和何首乌炮制后, 溶出率增高和降低的元素数量基本相当。说明炮制以后, 元素溶出率总体上升。
2.3.2 次级形态分析砷元素在自然界中的存在形式有很多, 其毒性也根据形态不同而有所差别。无机砷有三价砷(As3+)和五价砷(As5+), 毒性很强;有机砷有单甲基砷酸(MMA)和二甲基砷酸(DMA), 有一定毒性, 但毒性远远小于无机砷;砷胆碱(AsC)、砷甜菜碱(AsB)以及各种类型的砷糖(AsS)和砷脂(AsL)几乎无毒[19]。因此, 要对砷的形态分析加以研究, 以综合评价砷毒性, 阐明砷作用的机理。
李丽敏等[20]采用高效液相色谱-电感耦合等离子质谱联用技术(HPLC-ICP-MS)建立了As3+、As5+、MMA、DMA、AsC和AsB 6种不同形态的砷的分析方法, 并对雄黄及七味新消丸、万灵片、牛黄醒消丸、牛黄抱龙片和牛黄消炎片5种含雄黄复方制剂中可溶性砷的形态进行研究。作者分别采用37 ℃人工胃液恒温振荡, 0.16%盐酸溶液超声, 甲醇-水(1:1)超声及甲醇-水(1:1)快速溶剂萃取等方法对样品中可溶性砷进行提取。发现雄黄及含雄黄复方制剂的酸可溶性砷总量仅占样品总含砷量的0.12%~2.70%;不同提取溶剂可溶性砷形态为As3+和As5+ 2种形态;酸可溶性砷中As3+和As5+之和与酸可溶性砷总量随中药复方制剂不同而呈现不同比例关系, 说明复方制剂中其他成分的存在可能会对可溶性砷中有毒形态溶出产生抑制作用。
金鹏飞等[21-22]应用ICP-MS建立了Mg、K、Ca、Na、Fe等20种元素的定量方法, 同时应用HPLC-ICP-MS建立As3+、As5+、MMA、DMA 4种砷形态的定量方法和AsB、AsC 2种砷形态的定性方法, 并考察牛黄解毒片水提取物、人工胃液提取物、人工肠液提取物中的无机元素和砷形态。实验结果显示, 水提物与人工胃肠液提取物中砷总量相当, 而人工胃肠液提取物中其他19种元素的含量高于水提物;各提取物中只检出As3+和As5+, 均未检出MMA、DMA、AsB和AsC, 说明牛黄解毒片在水和胃肠液中的溶出砷均以高毒性的无机砷为主。陈绍占等[23]采用HPLC-ICP-MS技术对雄黄染毒后大鼠肝肾中AsB、As3+、MMA、DMA和As5+等砷形态进行了研究, 发现经雄黄染毒后, 大鼠肝脏中的砷形态主要为DMA和As3+, 肾脏中的砷形态主要为DMA、MMA和As3+。
王英锋等[24]采用HPLC-ICP-MS对藏药仁青芒觉中可溶性砷的形态进行了研究。样品前处理选择微波萃取并比较了1%盐酸、1%硝酸、2%醋酸、50%甲醇4种溶剂的提取效率。实验结果显示, 仁青芒觉在不同提取液中砷的形态主要以As3+和As5+的形式存在, 且1%盐酸、1%硝酸的提取效率较高。As3+和As5+的检出限分别为0.39 ng·g-1和0.72 ng·g-1, 该研究为藏药中砷的毒理学研究提供了依据。金鹏飞等[25]利用HPLC-ICP-MS方法对黄芪、大黄、黄芩、何首乌、地黄5种中药炮制前后As3+、As5+、MMA、DMA 4种砷形态的变化进行了比较研究, 并对1个总砷超标的冬虫夏草样品进行了砷形态的分析, 测定结果显示, 中药中的砷以无机砷(As3+和As5+)为主;植物来源中药中都未检出MMA和DMA, 但冬虫夏草中检出了MMA。汪建君等[26]采用HPLC-ICP-MS对金银花、泽泻、鸡血藤中As3+、DMA、MMA、As5+ 4种砷形态的残留情况进行了测定。泽泻检出少量的As3+和As5+, 金银花检出少量As3+、DMA及As5+, 鸡血藤则均未检出As3+、DMA、MMA、As5+。
汞元素的不同形态间, 毒性相差非常大:一价汞(Hg+)和二价汞(Hg2+)属于无机汞, Hg+和Hg2+的典型化合物有氯化亚汞(HgCl)和氯化汞(HgCl2), 毒性很强, 是汞元素的主要毒性形态;甲基汞(MeHg)和乙基汞(EtHg)等属于有机汞, 往往是无机汞的代谢产物, 其毒性强于无机汞, 其中以甲基汞的毒性最强[27]。
刘洪旭等[28]建立了测定含朱砂中成药中甲基汞和乙基汞的HPLC-ICP-MS方法。采用盐酸提取, 二氯甲烷萃取, 水封吹氮浓缩对样品进行前处理。作者运用该方法测定了19种含朱砂中成药中甲基汞和乙基汞的含量, 仅牛黄千金散中检出0.006 6 mg·kg-1的甲基汞, 其他均未检出, 说明含朱砂中成药还是以稳定的、不活泼的硫化汞形式存在。
2.4 药物代谢及药物动力学在药物研发过程中, 母体化合物和代谢物由于检测响应值的不同, 通常需要放射性标记药物或者代谢物的合成对照品, 这是个昂贵且耗时的过程。ICP-MS技术的化合物响应值与种类无关, 以此为基础的方法可以替代放射性标记方法, 适用于研发中的含硫、溴等药物代谢物的研究。Meermann等[29]利用HPLC-ICP-MS结合在线同位素稀释法对人类粪便样品中的含溴药物代谢物进行了研究。将含溴的抗结核药物TMC 207给予耐多药结核感染患者, 收集粪便样品。采用HPLC-ICP-MS法对TMC 207代谢物进行定性鉴别, 用添加Br81的溴化钠和含天然溴的溴化钠制得同位素稀释法, 再用HPLC-ICP-MS结合在线同位素稀释法进行定量分析, 避免TMC 207由于半衰期长使用放射性标记方法对受试者造成伤害。Losada等[30]利用LC-ICP-MS以依他尼酸和噻托溴铵两化合物为探针物质对含硫药物体内体外代谢物进行了分析, 并重点对ICP-MS条件进行了优化。2种药物都通过生成谷胱甘肽缀合物代谢, 为避免多原子离子的干扰, 通过测定SO+离子(m/z 48)对S的间接检测进行了优化, 调整流动相中有机溶剂的比例, 确定LC-ICP-MS检测的灵敏度。提出溶剂区量化和后柱梯度补偿方法以减少有机溶剂对含S-代谢物的定量效果。该技术慢慢成为一种强大的有选择性的含S-药物代谢物的定量分析的工具。
岳向阳等[31]研究了琥珀酸亚铁片剂的人体药动学和生物等效性。将20名健康男性受试者随机分配到2个给药组, 交叉服用参比制剂和受试制剂200 mg, 每一周期于服药前后一定时间内采集静脉血, 用ICP-MS测定琥珀酸亚铁血药浓度。计算参比制剂和受试制剂的主要药动学参数, 并进行方差分析和双单侧t检验, 评价两者的生物等效性。结果2种制剂的90%置信区间分别为89.9%~109.2%和92.5%~107.7%, 在生物等效范围内。参比制剂和受试制剂的Tmax经Wilcoxon非参数检验, P > 0.05, 未见显著性差异, 表明2种制剂具有生物等效性。
青黄散由青黛和雄黄2味中药组成, 在临床使用过程中, 通常根据病情及患者个体差异, 将青黛与雄黄分别按7:3、8:2、9:1这3种配伍进行组方使用。刘耀武等[32]采用ICP-MS对青黄散中青黛和雄黄剂量配比对体内砷变化的影响规律进行了研究, 为进一步研究青黄散在治疗白血病中量效关系提供理论基础。作者以大鼠为研究对象, 按照青黛与雄黄配伍比例的不同分为7:3组、8:2组、9:1组, 3组中雄黄的剂量保持一致。实验结果显示, 随着青黄散中青黛的比例增加, 峰浓度(Cmax)显著性提高, 其药-时曲线下面积(AUC)显著增大, 体内平均滞留时间(MRT)无明显变化, 说明在青黄散中, 青黛能促进砷的吸收, 但对砷的消除无明显影响。
吴艳萍等[33]利用ICP-MS研究了胃舒散中重金属铋在大鼠体内药代动力学。实验结果显示, 铋的血药浓度在0.5 h左右达到高峰, 达峰浓度在15 μg·L-1左右, 7 h降至较低水平。铋在大鼠体内吸收半衰期14.7 min, 消除半衰期为293.4 min, 血浆药物总清除率1 571.0 L·min-1·kg-1。说明铋在大鼠体内的药代动力学模型符合一房二室模型, 为研究该物质在体内的蓄积情况提供了实验依据。
2.5 生物样品分析生物样品由于样本量小, 内源性物质和代谢产物的干扰多, 使其在分析处理上比常规分析困难得多。这就要求对生物样品的处理分析方法有更高的选择性和灵敏度。ICP-MS方法选择性好, 灵敏度高, 分析定量与化合物结构无关的特点成为生物样品分析的理想选择。
LI等[34]建立了应用ICP-MS技术同时测定人体血浆中MCF-7细胞(人乳腺癌细胞)和HepG2细胞(人肝癌细胞)的方法。作者采用特殊的磁化学方法, 使MCF-7细胞和HepG2细胞分别键合纳米金材料和硒化镉纳米晶体(CdSe), 然后通过测定Au和Cd的含量即可推算MCF-7细胞和HepG2细胞的数量。该方法的检测限为50个MCF-7细胞和89个HepG2细胞, MCF-7细胞的线性范围为200~40 000个, HepG2细胞的线性范围为300~30 000个。
郑嘉欣等[35]采用ICP-MS对28名健康对照者及34例肾癌患者血清中多种微量元素含量进行测定, 并用偏最小二乘法判别分析和Fisher判别分析对结果进行显著性分析和模式识别分析, 来探讨肾癌患者血清中微量元素水平与肾癌的关系。结果显示, 肾癌患者与健康组相比, 血清中V、Co、Ni、Mn、Cd的含量显著增高(P < 0.05), 而Ca、Zn含量显著降低(P < 0.05)。肾癌患者样本和健康对照者样本被分别聚为2类, 肾癌组明显偏离对照组, 从而实现对肾癌的判别分析。
药用铂制剂是临床上常用的抗癌药物, 但所有铂制剂均有较大副作用, 若剂量不足则达不到效果, 但过量会引起诸多不良后果。顺铂和奥沙利铂在纯水和血浆中不稳定, 奥沙利铂在0.9%的氯化钠中不稳定, 刘德晔等[36]通过测定顺铂和奥沙利铂色谱保留时间和卡铂的标准曲线来间接测定血浆中不稳定的顺铂和奥沙利铂。此方法能够准确检测血浆中游离铂制剂浓度, 可以反映这些药物在患者尤其肾功能受损者血浆中的代谢情况, 对药效评估有重要作用。
金属类抗癌药物在体内的吸收、分布、癌细胞定向传递及靶向释放等过程很大程度上取决于金属药物与体内蛋白的结合。毛细管电泳色谱电感耦合等离子体质谱联用技术(CE-ICP-MS)在金属药物与体内蛋白相互作用的研究中应用广泛[37]。Timerbaev等[38]应用CE-ICP-MS建立了顺铂脂质体释放及稳定性体外评价方法。游离顺铂、顺铂脂质体、顺铂血浆蛋白结合物可通过CE分离而实现分别测定。该方法可用于顺铂脂质体包封率及其在人血浆中的稳定性及渗漏率的评价。
激光剥蚀电感耦合等离子体质谱联用技术(LA-ICP-MS)适合于各种生物样品(脑, 软骨, 肝, 脊髓等)的薄组织切片中元素分布的定性和定量研究[39], 使其在帕金森综合症[40-41]、威尔逊氏病[42]等疾病的研究中起到了非常重要的作用。大脑中铜元素的含量与老年退行性疾病及神经系统疾病有着重要关系。WANG等[43]应用LA-ICP-MS技术对不同鼠龄小鼠大脑中铜元素的吸收及蓄积情况进行了研究, 发现随着鼠龄的增加, 小鼠大脑对铜元素的吸收能力降低, 而铜蓄积量增加, 两者之间形成动态平衡。而纹状体及视皮质等具有病灶部位铜元素的吸收和蓄积都降低, 可为神经系统疾病的深入研究提供依据。
2.6 药品质量控制金鹏飞等[44]建立了ICP-MS同时测定多维元素片中Cu、Mn、Cr、Se、Mo等8种微量元素的方法, 并将该方法和国家法定方法(原子吸收分光光度法)进行方法学比较。实验结果表明, 该方法和国家法定方法的测定值之间具有良好的重合性。符传武等[45]采用ICP-MS建立了检测明胶空心胶囊中遮光剂二氧化钛含量的方法, 对监管部门控制二氧化钛在明胶空心胶囊中随意添加的行为, 确保明胶空心胶囊安全有一定的意义。
阿加曲班是一种凝血酶抑制剂, 在其原料药生产过程中用到了钯碳作为催化剂, 虽然经过精制, 但成品中仍会有Pd残留且会被进一步引入到制剂中。张亚红等[46]为控制阿加曲班原料药质量, 采用ICP-MS建立了阿加曲班原料药中Pd残留量的检测方法。实验结果表明, 该方法可用于阿加曲班原料药中催化剂Pd的残留量测定, 同时为测定其他品种原料药中Pd残留量提供参考。
颜敏等[47]应用ICP-MS测定了16批药用玻璃容器样品中Al、Cr、Mn、Fe、Cu等13种金属元素的浸出量。16批样品中Cu、Zn、Cd、Sn、Sb、Pb元素均未检出, 仅部分样品检出微量Cr、Mn、Fe、As、Ba、Ce元素, 16批样品均检出Al元素, 浸出量在131.7~5 160.7 ng·mL-1。根据样品测定结果, 作者建议增加输液类药用玻璃容器中Al元素浸出量的监测。
3 问题与展望ICP-MS尽管在药物分析领域表现出了不凡的优点, 但在应用中存在的问题也应引起重视, 如信号波动和基体效应, 氧化物、双电荷离子、多原子离子、同量异位素和物理效应的干扰。应用内标可有效校正信号波动, 质量数接近的元素受信号波动和基体效应的影响大小相近, 所以内标的选择以质量数接近为最佳, 而进行多元素分析时, 应用双内标或多内标是很好的解决办法, 但应选择质量数尽可能相近的元素作为双内标或多内标。使用与基体匹配的标准、同位素稀释或更基本的方法如稀释样品或从基体中分离出痕量元素等均可改善基体效应[48]。对于氧化物的干扰, 提升等离子体的温度, 减缓入射气流速度或减小氧化物形成区与提取孔之间的距离等措施使其低于可接受水平。双电荷离子干扰较为少见, 通常可以通过校正解决, 但当其与氧化物共存时, 响应会随入射气流速度等等离子体参数而变化。多原子离子干扰可以通过优化操作条件及简化分析过程, 若操作不谨慎则通常会出现较大的误差[49]。相邻元素间的同量异位素可能引起严重的干扰, 但可通过测定稳定的另一同位素来进行校正[50]。记忆效应可通过谨慎选择等离子体的操作条件如基体浓度、功率、入射气流速度等加以控制, 另外减小先于样品引入标准物的浓度也可减小记忆效应[51]。
样品前处理是ICP-MS分析技术的重要环节, 可使被测组分从复杂样品中分离出来, 成为便于测定的溶液形式并可除去对分析测定有干扰的基体物质;如果被测组分的浓度较低, 还需要进行浓缩富集;如果被测组分用选定的分析方法难以检测, 还需要通过样品衍生化处理使其定量转化成另一种易于检测的化合物。可溶性无机样品可直接用水溶解并加入适量酸制成测定溶液, 其他大多数固体无机样品都可使用酸分解制备样品。有机样品常见的样品前处理方法包括干灰化法、湿法消解、高压消解和微波消解等。干灰化法空白低, 操作简单, 但易导致元素的部分损失, 回收率偏低, 准确度低;湿法消解是实验室常用的一种消解模式, 该方法同样存在待测元素挥发损失的问题;高压消解可通过升高试剂的沸点而使消解温度提高, 进而显著缩短样品的分解时间, 使一些难溶解物质易于溶解, 并有效控制元素挥发损失;微波消解是无机元素测定的一种较为有效的前处理手段, 其完全在密闭的环境中进行, 能尽量避免目标元素的污染和损失。
近年来ICP-MS法在药物分析领域得到不断发展, 应用也越来越广泛。作为一种无机质谱, 其检测限低, 动态线性范围宽, 多元素同时检测等优点使其在元素分析方面占据重要地位。随着接口技术的不断发展, 色谱联用ICP-MS使其应用范围不断扩大。生物样品由于样品量有限, 基质复杂, 元素及其各形态的含量低, 元素形态在分析过程中可能发生转变等问题, 使得生命体系中痕量元素及其形态分析成为药物分析中亟待解决的一个富有挑战性的课题, 也是目前分析科学研究的热点之一。ICP-MS高灵敏度, 高分辨率以及“与化合物结构无关的特性”更是使其应用慢慢向生命科学领域延伸, 尤其与有机质谱和生物质谱结合更是可以解决一些科学前沿问题。然而复杂的生物基体往往也会影响ICP-MS或色谱-ICP-MS测定结果的准确性。因此, 研究合适的样品前处理技术对目标分析物进行富集, 同时与基体分离, 进一步改善方法的分析性能, 是目前分析化学中的一个重要研究方向。
| [1] |
MILLOUR S, NOEL L, KADAR A, et al. Simultaneous analysis of 21 elements in foodstuffs by ICP-MS after closed-vessel microwave digestion:method validation[J]. J Food Compos Anal, 2011, 24(1): 111. DOI:10.1016/j.jfca.2010.04.002 |
| [2] |
张伟, 周长明, 任连杰, 等. 微波消解-ICP-MS测定人血白蛋白中痕量元素[J]. 药物分析杂志, 2015, 35(3): 553. ZHANG W, ZHOU CM, REN LJ, et al. Determination of trace elements in human albumin by microwave digestion ICP-MS[J]. Chin J Pharm Anal, 2015, 35(3): 553. |
| [3] |
刘潇潇, 杨德忠, 李华. ICP-MS法测定清开灵系列制剂中17种元素的含量[J]. 药物分析杂志, 2015, 35(11): 2018. LIU XX, YANG DZ, LI H. Content determination of 17 elements in Qingkailing preparations by ICP-MS[J]. Chin J Pharm Anal, 2015, 35(11): 2018. |
| [4] |
老骄阳, 田腾跃, 王帅, 等. ICP-MS测定茯苓与猪苓中无机元素的含量[J]. 中国实验方剂学杂志, 2016, 22(5): 84. LAO JY, TIAN TY, WANG S, et al. Determination of inorganic elements in Poria and Polyporus by ICP-MS[J]. Chin J Exp Tradit Med Form, 2016, 22(5): 84. |
| [5] |
常安, 杨燕云, 许亮, 等. ICP-MS测定不同来源和不同产地透骨草25种无机元素及统计分析[J]. 中国实验方剂学杂志, 2016, 22(5): 54. CHANG A, YANG YY, XU L, et al. Determination of 25 inorganic elements in Tougucao from different origins and areas by ICP-MS and statistical analysis[J]. Chin J Exp Tradit Med Form, 2016, 22(5): 54. |
| [6] |
罗益远, 刘娟秀, 刘训红, 等. ICP-MS分析何首乌炮制前后无机元素差异[J]. 中国新药杂志, 2015, 24(8): 942. LUO YY, LIU JX, LIU XH, et al. Analysis of the inorganic element differences in Polygoni Multiflori Radix before and after processing by ICP-MS[J]. Chin New Drugs J, 2015, 24(8): 942. |
| [7] |
罗益远, 刘娟秀, 侯娅, 等. 何首乌不同产地及商品药材中无机元素的ICP-MS分析[J]. 中草药, 2015, 46(7): 1056. LUO YY, LIU XJ, HOU Y, et al. ICP-MS analysis on inorganic elements in Polygoni Multiflori Radix from different habitats and commercial herbs[J]. Chin Tradit Herb Drug, 2015, 46(7): 1056. DOI:10.7501/j.issn.0253-2670.2014.07.022 |
| [8] |
岳媛, 杨晓阳, 肖佳佳, 等. ICP-MS法测定川明参中6种重金属元素[J]. 中草药, 2016, 47(9): 1595. YUE Y, YANG XY, XIAO JJ, et al. Determination of heavy metal elements in Chuanmingshen violaceum by ICP-MS[J]. Chin Tradit Herb Drug, 2016, 47(9): 1595. DOI:10.7501/j.issn.0253-2670.2016.09.025 |
| [9] |
陈佳, 乔菲, 金红宇, 等. ICP-MS法测定马钱子中重金属及有害元素含量的不确定度评定[J]. 药物分析杂志, 2013, 33(12): 2176. CHEN J, QIAO F, JIN HY, et al. Evaluation of the uncertainty for the determination of heavy metals in Strychni Semen by ICP-MS[J]. Chin J Pharm Anal, 2013, 33(12): 2176. |
| [10] |
杨雪梅, 韩伟立, 刘洪涛, 等. 微波消解ICP-MS法测定药材预知子及其提取物中重金属含量[J]. 时珍国医国药, 2011, 22(8): 2012. YANG XM, HAN WL, LIU HT, et al. Determination of heavy metals in Fructus Akebiae and Fructus Akebiae extracts by ICP-MS with microwave[J]. Lishizhen Med Mater Med Res, 2011, 22(8): 2012. |
| [11] |
甘彦雄, 郑勇凤, 汪蕾, 等. 基于ICP-MS分析蓬莪术醋制前后煎液及沉淀物重金属转移率变化[J]. 中国中药杂志, 2016, 41(1): 65. GAN YX, ZHENG YF, WANG L, et al. Analysis on transfer rate change of heavy metal in decoction and precipitation of Curcuma phaeocaulis before and after processing with vinegar based on ICP-MS[J]. China J Chin Mater Med, 2016, 41(1): 65. |
| [12] |
胡麟, 胡昌江, 吴文辉, 等. 微波消解-ICP-MS法测定3种中药饮片及配方颗粒中的重金属及其转移率[J]. 中成药, 2015, 37(10): 2238. HU L, HU CJ, WU WH, et al. Determination of heavy metals and their transfer rates in three traditional Chinese medicine decoction pieces and dispensing granules by microwave digestion ICP-MS[J]. Chin Tradit Pat Med, 2015, 37(10): 2238. |
| [13] |
周天泽. 中草药微量元素形态分析的几个问题[J]. 中草药, 1990, 21(10): 37. ZHOU TZ. Some questions about speciation analysis of trace element of Chinese herbal medicine[J]. Chin Tradit Herb Drugs, 1990, 21(10): 37. DOI:10.3321/j.issn:0253-2670.1990.10.012 |
| [14] |
刘威, 李峰, 张帅, 等. ICP-MS法对茯苓中24种微量元素的形态分析及其溶出特性研究[J]. 辽宁中医杂志, 2016, 43(3): 562. LIU W, LI F, ZHANG S, et al. Speciation analysis and extracting characteristics of 24 trace elements in Poria cocos[J]. Liaoning J Tradit Chin Med, 2016, 43(3): 562. |
| [15] |
李铮, 赵一懿, 杜小伟, 等. ICP-MS法测定朱砂安神丸中可溶性汞[J]. 中成药, 2016, 38(12): 2723. LI Z, ZHAO YY, DU XW, et al. Determination of soluble mercury in Zhusha Anshen Pills by ICP-MS[J]. Chin Tradit Pat Med, 2016, 38(12): 2723. |
| [16] |
王辰洋, 金鹏飞, 邝咏梅, 等. ICP-MS研究含雄黄中成药中的砷元素在胃肠液中的溶出特性[J]. 沈阳药科大学学报, 2015, 32(11): 853. WANG CY, JIN PF, KUANG YM, et al. Dissolution characteristics of arsenic in gastrointestinal fluids for realgar-containing traditional Chinese medicines by ICP-MS[J]. J Shenyang Pharm Univ, 2015, 32(11): 853. |
| [17] |
白国银, 韦超, 欧阳荔, 等. 含矿物中成药及其胃肠消化液中五种重金属元素的测定研究[J]. 光谱学与光谱分析, 2011, 31(1): 256. BAI GY, WEI C, OUYANG L, et al. Determination of 5 heavy metals in traditional Chinese medicines and extraction liquid containing mineral materials[J]. Spectrosc Spect Anal, 2011, 31(1): 256. |
| [18] |
金鹏飞, 宋丽洁, 胡欣, 等. ICP-MS研究中药炮制前后18种微量元素总量和溶出特性的变化[J]. 中国药学杂志, 2010, 45(12): 893. JIN PF, SONG LJ, HU X, et al. Effect of processing on content and dissolution of 18 trace elements in traditional Chinese medicines by ICP-MS[J]. Chin Pham J, 2010, 45(12): 893. |
| [19] |
高双荣, 梁爱华, 易艳, 等. 雄黄中砷的不同形态及其毒性研究进展[J]. 中国实验方剂学杂志, 2011, 17(24): 243. GAO SR, LIANG AH, YI Y, et al. Advances in research on different forms of arsenic in realgar and its toxicity[J]. Chin J Exp Tradit Med Form, 2011, 17(24): 243. |
| [20] |
李丽敏, 夏晶, 王欣美, 等. HPLC-ICP-MS法研究5种含雄黄中成药的可溶性砷及其形态[J]. 中成药, 2012, 34(11): 2118. LI LM, XIA J, WANG XM, et al. Speciations of soluble arsenic in five Chinese patent medicines by HPLC-ICP-MS[J]. Chin Tradit Pat Med, 2012, 34(11): 2118. DOI:10.3969/j.issn.1001-1528.2012.11.017 |
| [21] |
金鹏飞, 梁晓丽, 夏路风, 等. ICP-MS研究牛黄解毒片中20种微量元素的总量及在水和胃肠液中的溶出特性[J]. 药物分析杂志, 2014, 34(6): 985. JIN PF, LIANG XL, XIA LF, et al. Study on total contents of 20 trace elements in Niuhuang Jiedu tablets and their extract rates in water and gastrointestinal fluids by ICP-MS[J]. Chin J Pharm Anal, 2014, 34(6): 985. |
| [22] |
金鹏飞, 夏路风, 梁晓丽, 等. 高效液相色谱-电感耦合等离子体质谱研究牛黄解毒片在水和胃肠液中溶出砷的形态[J]. 中国药学杂志, 2013, 48(24): 2162. JIN PF, XIA LF, LIANG XL, et al. Arsenic speciation of Niuhuang Jiedu tablets in water and gastrointestinal fluids by HPLC-ICP-MS[J]. Chin Pharm J, 2013, 48(24): 2162. |
| [23] |
陈绍占, 杜振霞, 刘丽萍, 等. 高效液相色谱-电感耦合等离子质谱法分析雄黄在大鼠脏器中代谢的砷形态[J]. 分析化学, 2014, 42(3): 349. CHEN SZ, DU ZX, LIU LP, et al. Analysis of arsenic metabolites of realgar in rat viscera by HPLC-ICP-MS[J]. Chin J Anal Chem, 2014, 42(3): 349. |
| [24] |
王英锋, 竺梅, 冯敏, 等. 仁青芒觉中可溶性砷形态的HPLC-ICP-MS研究[J]. 药物分析杂志, 2011, 31(10): 1884. WANG YF, ZHU M, FENG M, et al. Speciation analysis of solvable arsenic in Renqing Mangjue by HPLC-ICP-MS[J]. Chin J Pharm Anal, 2011, 31(10): 1884. |
| [25] |
金鹏飞, 吴学军, 邹定, 等. HPLC-ICP-MS研究炮制对中药砷形态的影响[J]. 光谱学与光谱分析, 2011, 31(3): 816. JIN PF, WU XJ, ZOU D, et al. Study on arsenic speciation changes in crude and processed traditional Chinese medicines by HPLC-ICP-MS[J]. Spectrosc Spect Anal, 2011, 31(3): 816. |
| [26] |
汪建君, 陈惠玲, 李玲玲. HPLC-ICP-MS测定泽泻、金银花、鸡血藤中可溶性价态砷及残留限度[J]. 中国现代应用药学, 2015, 32(11): 1359. WANG JJ, CHEN HL, LI LL. Speciations of soluble arsenic and the limit standard in Alismatis Rhizome, Lonicerae Japonicae Flos and Spatholobi Caulis by HPLC-ICP-MS[J]. Chin J Mod Appl Pharm, 2015, 32(11): 1359. |
| [27] |
WU Q, LU YF, SHI JZ, et al. Chemical form of metals in traditional medicines underlines potential toxicity in cell cultures[J]. J Ethnopharmacol, 2011, 134(3): 839. DOI:10.1016/j.jep.2011.01.031 |
| [28] |
刘洪旭, 吴文晞, 王丹红, 等. 含朱砂中成药中甲基汞和乙基汞含量的HPLC-ICP-MS法检测[J]. 时珍国医国药, 2012, 23(4): 873. LIU HX, WU WX, WANG DH, et al. Determination of methyl mercury and ethyl mercury in traditional Chinese medicines containing cinnabar by HPLC-ICP-MS[J]. Lishizhen Med Mater Med Res, 2012, 23(4): 873. |
| [29] |
MEERMANN B, BOCKX M, LAENEN A. Speciation analysis of bromine-containing drug metabolites in feces samples from a human in vivo study by means of HPLC/ICP-MS combined with on-line isotope dilution[J]. Anal Bioanal Chem, 2012, 402(1): 439. DOI:10.1007/s00216-011-5339-y |
| [30] |
LOSADA C, ALBERTIl JJ, SAURINA J. Determination of S-containing drug metabolites from in vitro and in vivo metabolism studies by using LC-ICP/MS[J]. Anal Bioanal Chem, 2012, 404(2): 539. DOI:10.1007/s00216-012-6145-x |
| [31] |
岳向阳, 金鹏飞, 曹国颖, 等. ICP-MS研究琥珀酸亚铁片剂的人体药动学及生物等效性[J]. 药物分析杂志, 2011, 31(2): 326. YUE XY, JIN PF, CAO GY, et al. ICP-MS determination of human pharmacokinetics and bioequivalence of ferrous succinate tablets[J]. Chin J Pharm Anal, 2011, 31(2): 326. |
| [32] |
刘耀武, 汪电雷, 黄鹏, 等. ICP-MS法研究不同青黛和雄黄配伍组方对大鼠体内砷吸收的影响[J]. 中药材, 2016, 39(4): 902. LIU YW, WANG DL, HUANG P, et al. Analysis of arsenic absorption in mice influenced by different natural indigo and realgar compatibility formula using ICP-MS[J]. J Chin Med Mater, 2016, 39(4): 902. |
| [33] |
吴艳萍, 林旭楷. 胃舒散中重金属铋在大鼠体内药代动力学研究[J]. 中国实验方剂学杂志, 2011, 17(22): 108. WU YP, LIN XK. Study on pharmacokinetic of bismuth in Weishu San in rat[J]. Chin J Exp Tradit Med Form, 2011, 17(22): 108. DOI:10.3969/j.issn.1005-9903.2011.22.033 |
| [34] |
LI XT, CHEN BB, HE M, et al. Simultaneous detection of MCF-7 and HepG2 cells in blood by ICP-MS with gold nanoparticles and quantum dots as elemental tags[J]. Biosens Bioelectron, 2017, 90: 343. DOI:10.1016/j.bios.2016.11.030 |
| [35] |
郑嘉欣, 邢金春, 林琳, 等. 电感耦合等离子体质谱法测定肾癌患者血清微量元素水平及其模式识别分析[J]. 国际肿瘤学杂志, 2011, 38(12): 948. ZHENG JX, XING JC, LIN L, et al. Determination and pattern recognition of trace elements in serum samples from patients with renal cell carcinoma by ICP-MS[J]. J Int Oncol, 2011, 38(12): 948. DOI:10.3760/cma.j.issn.1673-422X.2011.12.022 |
| [36] |
刘德晔, 朱醇, 马永建, 等. 高效液相色谱-电感耦合等离子体质谱测定血浆中铂类抗癌药物[J]. 分析试验室, 2012, 31(7): 75. LIU DY, ZHU C, MA YJ, et al. A rapid method for determination of anticancer platinum medicines by high performance liquid chromatography-inductively coupled plasma mass spectrometry[J]. Chin J Anal Lab, 2012, 31(7): 75. |
| [37] |
TIMERBAEV AR, PAWLAK K, ALEKSENKO SS, et al. Advances of CE-ICP-MS in speciation analysis related to metalloproteomics of anticancer drugs[J]. Talanta, 2012, 102(24): 164. |
| [38] |
NGUYEN TT, OSTERGAARD J, STURUP S, et al. Determination of platinum drug release and liposome stability in human plasma by CE-ICP-MS[J]. Int J Pharm, 2013, 449(1-2): 95. DOI:10.1016/j.ijpharm.2013.03.055 |
| [39] |
SUSSULINI A, BECKER JS, BECKER JS. Laser ablation ICP-MS:Application in biomedical research[J]. Mass Spectrom Rev, 2017, 36(1): 47. DOI:10.1002/mas.v36.1 |
| [40] |
MATUSCH A, FENN LS, DEPDOYLU C, et al. Combined elemental and biomolecular mass spectrometry imaging for probing the inventory of tissue at a micrometer scale[J]. Anal Chem, 2012, 84(7): 3170. DOI:10.1021/ac203112c |
| [41] |
MATUSCH A, DEPDOYLU C, PALM C, et al. Cerebral bioimaging of Cu, Fe, Zn, and Mn in the MPTP mouse model of Parkinson's disease using laser ablation inductively coupled plasma mass spectrometry (LA-ICP-MS)[J]. J Am Soc Mass Spectrom, 2010, 21(1): 161. DOI:10.1016/j.jasms.2009.09.022 |
| [42] |
BOARU SG, MERLE U, UERLINGS R, et al. Simultaneous monitoring of cerebral metal accumulation in an experimental model of Wilson's disease by laser ablation inductively coupled plasma mass spectrometry[J]. BMC Neurosci, 2014, 15(1): 98. DOI:10.1186/1471-2202-15-98 |
| [43] |
WANG LM, BECKER JS, WU Q, et al. Bioimaging of copper alterations in the aging mouse brain by autoradiography, laser ablation inductively coupled plasma mass spectrometry and immunohistochemistry[J]. Metallomics, 2010, 2(5): 348. DOI:10.1039/c003875j |
| [44] |
金鹏飞, 马捷, 邹定, 等. ICP-MS同时测定多维元素片(29)中8种微量元素的含量[J]. 药物分析杂志, 2009, 29(6): 994. JIN PF, MA J, ZOU D, et al. Simultaneous determination of 8 trace elements in vitamins with minerals tablets (29) by ICP-MS[J]. Chin J Pharm Anal, 2009, 29(6): 994. |
| [45] |
符传武, 韦瑶瑶, 洪薇, 等. ICP-MS测定明胶空心胶囊中的二氧化钛[J]. 药物分析杂志, 2015, 35(12): 2209. FU CW, WEI YY, HONG W, et al. Determination of titanium dioxide in gelatin empty capsules by inductively coupled plasma mass spectrometry[J]. Chin J Pharm Anal, 2015, 35(12): 2209. |
| [46] |
张亚红, 李华龙. 电感耦合等离子体质谱法测定阿加曲班原料药中催化剂钯的残留量[J]. 药物分析杂志, 2016, 36(9): 1667. ZHANG YH, LI HL. Determination of catalyst palladium residue in argatroban crude product by ICP-MS[J]. Chin J Pharm Anal, 2016, 36(9): 1667. |
| [47] |
颜敏, 刘园园, 贺瑞玲, 等. ICP-MS法测定药用玻璃容器中13种金属元素的浸出量[J]. 药物分析杂志, 2016, 36(1): 133. YAN M, LIU YY, HE RL, et al. Determination of leaching amount of 13 metal elements in pharmaceutical glass containers by ICP-MS[J]. Chin J Pharm Anal, 2016, 36(1): 133. |
| [48] |
CASTIÑEIRA MM, BRANDT R, BOHLEN AV, et al. Development of a procedure for the multi-element determination of trace elements in wine by ICP-MS[J]. J Anal Chem, 2001, 370(5): 553. DOI:10.1007/s002160100862 |
| [49] |
VENTH K, DANZER K, KUNDERMANN G, et al. Multisignal evaluation in ICP-MS determination of trace elements in Mo-Zr-alloy[J]. Anal Bioanal Chem, 1996, 354(7-8): 811. DOI:10.1007/s0021663540811 |
| [50] |
MEIJA J, CARUSO JA. Deconvolution of isobaric interferences in mass spectra[J]. J Am Soc Mass Spectrom, 2004, 15(5): 654. DOI:10.1016/j.jasms.2003.12.016 |
| [51] |
DIEMER J, QUÉTEL C, TAYLOR P. Contribution to the certification of B, Cd, Cu, Mg and Pb in a synthetic water sample, by use of isotope-dilution ICP-MS, for Comparison 12 of the International Measurement Evaluation Programme[J]. Anal Bioanal Chem, 2002, 374(2): 220. |
 2017, Vol. 37
2017, Vol. 37 
