拉坦前列素(latanoprost)是一种新型苯基替代的丙基酯前列素PGF2ɑ,是选择性F2ɑ受体激动剂,是以异丙酯为存在形式的前体药物[1]。它通过角膜被吸收,在酯酶的作用下水解为具有生物活性的游离酸,以增加房水的巩膜色素外流达到降低眼压、改变眼的颜色[2-3]、减少房水外流[4],临床上作为治疗青光眼及高眼压症的首选药物[5-8]。在拉坦前列素的合成策略中,是以科里内酯作为起始原料,进行两个侧链基团的合成[9-10]。该方法立体选择性差,产生的差向异构体杂质15S-拉坦前列素与拉坦前列素物理化学性质相近,极性差异较小,在精制纯化阶段,很难将15S-拉坦前列素完全除去[11]。由于滴眼液中主成分的浓度仅50 μg·mL-1,难于直接测定其有关物质。目前,进口药品注册标准[12]和国内生产企业注册标准[13]中,仅在原料药检验标准中对该杂质的限量进行控制,对于制剂并没有进行该杂质的控制。文献[14]报道利用乙酸乙酯进行提取浓缩后,采用正相色谱的方法进行测定。由于提取过程复杂,很难避免样品在提取过程中发生降解,且样品中的微量杂质提取不完全而产生损失。本实验采用基于超高效液相-四极杆-静电场轨道阱质谱系统技术,利用高分辨质谱技术的高分辨率和高灵敏度[15],实现对拉坦前列素滴眼液中的差向异构体杂质15S-拉坦前列素进行分析,建立拉坦前列素滴眼液中的15S-拉坦前列素含量测定方法。所建方法专属性强、灵敏度高,为拉坦前列素滴眼液质量控制提供参考。
|
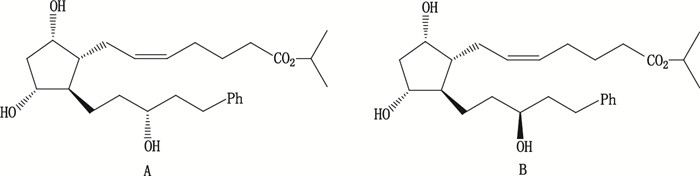
A.拉坦前列素(latanoprost)B.15S-拉坦前列素(15S-latanoprost) 图 1 拉坦前列素和15S-拉坦前列素结构式 Figure 1 Structure of latanoprost and 15S-latanoprost |
Agilent 1290 Infinity超高效液相色谱仪(美国Agilent公司),Q Exactive Focus四极杆-静电场轨道阱高分辨质谱系统(美国Thermo Fisher Scientific公司),配有HESI源及Xcalibur 4.0数据处理系统。Mettler XP 205电子分析天平(瑞士METTLER TOLEDO公司,d=0.01 mg),Milli-Q纯化水(Millipore,Bedford,USA)。色谱柱为Thermo Accucore -C18(2.1 mm×150 mm,2.6 μm;填料:十八烷基硅烷键合硅胶;赛默飞世尔公司)
拉坦前列素对照品(批号:R008T0,含量:97.4 %,购于美国药典委员会);15S-拉坦前列素对照品(批号:LTIM11201,含量:99.9 %,购于美国药典委员会)。拉坦前列素滴眼液(批号:60160401,A企业;批号:5013,B企业;批号:L92219,C企业;规格均为:2.5 mL:125 μg)。乙腈及甲醇均为色谱纯,冰醋酸为优级纯,高纯水,其他试剂均为优级纯。
2 方法与结果 2.1 色谱与质谱条件色谱柱为Thermo Accucore -C18(2.1 mm×150 mm,2.6 μm;填料:十八烷基硅烷键合硅胶);流动相为甲醇-乙腈-水(用冰乙酸调节pH3.0)(48:12:40);流速为0.3 mL·min-1;柱温为35 ℃;进样量为10 μL。采用HESI离子源,正离子扫描模式,扫描范围为m/z 300~600。采用FullMS模式提取离子方式检测,拉坦前列素与15S-拉坦前列素的检测离子均为[M+Na]+m/z 455.277±0.003;电喷雾离子源雾化温度为300 ℃;毛细管电压为3.50 kV;离子传输管温度为320 ℃;鞘气为50 arb;辅助气为10 arb;分辨率为(R)70 000。
2.2 溶液的制备 2.2.1 供试品溶液精密量取拉坦前列素滴眼液适量,用流动相稀释制成每1 mL约含拉坦前列素1 μg的溶液。
2.2.2 拉坦前列素对照品贮备溶液精密称取拉坦前列素对照品适量,用流动相溶解并稀释制成每1 mL约含拉坦前列素1 μg的溶液。
2.2.3 15S-拉坦前列素对照品贮备溶液精密称取15S-拉坦前列素对照品适量,用流动相溶解并稀释制成每1 mL约含15S-拉坦前列素1 μg的溶液。
2.2.4 系统适用性试验溶液精密量取拉坦前列素对照品储备溶液和15S-拉坦前列素对照品储备溶液各1 mL并用流动相定容至100 mL。
2.2.5 空白辅料溶液按照处方的比例,取各辅料制备不含拉坦前列素的空白辅料溶液。
2.2.6 光降解溶液取拉坦前列素滴眼液适量,倒入石英比色皿中,置紫外光灯(254 nm)下放置约7 h。精密量取经光照射后的拉坦前列素滴眼液适量,用流动相稀释制成每1 mL约含拉坦前列素1 μg的溶液。
2.3 目标离子的选择取“2.2.2”项下拉坦前列素对照品储备溶液与“2.2.3”项下15S-拉坦前列素对照品贮备溶液,分别分析,采用正离子方式在m/z 300~600扫描。拉坦前列素与15S-拉坦前列素是立体异构体,它们的单同位素质量均为432.2870(C26H40O5),经计算可知m/z 433.2948(cal.433.2948,D=0)为[M+H]+,m/z 455.2766(cal.455.2768,D=4.4×10-7)为[M+Na]+,m/z 471.2507(cal.471.2507,D=0)为[M+K]+,见图 2。根据化合物在质谱中的信号响应的强弱,选择[M+Na]+m/z 455.277±0.003为目标离子进行定量分析。
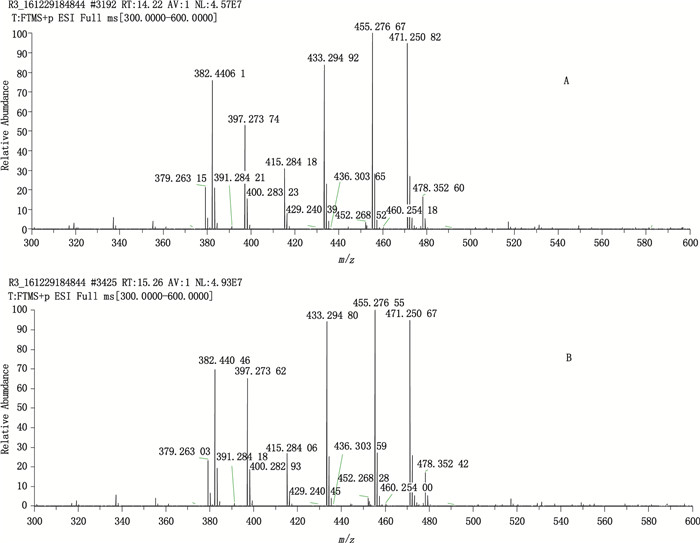
|
图 2 拉坦前列素(A)与15S拉坦前列素(B)的Full MS图 Figure 2 Full MS spectra of latanoprost (A) and 15S-latanoprost (B) |
取空白辅料溶液、系统适用性试验溶液与供试品溶液,按照“2.1”项下试验条件进样测定,记录质谱图,见图 3。在该条件下,拉坦前列素峰与15S-拉坦前列素的分离度大于1.5。空白辅料中杂质峰对拉坦前列素和15S-拉坦前列素色谱峰没有干扰。
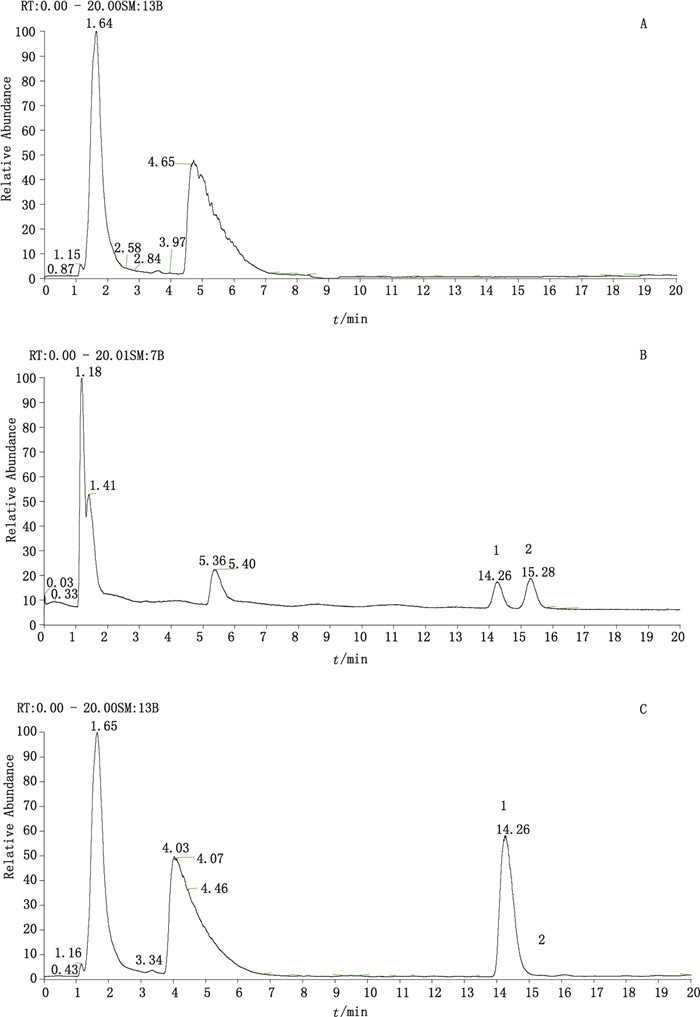
|
1.拉坦前列素(latanoprost)2.15S-拉坦前列素(15S-latanoprost) A.空白辅料溶液(auxiliary material solution)B.系统适用性试验溶液(system suitability solution)C.供试品溶液(sample solution) 图 3 系统适用性试验TIC色谱图 Figure 3 TIC chromatograms |
分别精密量取拉坦前列素对照品贮备溶液与15S-拉坦前列素对照品储备溶液用流动相定量稀释,制得浓度均约为1.0、2.0、5.0、10.0、20.0 ng·mL-1标准系列浓度的溶液,按“2.1”项下条件进样测定。以离子峰面积为纵坐标(Y),以浓度为横坐标(X),进行线性回归,其线性方程见表 1。
|
|
表 1 拉坦前列素及15S-拉坦前列素的线性方程 Table 1 Regression equation of latanoprost and 15S-latanoprost |
将拉坦前列素对照品溶液与15S-拉坦前列素对照品溶液用流动相逐步稀释,按“2.1”项下试验条件测定,以S/N=10求得拉坦前列素与15S-拉坦前列素的定量限(LOQ),以S/N=3求得拉坦前列素与15S-拉坦前列素的检测限(LOD)。结果见表 1。
2.7 精密度试验取系统适用性试验溶液,按“2.1”项下试验条件连续进样6次,计算系统适用性试验溶液中拉坦前列素及15S-拉坦前列素色谱峰面积,其RSD分别为0.11%与0.12%。表明仪器精密度良好。
2.8 重复性试验取供试品(批号:60160401),按“2.2.1”制备供试品溶液6份,进样测定并计算15S-拉坦前列素的含量。结果15S-拉坦前列素的RSD为0.21%。表明该方法的重复性良好。
2.9 稳定性试验取供试品(批号:60160401),按2.2.1制备供试品溶液,在室温条件下避光放置,分别在第0、1、2、4、6 h进样测定,测得15S-拉坦前列素峰面积的RSD为0.16%。表明供试品溶液中15S-拉坦前列素的含量在6 h内稳定。
2.10 回收率试验取9份样品(批号:06160401),每份分别精密加入15S-拉坦前列素对照品溶液(浓度为9.988 ng·mL-1)2.5、5.0、10.0mL,制备低、中、高3种浓度的溶液各3份,进样测定。计算15S-拉坦前列素的平均回收率。结果见表 2。
|
|
表 2 15S-拉坦前列素加样回收率结果(n=9) Table 2 Results of recovery test for 15S-latanoprost |
取“2.2.6”项下光降解溶液,按2.1项下试验条件测定,并计算15S-拉坦前列素的含量为192.3 ng·mL-1。结果表明随着光照时间的增加,15S-拉坦前列素的含量相应增加。
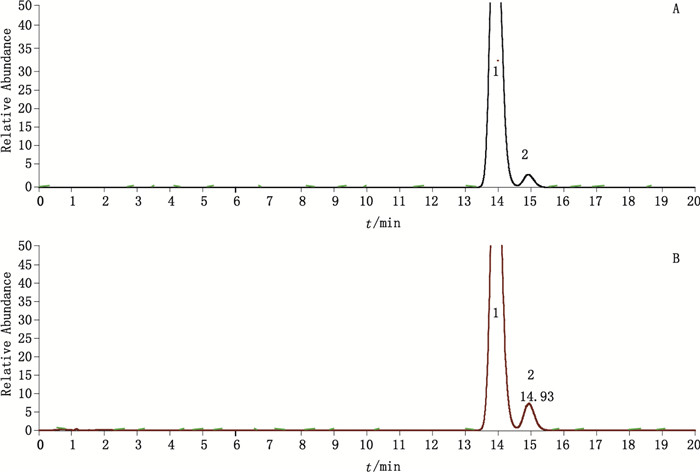
|
1.拉坦前列素(latanoprost)2.15S-拉坦前列素(15S-latanoprost) A.未破坏样品溶液(no degradation test solution)B.光降解样品溶液(light degradation test solution) 图 4 拉坦前列素滴眼液光降解MS图 Figure 4 MS chromatograms for light degradation of latanoprost eye drops |
按“2.1”项下试验条件对3批样品中15S-拉坦前列素的含量进行测定,结果见表 3。
|
|
表 3 样品中15S-拉坦前列素检测结果(n=2) Table 3 Determination results of samples |
本实验采用Full MS模式在m/z 300~600范围对样品进行一级质谱扫描,得到拉坦前列素与15S-拉坦前列素的一级质谱离子峰丰度高,离子信号稳定。在选定的液相色谱条件下,拉坦前列素峰与15S-拉坦前列素峰的峰形正态,分离度好,没有杂质成分的干扰。本实验采用正离子扫描模式,拉坦前列素与15S-拉坦前列素离子化效果好,均分别得到[M+H]+、[M+Na]+与[M+K]+峰,由于[M+Na]+峰的丰度较高,为了得到更高的检测灵敏度,选择[M+Na]+峰作为检测离子,并经方法学验证可行。
3.2 流动相选择本实验检测对象拉坦前列素与15S-拉坦前列素是立体异构体,2种化合物的质谱信息完全一致。采用FullMS扫描后进行提取分子离子峰时,2种化合物的分子离子峰被同时提取出。为了将两种成分区分开,本实验先采用超高效液相色谱将2种成分分离,然后利用2种成分的保留时间的差异进行区分。因此,流动相条件的选择尤为重要。本实验分别考查了甲醇-水、乙腈-水、乙腈-甲醇-水等流动相体系,以及对水相进行pH值调节。最终选择甲醇-乙腈-水(用冰乙酸调节pH3.0)(48:12:40)作为本实验的流动相条件,在该条件下,2种成分分离度良好,没有色谱峰重叠,可以进行单独积分。
3.3 光照条件对制剂稳定性的影响拉坦前列素滴眼液贮藏条件要求避光保存,且在进口药品注册标准JX20070141有关物质检查项下要求避光操作。均提示该滴眼液对光不稳定。因此,本实验着重研究了光照射条件对15S-拉坦前列素含量的影响。实验结果显示,在紫外光照射条件下,随着光照时间的增加,15S-拉坦前列素的含量相应增加。表明15S-拉坦前列素不仅是原料药合成的工艺杂质,同时也是制剂的降解杂质。而进口药品注册标准和国内生产企业注册标准仅通过原料药质量标准进行控制该杂质的限量是不够的。有必要将该杂质的控制方法列入制剂的检验标准中。同时,提示拉坦前列素滴眼液对光不稳定,在贮藏、运输和使用过程中均应注意避光条件。
拉坦前列素滴眼液是治疗青光眼的首选药物,本品的不良反应较多,且较为严重,而样品中的杂质是引起不良反应的主要原因[11]。控制样品中的杂质,是减少不良反应的主要手段[11]。由于拉坦前列素滴眼液的主成分浓度很低(50 μg·mL-1),难以采用常规高效液相的方法测定其有关物质。本实验采用超高效液相-四极杆-静电场轨道阱质谱联用技术,实现了对该滴眼液中15S-拉坦前列素差向异构体杂质的检测,该方法灵敏度高,专属性强,为拉坦前列素滴眼液的质量控制提供参考。
| [1] |
张翠莲. 拉坦前列素[J]. 中国新药杂志, 1998, 7(4): 329. ZHANG CL. Latanoprost[J]. Chin J New Drug, 1998, 7(4): 329. |
| [2] |
ARRANZ ME, TEUS MA, SAORNIL MA, et al. Analysis of irises with a latanoprost-induced changein iris color[J]. Am J Ophthalmol, 2004, 138(4): 625. DOI:10.1016/j.ajo.2004.06.017 |
| [3] |
SAKURAI M, HIGASHIDE T, TAKAHASHI M, et al. Association between genetic polymorphisms of the prostaglandin F2alpha receptor gene and response to latanoprost[J]. OphthalmLology, 2007, 114(6): 1039. DOI:10.1016/j.ophtha.2007.03.025 |
| [4] |
SHERWOOD M, BRANDT J. Six-month comparison of bimato prost once-daily and twice-daily with timolol twice-daily in patients with elevated intraocular pressure[J]. Surv Ophthalmol, 2011, 26(8): 739. |
| [5] |
ALLAIRE C, DIETRICH A, ALLEMIER H, et al. Latanoprost 0.005% test formulation is as effective as Xalatan in patients with ocular hypertension and primary open-angle glaucoma[J]. Eur J Ophthalmol, 2012, 22(1): 19. |
| [6] |
STEIGERWALT RD, VINGOLO EM, PLATEROTI P, et al. The effect of latanoprost and influence of changes in body position on patients with glaucoma and ocular hypertension[J]. Eur Rev Med Pharmacol Sci, 2012, 16(12): 1723. |
| [7] |
PACELLA F, TURCHETTI P, SANTAMARIA V, et al. Differential activity and clinical utility of latanoprost in glaucoma and ocular hypertension; Smaldone[J]. Clin.Ophthalmol, 2012, 6: 811. |
| [8] |
赵军梅, 钱军. 拉坦前列素滴眼液治疗青光眼[J]. 中国新药与临床杂志, 2003, 22(1): 38. ZHAO JM, QIAN J. latanoprost eye drops in treatment of glaucoma[J]. Chin J New Drugs Clin Rem, 2003, 22(1): 38. |
| [9] |
ZANONI G, o'ALFONSO A, PORTA A, et al. The meyere-schuster rearrangement:A new synthetic strategy leading to prostaglandins and their drug analogs, bimatoprost and latanoprost[J]. Tetrahedron, 2010, 66(38): 7472. DOI:10.1016/j.tet.2010.07.069 |
| [10] |
MARTYNOW JG, JOZWIK J, SZELEJEWSKI W, et al. A new synthetic approach to high-purity (15R)-latanoprost[J]. Eur J Org Chem, 2007, 2007(4): 689. DOI:10.1002/(ISSN)1099-0690 |
| [11] |
修志明, 王立成, 黄梦媛, 等. 一种合成拉坦前列素的新方法[J]. 有机化学, 2014, 34: 1786. XIU ZM, WANG LC, HUANG MY, et al. A novel method for the synthesis of latanoprost[J]. Chin J Org Chem, 2014, 34: 1786. |
| [12] |
JX20070141拉坦前列素[S]. 2007 JX20070141 latanoprost[S].2007 |
| [13] |
YBH09502004-2015Z拉坦前列素[S]. 2015 YBH09502004-2015Z latanoprost[S].2015 |
| [14] |
潘端锦, 陈秋芬, 张军东, 等. 拉坦前列素滴眼液中有关物质的NP-HPLC法测定[J]. 中国医药工业杂志, 2013, 44(9): 932. PAN DJ, CHEN QF, ZHANG JD, et al. Determination of the related substance in latanoprost eye drops by NP-HPLC[J]. Chin J Pharm, 2013, 44(9): 932. |
| [15] |
李明, 马家辰, 李红梅, 等. 静电场轨道阱质谱的进展[J]. 质谱学报, 2013, 34(3): 185. LI M, MA J C, LI HM, et al. Progress on electrostatic orbitrap mass spectrometer[J]. J Chin Mass Spectr Soc, 2013, 34(3): 185. DOI:10.7538/zpxb.2013.34.03.0185 |
 2017, Vol. 37
2017, Vol. 37 