2. 浙江工业大学, 杭州 310014
2. Zhejiang University of Technology, Hangzhou 310014, China
硫酸氢氯吡格雷(clopidogrel hydrogen sulfate)是一种有效、安全的血小板聚集抑制剂,临床上主要用于预防和治疗因血小板高聚集状态引起的心、脑及其他动脉的循环障碍疾病,是全球畅销的抗血栓药物。硫酸氢氯吡格雷属于多晶型药物,其中Ⅰ型和Ⅱ型晶型是有效晶型[1]。硫酸氢氯吡格雷的一种合成方法[2]中使用了对甲苯磺酰氯,对甲苯磺酰氯若未在工艺中完全除去,易与后续合成反应中使用的有机溶剂甲醇反应生成具有潜在基因毒性的对甲苯磺酸甲酯(methyl p-toluenesulfonate,MTS)[3]。根据欧洲药事管理局[4]和美国食品药品管理局[5]的法规要求,基因毒性杂质的毒理学关注阈值(threshold of toxicological concern,TTC)限度为1.5 μg·d-1,硫酸氢氯吡格雷每日最高服用剂量为300 mg,因此硫酸氢氯吡格雷中对甲苯磺酸甲酯的限度为5 μg·g-1,有必要建立硫酸氢氯吡格雷中对甲苯磺酸甲酯的检测方法。液相色谱-质谱联用技术具有灵敏度高、分析速度快、结果准确可靠的特点,可以满足痕量毒性杂质检测的要求[6-17]。本试验建立了超高效液相色谱-质谱联用(UHPLC-MS)方法测定2种硫酸氢氯吡格雷晶型中的对甲苯磺酸甲酯,进行了相应的方法学验证,并测定了2种硫酸氢氯吡格雷晶型各3批次样品中对甲苯磺酸甲酯的残留量。
1 仪器与试药Agilent 1290超高效液相色谱仪(美国安捷伦公司),Agilent 6490三重四极杆质谱仪(美国安捷伦公司),配备喷射流技术(Jet Stream)的ESI离子源,质谱软件为MassHunter B.07.01工作站;XPE 205电子天平(瑞士梅特勒托利多公司);Millipore Advantage A10纯水仪(美国Millipore公司)。Zorbax Extend C18(2.1 mm×50 mm,1.8 μm,填料:十八烷基硅烷键合硅胶;Agilent公司)。
对甲苯磺酸甲酯对照品(Adamas公司,批号:P1150562,纯度:99%),硫酸氢氯吡格雷Ⅰ型晶型(批号:A1071309001、A1071310001、A1071310002)和Ⅱ型晶型(批号:A1131511001、A1131511002、A1131511003)均由浙江燎原药业股份有限公司提供;甲醇、乙腈、甲酸均为色谱级(默克公司)。
2 方法与结果 2.1 色谱条件液相色谱柱:Agilent Zorbax Extend C18(2.1 mm×50 mm,1.8 μm);流速0.4 mL·min-1;0.1%甲酸水溶液为流动相A,0.1%甲酸甲醇溶液为流动相B,梯度洗脱(0 ~ 2.5 min,45% B;2.5 ~ 5.0 min,45% B→80% B;5.0 ~ 15.0 min,80% B;15.0 ~ 16.0 min,80% B→45% B;16.0~20.0 min,45% B);柱温:40 ℃;进样体积:1 μL;供试品测定时,在2.5 min通过阀切换将流路切换到旁路,避免高浓度氯吡格雷进入质谱。
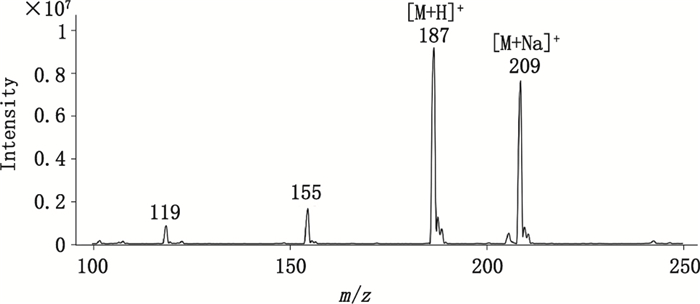
2.2 质谱条件根据对甲苯磺酸甲酯的化学性质,采用正离子检测模式。离子源参数为:干燥气温度:250 ℃,干燥气流速:11 L·min-1;雾化气流速:0.28 MPa;鞘气温度:350 ℃,鞘气流速:8 L·min-1;毛细管电压:4.0 kV;喷嘴电压:1.5 kV。一级质谱总离子流图(TIC)如图 1所示,离子m/z 187为[M+H]+,离子m/z 209为[M+Na]+。
|
图 1 对甲苯磺酸甲酯正离子模式下离子流图 Figure 1 The TIC chromatogram of methyl p-toluenesulfonate in the positive mode |
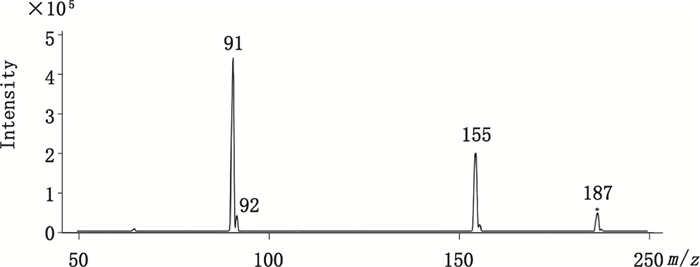
对甲苯磺酸甲酯正离子模式下二级质谱图见图 2,主要的碎片离子有m/z 155和m/z 91,其中m/z 155由磺酸酯键断裂产生,m/z 91是苄基正离子,均反映了对甲苯磺酸甲酯的结构特征。试验中对二级质谱碰撞能量进行了优化,对甲苯磺酸甲酯中2个离子对m/z 187→91和m/z 187→155的MRM参数见表 1,其中,离子对m/z 187→91的信噪比较离子对m/z 187→155更高,因此选择m/z 187→91作为定量离子对,m/z 187→155作为定性离子对。
|
图 2 对甲苯磺酸甲酯正离子模式下二级质谱图 Figure 2 The MS/MS chromatogram of methyl p-toluenesulfonate in the positive mode |
|
|
表 1 对甲苯磺酸甲酯MRM参数 Table 1 The MRM parameters of methyl p-toluenesulfonate |
精密称取对甲苯磺酸甲酯对照品适量,加稀释剂[水-甲醇(50:50)]溶解并稀释成1.0 µg·mL-1的对照品储备液。
2.4 供试品溶液分别精密称取硫酸氢氯吡格雷Ⅰ型和Ⅱ型晶型各3批,加稀释剂溶解并稀释成5 mg·mL-1的溶液。
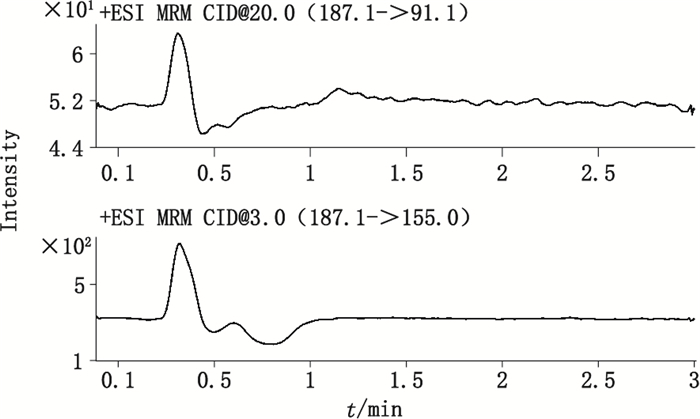
2.5 方法学考察 2.5.1 专属性试验取稀释剂照上述条件进行试验,记录色谱图,见图 3,结果显示稀释剂不干扰测定,表明该方法专属性良好。
|
图 3 稀释剂MRM质谱图 Figure 3 The MRM chromatogram of blank solvent |
精密量取对照品储备液适量,加稀释剂稀释得到浓度分别为1.0、5.0、10、25、50、100、200 ng·mL-1的对照品溶液,进样分析,绘制标准曲线,得线性方程:
| $ \mathit{Y}\rm{= 44}\rm{.43}\ \mathit{X}\rm{+33}\rm{.83}\ \ \ \ \mathit{r}\rm{=0}\rm{.999}\ \rm{9} $ |
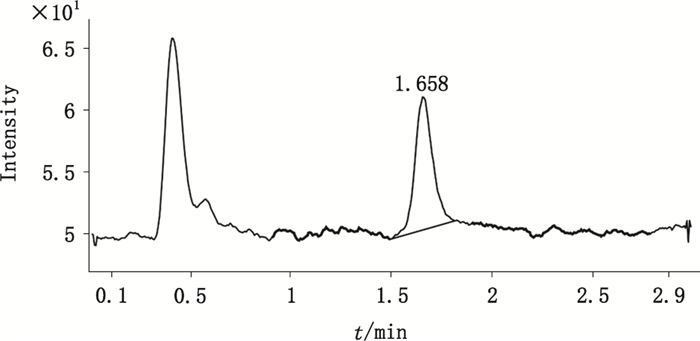
表明对甲苯磺酸甲酯在1.0 ~200 ng·mL-1浓度范围内线性关系良好,对甲苯磺酸甲酯定量限(LOQ)为1.0 ng·mL-1(S/N=9.3)(图 4)。根据上述标准曲线,基于响应值标准偏差和标准曲线斜率法计算对甲苯磺酸甲酯的检测限(LOD),为0.5 ng·mL-1(S/N=3)。
|
图 4 对甲苯磺酸甲酯定量限MRM质谱图 Figure 4 The LOQ chromatography of methyl p-toluenesulfonate |
取“2.5.2”项下25 ng·mL-1的对甲苯磺酸甲酯对照品溶液(自动进样器4 ℃控温),连续3 d每天进样6次进行分析,根据“2.5.2”项下线性方程计算,峰面积的RSD为1.1%,表明4 ℃条件下对照品溶液在48 h内稳定性良好。试验中还发现,对甲苯磺酸甲酯对照品溶液在室温下不稳定,24 h后降解约10%,因此试验中对照品溶液和供试品溶液应在4 ℃环境下保存。
2.5.4 加样回收率和精密度试验精密称取硫酸氢氯吡格雷Ⅰ型晶型(批号:A107139001)样品和Ⅱ型晶型(批号:A1131511001)样品各9份约100 mg,分别置20 mL量瓶中,精密加入“2.5.2”项下浓度为100 ng·mL-1的对甲苯磺酸甲酯对照品溶液4.0、5.0、6.0 mL,加稀释剂溶解并稀释至刻度,摇匀,即得低(20 ng·mL-1)、中(25 ng·mL-1)、高(30 ng mL-1)3个浓度的供试品溶液各3份,进样分析,根据“2.5.2”项下线性方程计算,Ⅰ型晶型和Ⅱ型晶型回收率结果见表 2,平均回收率分别为97.7%和97.9%,RSD分别为1.5%和1.5%,表明对甲苯磺酸甲酯回收率和精密度良好。
|
|
表 2 硫酸氢氯吡格雷2种晶型中对甲苯磺酸甲酯的回收率 Table 2 Recoveries of methyl p-toluenesulfonate in two kinds of crystal forms of clopidogrel hydrogen sulfate |
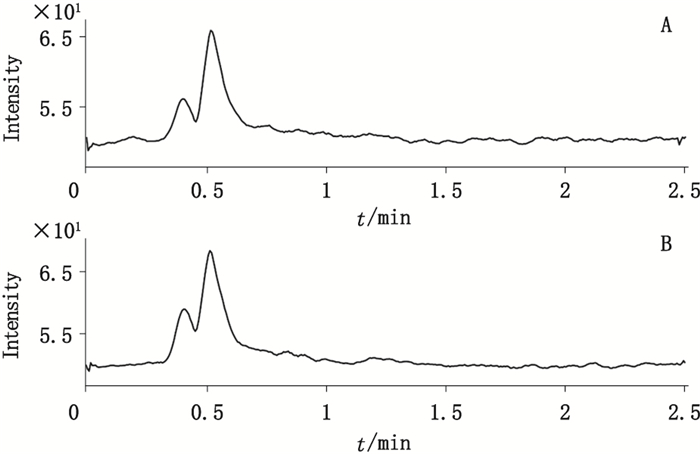
取硫酸氢氯吡格雷Ⅰ型晶型(批号:A1071309001,A1071310001,A1071310002)和Ⅱ型晶型(批号:A1131511001,A1131511002,A1131511003)供试品各3批,每批精密称取2份约125 mg,置25 mL量瓶中,加稀释剂溶解并稀释至刻度,摇匀,进样分析,结果6批样品中均未检出对甲苯磺酸甲酯(图 5),表明供试品溶液中对甲苯磺酸甲酯浓度均低于定量限。
|
图 5 Ⅰ型晶型供试品(批号:A1071309001)(A)和Ⅱ型晶型供试品(批号:A1131511001)(B)MRM质谱图 Figure 5 The typical MRM chromatograms of sample solutions of crystal form Ⅰ(batch:A1071309001)(A)and Ⅱ(batch:A1131511001)(B) |
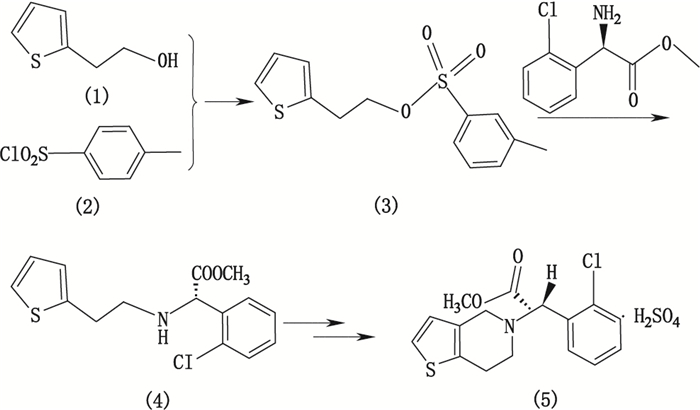
本试验中硫酸氢氯吡格雷原料药的合成工艺如图 6所示,2-噻吩乙醇(1)与对甲苯磺酰氯(2)反应生成中间体2-噻吩乙醇对甲苯磺酸甲酯(3),2-噻吩乙醇对甲苯磺酸甲酯与(+)邻氯苯甘氨酸甲酯反应生成中间体胺化物(4),胺化物再经成盐、环合反应、手性拆分等多步反应得到硫酸氢氯吡格雷(5)。其中,胺化物成盐反应中使用了溶剂甲醇,若与残留的对甲苯磺酰氯反应生成对甲苯磺酸甲酯。因此,必须对硫酸氢氯吡格雷原料药中的对甲苯磺酸甲酯进行控制。
|
图 6 硫酸氢氯吡格雷原料药的合成路线 Figure 6 The synthetic route of clopidogrel hydrogen sulfate |
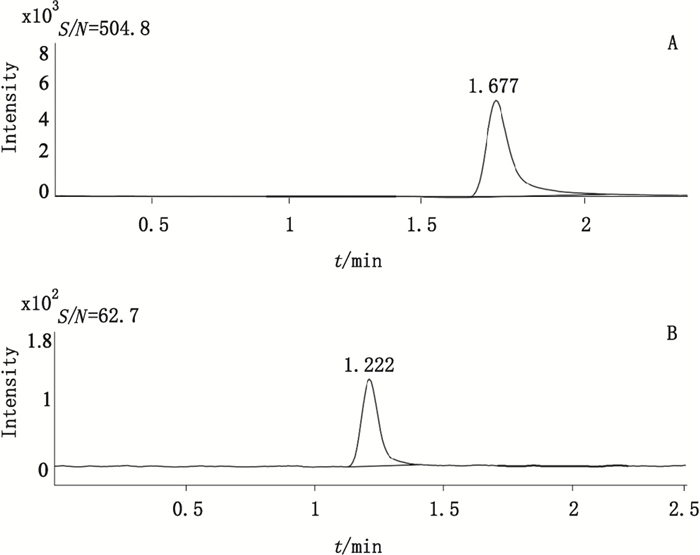
色谱条件优化试验中,探索了甲醇和乙腈2种有机相对分离度和灵敏度的影响。采用Agilent Zorbax Extend C18色谱柱,当0.1%甲酸水溶液-有机相(甲醇或乙腈)比例为55:45时,对甲苯磺酸甲酯与主成分氯吡格雷(保留时间约为5.0 min)分离度良好。试验发现,当采用甲醇做有机相时,离子对m/z 187→91和m/z 187→155的MRM信号响应更高,信噪比更大,见图 7,因此有机相采用含0.1%甲酸的甲醇溶液。
|
图 7 有机相使用甲醇(A)和乙腈(B)时,对甲苯磺酸甲酯MRM信号的信噪比 Figure 7 Comparison of MRM S/N intensity using methanol(A)and acetonitrile(B)as mobile phases |
试验发现,对甲苯磺酸甲酯在正离子模式下的离子强度大于负离子模式,因此选择正离子模式检测。质谱条件最优化试验中发现,质谱ESI离子源参数中干燥气温度、流速、雾化气流速、鞘气温度、流速、毛细管电压对化合物离子化效果影响较小,与离子传输效率相关的Ion Funnel参数对化合物离子化效果影响也较小,因此试验中均采用默认值。
本试验建立了超高效液相色谱-质谱联用法测定硫酸氢氯吡格雷原料药中的对甲苯磺酸甲酯,并进行了方法学验证,结果2种晶型各3批样品中均未检出对甲苯磺酸甲酯。可以有效控制硫酸氢氯吡格雷中的潜在基因毒性杂质对甲苯磺酸甲酯。该方法专属性强,灵敏度高,满足基因毒性杂质测定要求,可以作为硫酸氢氯吡格雷原料中对甲苯磺酸甲酯的质控方法。
| [1] |
LU J, WANG J, ROHANI S. Preparation and characterization of amorphous, Ⅰ andⅡ forms of clopidogrel hydrogen sulfate[J]. Cryst Res Technol, 2012, 47(5): 505. DOI:10.1002/crat.v47.5 |
| [2] |
梁美好, 沈正荣. (+)-氯吡格雷的合成工艺改进[J]. 中国药物化学杂志, 2007, 17(3): 163. LIANG MH, SHEN ZR. Improved synthesis of clopidogrel[J]. Chin J Med Chem, 2007, 17(3): 163. |
| [3] |
SZEKELY G, AMORES MC, GIL M, et al. Genotoxic impurities in pharmaceutical manufacturing:Sources, regulations, and mitigation[J]. Chem Rev, 2015, 115(16): 8182. DOI:10.1021/cr300095f |
| [4] |
EUROPEAN MEDICINES AGENCY.Guidelines on the limits of genotoxicimpurities[EB/OL].[2016-12-05].http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002903.pdf
|
| [5] |
US FOOD AND DRUG ADIMMINISTRATION.Guidance for industry.Genotoxic and carcinogenic impurities in drug substances and products:recommended approaches[EB/OL].[2016-12-05].http://www.fda.gov/OHRMS/DOCKETS/98fr/FDA-2008-D-0629-gdl.pdf
|
| [6] |
GUO T, SHI Y, ZHENG L, et al. Rapid and simultaneous determination of sulfonate ester genotoxic impurities in drug substance by liquid chromatography coupled to tandem mass spectrometry:Comparison of different ionization modes[J]. J Chromatogr A, 2014, 1355: 73. DOI:10.1016/j.chroma.2014.05.079 |
| [7] |
张云峰, 钱建钦, 王建. HPLC-MS/MS法分析氟胞嘧啶中痕量基因毒性杂质N, N-二甲基苯胺[J]. 药物分析杂志, 2017, 37(2): 265. ZHANG YF, QIAN JQ, WANG J. Determination of trace level of genotoxic impurity N, N-dimethylaniline in flucytosine by HPLC-MS/MS[J]. Chin J Pharm Anal, 2017, 37(2): 265. |
| [8] |
陈菁菁, 杨小玲, 李琴. UPLC-QTOF/MS法分析盐酸奈必洛尔中痕量遗传毒性杂质A和B[J]. 药物分析杂志, 2016, 36(11): 2035. CHEN JJ, YANG XL, LI Q. Trace determination of genotoxic impurities A and B in nebivolol hydrochloride by UPLC-QTOF/MS[J]. Chin J Pharm Anal, 2016, 36(11): 2035. |
| [9] |
沈雨婷, 马迅, 南楠. UPLC-MS/MS方法测定盐酸哌替啶原料及注射液中的神经毒性杂质1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶[J]. 药物分析杂志, 2016, 36(5): 911. SHEN YT, MA X, NAN N. Determination of neurotoxicity impurity MPTP in pethidine hydrochloride API and injection by UPLC-MS/MS[J]. Chin J Pharm Anal, 2016, 36(5): 911. |
| [10] |
钱建钦, 陈悦. 正负离子切换超高效液相色谱-质谱联用法同时测定达比加群酯中间体中的2个毒性杂质[J]. 中国药学杂志, 2016, 51(11): 930. QIAN JQ, CHEN Y. Simultaneous determination of two toxic impurities in the intermediate of dabigatranetexilate by UHPLC-MS with positive/negative ionization switching[J]. Chin Pharm J, 2016, 51(11): 930. |
| [11] |
白培锋, 李海霞, 郭文敏. LC-MS/MS法检测奥拉帕尼中的遗传毒性杂质[J]. 中国新药杂志, 2016, 25(8): 865. BAI PF, LI HX, GUO WM. High sensitive determination of the genotoxic impurities in olaparib by LC-MS/MS[J]. Chin J New Drugs, 2016, 25(8): 865. |
| [12] |
李海霞, 白培锋, 刘娜, 等. 卡非佐米中基因毒性杂质和吗啉乙酸的LC-MS/MS法测定[J]. 中国医药工业杂志, 2016, 47(11): 1308. LI HX, BAI PF, LIU N, et al. Determination of a genotoxic impurity and morpholin acetic acid in carfilzomib by LC-MS/MS[J]. Chin J Pharm, 2016, 47(11): 1308. |
| [13] |
周长朋, 王东武, 张曼玉, 等. 高效液相色谱-四极杆/线性离子阱质谱仪测定盐酸决奈达隆中两种基因毒性杂质的痕量残留[J]. 分析测试学报, 2016, 35(9): 1111. ZHOU CP, WANG DW, ZHANG MY, et al. Determination of two genotoxic impurities residues in dronedarone hydrochloride by HPLC-QTRAP-MS/MS[J]. J Instrm Anal, 2016, 35(9): 1111. |
| [14] |
王慧君, 潘红娟, 刘超, 等. 阿哌沙班中基因毒性杂质的LC-MS法测定[J]. 中国医药工业杂志, 2015, 46(9): 1004. WANG HJ, PAN HJ, LIU C, et al. Determination of the gnotoxic impurity in apixaban by LC-MS[J]. Chin J Pharm, 2015, 46(9): 1004. |
| [15] |
梁键谋, 傅聪, 陈悦, 等. LC-MS/MS测定草酸右旋西酞普兰中对甲苯磺酸酯类基因毒性杂质的含量[J]. 中国现代应用药学, 2016, 33(11): 1436. LIANG JM, FU C, CHEN Y. Determination of genotoxic impurities in escitalopram oxalate by LC-MS/MS[J]. Chin J Mod Appl Pharm, 2016, 33(11): 1436. |
| [16] |
张莉, 黄丽娜, 黎其荣, 等. HPLC-MS法分析甲苯磺酸拉帕替尼中痕量基因毒性杂质[J]. 药物分析杂志, 2015, 35(2): 317. ZHANG L, HUANG LN, LI QR, et al. Trace determination of genotoxic impurity in lapatinibditosylate by HPLC-MS[J]. Chin J Pharm Anal, 2015, 35(2): 317. |
| [17] |
冯慧敏, 杭太俊, 高新桃, 等. LC-MS法同时检测甲磺酸伊马替尼中3个磺酸酯基因毒杂质[J]. 药物分析杂志, 2014, 34(12): 2202. FENG HM, HANG TJ, GAO XT, et al. Determination of potential carcinogenic and genotoxic sulfonate impurities in imatinib mesylate by a highly sensitive liquid chromatography-mass spectrometry method[J]. Chin J Pharm Anal, 2014, 34(12): 2202. |
 2017, Vol. 37
2017, Vol. 37 
