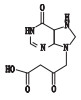
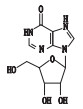
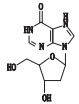
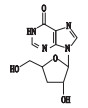
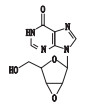
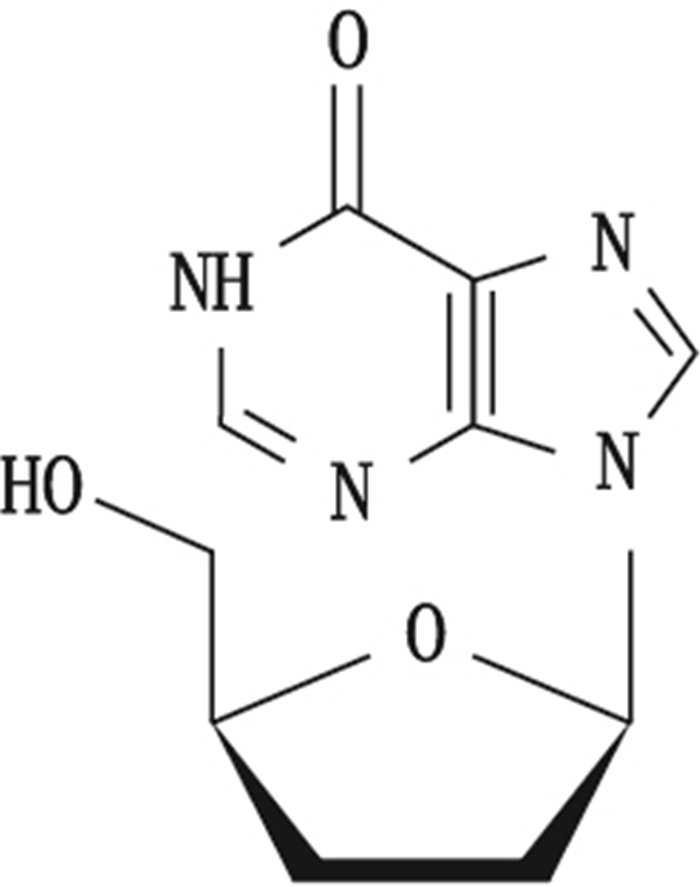
去羟肌苷(didanosine,2’,3’-双脱氧肌苷,见图 1)是一种嘌呤核苷类逆转录酶抑制剂,竞争性地抑制逆转录病毒对自然底物三磷酸双脱氧腺苷作用,中止DNA链的延长,从而阻碍HIV病毒的复制增殖。临床上主要用于治疗齐多夫定(AZT)不耐受、无效或无症状HIV感染的艾滋病患者[1-7]。合成工艺以肌苷为起始原料,经过溴化反应、消除反应、氢化反应得到去羟肌苷,其有关物质的分析鉴定研究尚未见报道。
|
图 1 去羟肌苷结构 Figure 1 Chemical structure of didanosine |
本文采用液相-质谱联用技术对其有关物质进行进行鉴定研究,并进行强制破坏试验。去羟肌苷在酸破坏条件下不稳定,主要破坏产物为次黄嘌呤,在碱、光照及高温条件下较为稳定[8-9],对原料中8个主要有关物质进行了结构鉴定[10-14],其中3个有关物质并未见报道,可为其质量控制提供参考依据。
1 仪器与试药Shimadzu LC2010液相色谱仪,LC Solution工作站;Agilent 1 260 Infinity液相色谱-6224飞行时间质谱仪,MassHunter工作站;ThermoFinnigan TSQ Quantum Ultra AM型LC-MS/MS联用仪;Xcalibur工作站。Sartorius BS21S电子天平。去羟肌苷对照品(批号:14703-200401,含量99.7%),次黄嘌呤(杂质A,批号:140661-200903,含量99.5%),肌苷(杂质B,批号:140669-201104,含量100%)均购自中国食品药品检定研究院;2’-去氧肌苷(杂质C,批号:D239755,含量98%),3’-去氧肌苷(杂质D,批号:D239760,含量98%),2’,3’-脱水肌苷(杂质E,批号:A648370,含量97%)均购自Toronto Research Chemicals公司;2’,3’-二去氧-2’,3’二去氢肌苷(杂质F,批号:RGT8936,含量99%)购自深圳市瑞吉特生物科技有限公司;系统适用性试验对照品(批号:69655-05-6,含去羟肌苷98.4%,杂质A 0.5%,杂质B 0.2%,杂质C 0.3%,杂质D 0.2%,杂质E 0.2%,杂质F 0.2%,USP对照品);去羟肌苷原料(批号:20121001、20121002、20121003)由河南天方药业股份有限公司提供;甲醇和乙腈为色谱纯,实验用水为超纯水。
2 方法与结果 2.1 色谱条件参照ChP2015选择如下色谱条件[12]。InertSurstain C18(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键含硅胶)色谱柱,以0.386%醋酸铵溶液加氨水调节pH至8.0为流动相A,以乙腈-甲醇(50:50)为流动相B,进行线性梯度洗脱(A-B)0 min(92:8)→15 min(92:8)→30 min(70:30)→45 min(70:30)→50 min(92:8)→60 min(92:8),检测波长254 nm,进样体积20 μL,柱温25 ℃。
2.2 质谱条件TOF/MS质谱条件:Dual ESI正离子扫描,雾化气压力350 kPa,温度350 ℃,干燥气流量10 L·min-1,毛细管电压4 kV,碎片电压100 V,参比离子m/z 121.050 8和922.009 7,质量数扫描范围m/z 100~1 200。
MS/MS质谱条件:喷雾电压5 kV,雾化气压310 kPa,辅助气压力35 kPa,毛细管温度350 ℃,二级质谱扫描碰撞氩气压力0.20 Pa,碰撞能量25 eV。
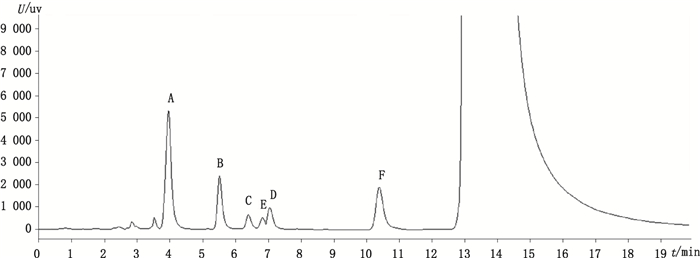
2.3 系统适用性试验精密称取系统适用性试验对照品适量,加稀释液(流动相A-B=90:10)溶解并定量稀释制成含去羟肌苷0.5 mg·mL-1的溶液,按‘2.1’色谱条件,精密量取20 μL注入液相色谱仪,记录色谱图,见图 2-a。
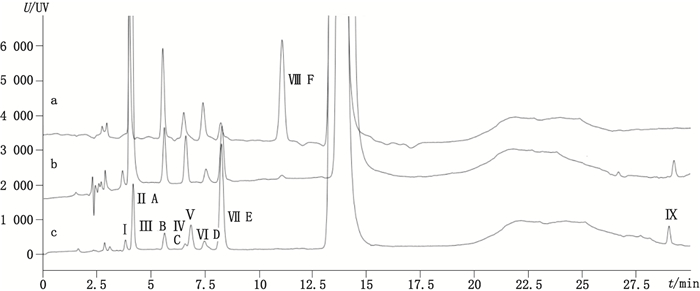
|
Ⅰ~Ⅶ.杂质峰编号(No.of impuritley peaks)A~F.杂质A-F(impurities A-F) 图 2 系统适用性(a)、酸破坏溶液(b)和原料(c)有关物质检查色谱图 Figure 2 Chromatograms for related substancesof system suitability solution(a), acid stress solution(b)and didanosine(c) |
测得理论板数按去羟肌苷峰计算为6 589,杂质C峰与杂质D峰间的分离度为3.8。
2.4 有关物质检查精密称取去羟肌苷原料25 mg,置50 mL量瓶中,用稀释液溶解并稀释至刻度,摇匀,作为供试品溶液。按照“2.1”项色谱条件进行试验HPLC-UV色谱图中共显示有8个主要有关物质峰(杂质编号为Ⅰ~Ⅷ),见图 2-c。由于去羟肌苷在强碱、高温、和光照条件下较稳定,在酸性条件下降解产物较多[5],酸破坏溶液色谱图,见图 2-b。结果显示去羟肌苷有关物质Ⅱ、Ⅲ、Ⅳ、Ⅷ可能为降解杂质,有关物质Ⅰ、Ⅴ、Ⅶ、Ⅸ可能由生产过程中代入。有关物质Ⅱ、Ⅲ、Ⅳ、Ⅵ、Ⅶ的液相色谱相对保留时间与USP系统适用性溶液中杂质A~E的相对保留时间一致,杂质F未检出,结果见表 1~2。
|
|
表 1 去羟肌苷有关物质的ESI-TOF/MS高分辨测定结果 Table 1 Accurate mass results of the relatedsubstances of didanosine by ESI high resolution TOF/MS |
|
|
表 2 去羟肌苷有关物质MS/MS二级碎片 Table 2 The MS/MS fragments of the related substances of didanosine |
按“2.1”、“2.2”项所述条件,对去羟肌苷有关物质进行ESI高分辨TOF/MS检测,测定各有关物质的精确离子质量,设置杂质组成为C、H、O、N并通过Mass Hunter软件匹配计算其离子式,质量偏差均小于3×10-6。
结果显示去羟肌苷有关物质Ⅱ、Ⅲ、Ⅳ、Ⅵ、Ⅶ的精密质量及相对保留时间与已知杂质A~E一致,结果见表 1。
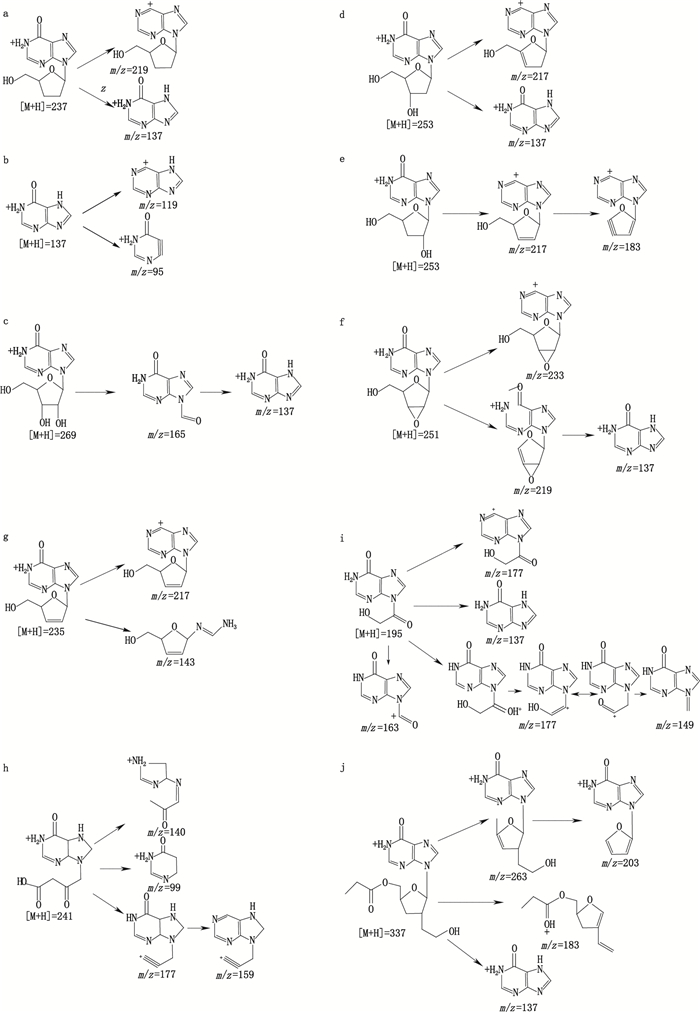
2.5.2 有关物质MS/MS结构鉴定按“2.2”所述质谱条件,测得去羟肌苷有关物质Ⅱ、Ⅲ、Ⅳ、Ⅵ、Ⅶ二级质谱碎片与杂质A~E的二级质谱碎片一致,结合相对保留时间和TOF/MS测定的结果,推测去羟肌苷原料中含有5个已知杂质和3个未知杂质,MS/MS主要碎片离子见表 2。3个未知杂质二级质谱图见图 3。去羟肌苷裂解途径见图 5-a,已知杂质A~F裂解途径见图 5-b~g。
|
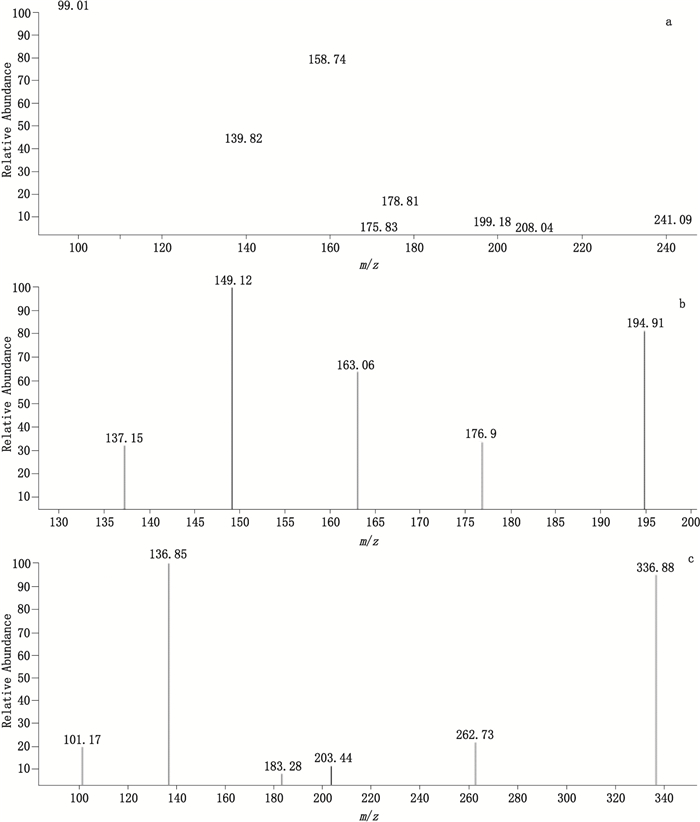
图 3 杂质Ⅰ(a)、Ⅴ(b)、Ⅸ(c)[M+H]+离子的二级质谱图 Figure 3 MS/MS spectra of [M+H]+ ions of impurity Ⅰ(a), impurity Ⅴ(b)and impurity Ⅸ(c) |
|
a.去羟肌苷(didanosine)b. Ⅱ(A)c. Ⅲ(B)d. Ⅳ(C)e. Ⅵ(D)f. Ⅶ(E)g. Ⅲ(F)h. Ⅰ i. Ⅴ j. Ⅸ[A~F.同图 4(same as |
有关物质Ⅰ为未知杂质,其准确分子量为240.088 1,通过TOF/MS得到的分子式为C9H12N4O4,主要特征碎片离子为m/z 177、m/z 159、m/z 140与m/z 99,见图 3-a。杂质可能是生产过程中带入,m/z 177为母离子脱去一分子H2O(18 amu)和1分子HCOOH(46 amu),m/z 159为m/z 177脱去一分子H2O(18 amu),m/z 140为母离子开环后脱去1分子HCOOH(46 amu)、一分子CO(28 amu)和一分子HCN(17 amu)得到,m/z 99为母离子开环后得到。有关物质Ⅱ可能为9-(2-氧基-丁酸)-1,4,5,7,8,9-六氢-嘌呤-6-酮,裂解途径见图 4-h。
|
A~F.杂质A~F(impurity A-F) 图 4 系统适用性溶液色谱图(EP9.0) Figure 4 HPLC chromatogram of system suitability solution |
有关物质Ⅴ为未知杂质,其准确分子量为194.043 5,通过TOF/MS的到的分子式为C7H6N4O3,主要特征碎片离子为m/z 177、m/z 163、m/z 149与m/z 137,见图 4-b。m/z 177为母离子脱去一分子H2O(18 amu),m/z 149为m/z 177脱去一分子CO(28 amu),m/z 163为母离子脱去一分子CH3OH(32 amu),m/z 137说明母离子与次黄嘌呤有相同的结构。有关物质Ⅴ可能为9-(2-羟基-乙酰基)-1,9-双氢-嘌呤-6-酮,裂解途径见图 4。
有关物质Ⅸ为未知杂质,其准确分子量为336.144 2,通过TOF/MS的到的分子式为C15H20N4O5,主要特征碎片离子为m/z 263、m/z 203、m/z 183、m/z 137与m/z 101,见图 3-c。m/z 263为母离子脱去一分子CH3CH2COOH(74 amu),m/z 203为母离子脱去CH3CH2OH(46 amu)和一分子CH3CH2COOCH3(88 amu),m/z 183为母离子脱去一分子H2O(18)及次黄嘌呤(136 amu),m/z 137说明母离子与次黄嘌呤有相同的结构,通过去羟肌苷原料的合成路线,与碎片离子的质荷比,有关物质物质Ⅸ的可能为9-(3-乙氧基-4-丙酸甲酯-四氢呋喃)-1,9-双氢-6H-嘌呤-6-酮,裂解途径见图 5。
3 讨论按照EP 9.0中去羟肌苷原料有关物质检查色谱条件[15],采用不同厂家的3根色谱柱进行测定,杂质C、D、E之间的分离较差,杂质D与E的相对保留时间分别为0.52和0.50(EP9.0正文中规定杂质D与E的相对保留时间为0.48、0.5),出峰顺序与正文描述的相反,见图 4,并通过LC-TOF/MS对结果进行了确认。采用液相色谱-质谱连用技术对去羟肌苷原料中3个未知杂质的结构鉴定,可以为其质量控制提供参考依据。
| [1] |
赵红卫, 秦玉花, 张伟, 等. 进口去羟肌苷肠溶胶囊在中国健康男青年体内药物动力学研究[J]. 中华实用诊断与治疗杂志, 2010, 24(1): 16. ZHAO HW, QIN YH, ZHANG W, et al. Pharmacokinetics of imported didanosine enteric capsules in healthy Chinese young men[J]. J Chin Pract Diagn Ther, 2010, 24(1): 16. |
| [2] |
徐先彬, 李扬, 刘蕾, 等. RP-HPLC法测定人血浆中去羟肌苷的浓度[J]. 药物分析杂志, 2006, 26(4): 491. XU XB, LI Y, LIU L, et al. RP-HPLC determination of didanosine concentration in human plasma[J]. Chin J Pharm Anal, 2006, 26(4): 491. |
| [3] |
卢云雯, 陈芬儿. 去羟肌苷的化学合成路线图解[J]. 中国医药工业杂志, 2002, 33(6): 310. LU YW, CHEN FE. Graphical synthetic routes of dideoxyinosine[J]. Chin J Pharm, 2002, 33(6): 310. |
| [4] |
杨蓓, 郁颖佳, 陶芸莺, 等. 国产去羟肌苷散剂与进口去羟肌苷片剂的人体生物等效性[J]. 中国新药与临床杂志, 2005, 24(9): 701. YANG B, YU YJ, TAO YY, et al. Bioequivalence of domestic didanosine powders and imported didanosine tablets in human[J]. Chin J New Drugs Clin Rem, 2005, 24(9): 701. |
| [5] |
靳凤丹, 陈笑艳, 于河舟, 等. 血浆中去羟肌苷测定与制剂生物等效性评价[J]. 中国药学杂志, 2006, 41(13): 1016. JIN FD, CHEN XY, YU HZ, et al. Determination of didanosine in human plasma and its application to a bioequivalence study[J]. China Pharm J, 2006, 41(13): 1016. DOI:10.3321/j.issn:1001-2494.2006.13.017 |
| [6] |
官常荣, 何平, 徐戎, 等. 国产与进口去羟肌苷分散片在健康人体的生物等效性[J]. 中国临床药理学杂志, 2007, 23(5): 336. GUAN CR, HE P, XU R, et al. Bioequivalence of domestic and imported didanosine dispersing tablets in healthy volunteer[J]. Chin J Clin Pharmacol, 2007, 23(5): 336. |
| [7] |
PERRY CM, NOBLE S. Didanosine:An updated review of its use in HIV[J]. Drugs, 1999, 58(6): 1099. DOI:10.2165/00003495-199958060-00009 |
| [8] |
连莹, 仲平. 容量滴定法测定去羟肌苷含量的分析方法与认可[J]. 药物分析杂志, 2015, 35(6): 1110. LIAN Y, ZHONG P. Methodological verification and approval of the volumetric titration determination of didanosine[J]. Chin J Pharm Anal, 2015, 35(6): 1110. |
| [9] |
杜明荦, 张军霞, 秦志国, 等. RP-HPLC法测定去羟肌苷肠溶胶囊有关物质及含量[J]. 药物分析杂志, 2016, 36(2): 182. DU ML, ZHANG JX, QIN ZG, et al. RP-HPLC Determination of related substances and assay in didanosine enteric-coated capsules[J]. Chin J Pharm Anal, 2016, 36(2): 182. |
| [10] |
DE OLIVEIRA AM, LÖWEN TC, CABRALM LM, et al. Development and validation of a HPLC-UV method for the determination in didanosine tablets[J]. J Pharm Biomed Anal, 2005, 38: 751. DOI:10.1016/j.jpba.2005.02.004 |
| [11] |
刘蕾, 徐先彬, 李杨, 等. HPLC-MS/MS同时测定人血浆中4种抗HIV感染药物的浓度[J]. 药物分析杂志, 2007, 27(5): 681. LIU L, XU XB, L Y, et al. HPLC-MS/MS simultaneous determination of four anti-HIV drugs in human plasma[J]. Chin J Pharm Anal, 2007, 27(5): 681. |
| [12] |
中国药典2015年版. 二部[S]. 2015: 114 ChP2015.Volume Ⅱ[S].2015:114 |
| [13] |
MALLAMPATI S, LEONARD S, DE VULDER S, et al. Method development and validation for the analysis of didanosine using micellar electrokinetic capillary chromatography[J]. Electrophoresis, 2005, 26(21): 4097. |
| [14] |
SANGSHETTIJAIPRAKASH N., KULKARNI PARAG A, SHINDEDEVANAND B. Spectrophotometric determination of didanosine in bulk and tablet formulation[J]. Trends Applied Sci Res, 2007, 2(1): 71. DOI:10.3923/tasr.2007.71.75 |
| [15] |
EP9.0[S].2016:2250
|
 2017, Vol. 37
2017, Vol. 37