2. 常州方圆制药有限公司, 常州 213022
2. Changzhou Fangyuan Pharmaceutical Co., Ltd., Changzhou 213022, China
杂质控制是药品质量控制的关键,目前人用药品注册技术要求国际协调会(ICH)及各国发布的药物杂质研究指导原则中都明确要求对表观含量在0.1%及其以上的杂质必须予以鉴定[1-2]。氨基糖苷类抗生素作为目前应用最为广泛的一类广谱抗菌抗生素[3],面临的安全性问题尤为突出。由于氨基糖苷类抗生素多为发酵或半合成抗生素,其杂质种类繁多且结构类似,故需对其中的有关杂质进行严格控制[4-5],以保证用药的安全和高效[6]。但实际上因条件的限制,发酵或半合成抗生素中的共存大量杂质,难以完全分离和定性。
依替米星又名爱大霉素(etimicin,ETM,抗生素89-07),是一种新的半合成水溶性氨基糖苷类抗生素[7],具有抗菌谱宽、抗菌活性强和毒性低等优点,如对大肠埃希杆菌、克雷伯氏肺炎轩菌、肠杆菌属等具有较高的抗菌活性[8-9],具有十分广阔的市场前景。ETM由庆大霉素C1a(GMC1a)通过化学合成、分离纯化获得,而GMC1a是由小单孢菌发酵而来[10],故其原料GMC1a中含有大量其他庆大霉素组分[11],且化学合成中易产生副产物,导致依替米星产品中杂质种类繁多,且结构类似,很难通过简单的分离纯化手段获得高纯度的杂质并鉴定结构。现有方法主要是采用大孔吸附树脂或大孔弱酸性离子交换树脂分离纯化ETM,进而采用液相色谱-质谱联用推测杂质的结构[12],但是,这些方法大多很难拿到纯品,因而不能对杂质进行精确的结构分析和药理作用测试。此外,Yuan、Wang、Wu等[13-15]通过LC/ESI-MSn、LC-PED以及NMR技术对ETM中的相关杂质进行了分离纯化和结构鉴定,但鉴定出的杂质的种类仍非常有限[16-17]。此外,如图 1所示,氨基糖苷类抗生素在其生产过程中,环上5个氨基位点均可与试剂作用得到具有不同生理活性的类似结构,因此迫切需要建立一种快速、准确地分析和鉴定该类化合物结构的方法。本文通过HPLC-ELSD分析和制备HPLC分离方法的联用,制备出4种高纯度的杂质(X1~X4),并进一步综合运用多种NMR技术对ETM及其杂质的结构进行了对比研究,在此基础之上建立了一种快速鉴定氨基糖苷类抗生素结构的分析方法。
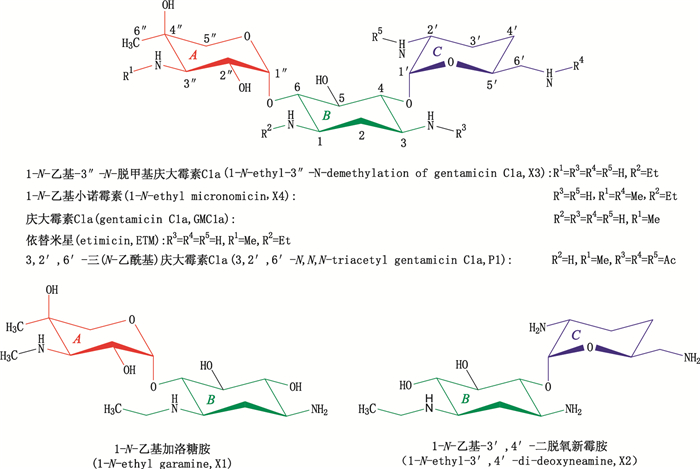
|
图 1 氨基糖苷类抗生素及杂质的结构 Figure 1 Structures of aminoglycoside antibiotics and impurities |
Agilent 1260高效液相色谱仪(美国Agilent公司),Alltech 3300 ELSD蒸发光散射检测器(美国格雷斯公司),岛津LCMS-2020型液质联用仪(日本Shimadzu公司),Bruker AvanceⅢ 300 MHz全数字化核磁共振谱仪;分析用电子天平(Mettler Toledo XS205),感量0.01 mg。
1.2 样品与试剂依替米星(ETM)样品、对照品庆大霉素C1a(GMC1a)(纯度99.5%)和3,2’,6’-三(N-乙酰基)庆大霉素Cla(P1)(纯度99.7%)由常州方圆制药有限公司提供(批号:ETM-160415);甲醇和三氟醋酸为色谱级;氘水(青岛腾龙),99.9%氘代。
1.3 HPLC-ELSD分析采用Ultimate LP-C18色谱柱(美国Welch公司)(填料:十八烷基硅烷键合硅胶;250 mm × 4.6 mm,5 μm),以0.2 mol·L-1三氟乙酸溶液-甲醇(84:16)为流动相,流速0.5 mL·min-1;进样量20 μL,柱温为40 ℃,漂移管温度为65 ℃,载气流量为1.8 L·min-1,增益为1。
1.4 HPLC制备分离采用Ultimate LP-C18色谱柱(填料:十八烷基硅烷键合硅胶;250 mm ×21.2 mm,5 μm),以0.2 mol·L-1三氟乙酸水溶液-甲醇(86:14)为流动相,流速6 mL·min-1;进样量2 000 μL,ELSD为检测器。在色谱柱与检测器之间连接1个分流装置,按照5:1分流比使少量流出液进入检测器,其余流出液被收集合并,55 ℃旋转蒸发除去溶剂后冷冻干燥。
1.5 MS分析以甲醇-水(80:20)为流动相,流速0.8 mL·min-1;MS参数:雾化速度1.5 L·min-1,气体流速1.5 L·min-1,毛细管电压1.3 kV,锥孔电压30 V,DL温度250 ℃,采用ESI正离子一级全扫描检测。
1.6 NMR分析取20 mg样品用0.5 mL D2O溶解,转移到核磁管中,实验条件采用:以四甲基硅烷为内标;1H-NMR的时域64 K,谱宽20 ppm,弛豫时间1 s,累计采样16次;13C-NMR的时域64 K,谱宽238 ppm,弛豫时间2 s,累计采样1 024次;1D谱的采样数据点阵为2 048×256,零填充后FT变为点阵为2 048×512;2D谱均采用标准脉冲程序。
2 结果与讨论 2.1 依替米星中杂质的分析和分离制备参照2015年版中国药典中依替米星组分的分析方法[18],用HPLC-ELSD法对实际生产中的ETM样品进行分析。如图 2所示,发现4个目标杂质(X1~X4)的含量均不超过0.03%(表 1),且该色谱条件下ETM与其他杂质具有很好的分离度。首先,通过与对照品庆大霉素C1a(GMC1a)和3,2’,6’-三(N-乙酰基)庆大霉素Cla(P1)品的HPLC-ELSD对照分析,确证图 2中12.251 min和36.604 min吸收峰分别为GMC1a和P1;然后,通过HPLC制备分离制备各杂质,结果成功得到4个纯的杂质样品(X1~X4,纯度>98%);最后,分别对ETM和杂质X1~X4进行MS分析(表 1),为进一步比对分析和确证杂质的结构提供数据支撑。
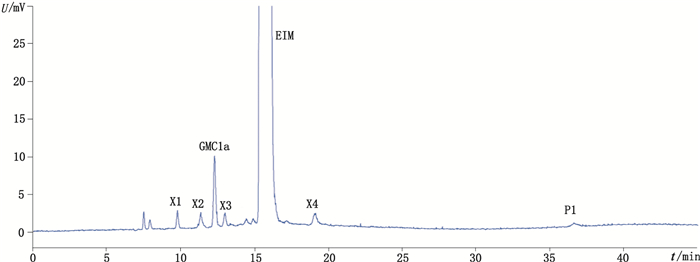
|
图 2 依替米星的色谱图 Figure 2 Chromatogram of ETM |
|
|
表 1 依替米星及杂质的含量和质谱数据 Table 1 Contents and mass spectrometry data of ETM and impurities |
ETM的核磁共振数据见表 2。
|
|
表 2 依替米星的核磁共振数据(D2O) Table 2 NMR data of ETM(D2O) |
首先,对ETM的常规1D-NMR谱(1H-NMR、13C-NMR和DEPT)进行解析,可以确定其化学结构中的特征位点。1H-NMR谱中低场位置处的两组双峰δ5.85(1H,d,J=3.4 Hz)和δ5.10(1H,d,J=3.8 Hz)为异头碳上的质子(H1′和H1″);13C-NMR谱中低场位置处的2个单峰(δ93.9和δ101.3)为异头碳(C1′和C1″);由DEPT谱可知,δ69.7为ETM中的唯一的季碳(C4″),δ67.6为仲碳中化学位移最大的连氧仲碳(C5″)。
然后,对ETM的HSQC数据和2D-NMR谱(1H-1H COSY和HMBC,图 3)进行综合分析,可以逐步实现结构中所有C、H的精确归属。①由HSQC谱可确定δ3.98(1 H,d,J=12.9 Hz)和δ3.48(1 H,d,J=10.8 Hz)为连氧仲碳上的质子(H5″)。② HMBC显示δ101.3异头碳与H5″具有远程相关关系,可确定δ101.3为A环上的异头碳(C1″),那么δ93.9则为C环上的异头碳(C1′)。③进一步结合数据,可确定δ5.85为C环端基质子(H1″),δ5.10为A环端基质子(H1′)。④由1H-1H COSY谱可知,δ4.23质子与H1″偶合,可确定为H2″,同时H2″与δ3.47质子偶合,可确定为H3″;δ3.51质子与H1′偶合,可确定为H2′,同时H2′与δ2.02质子偶合,可确定为H3′。⑤由HMBC谱可知,δ75.6叔碳与δ5.85(H1′)具有远程相关关系,可推断为B环C4位碳;同样,δ83.2叔碳与δ5.10(H1″)具有远程相关关系,可推断为B环C6位碳。⑥采用排除法,可快速归属出取代基和3个环上剩余的C和H。
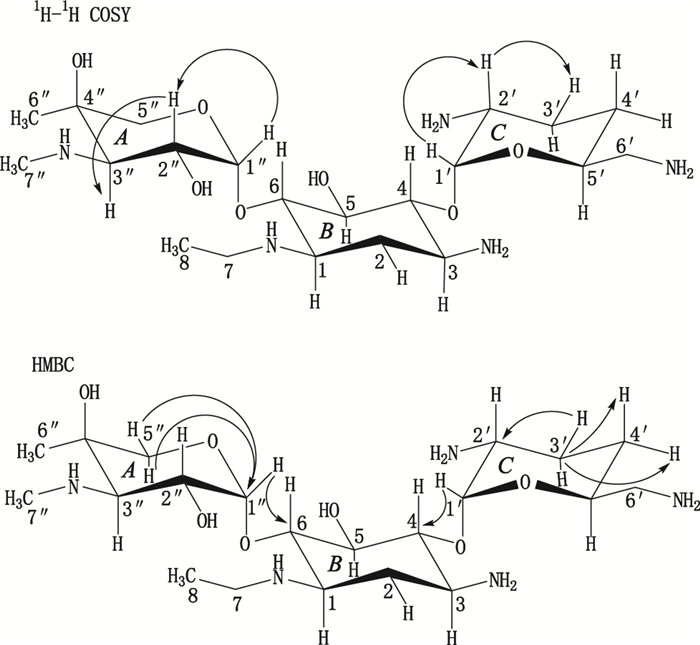
|
图 3 ETM的NMR谱相关分析 Figure 3 Correlation analysis of NMR spectra of ETM |
以ETM结构为模板,对比分析制备分离出的杂质X1~X4的MS数据及13C-NMR和1H-NMR谱图的变化,详细分析环和取代基对结构变化的影响,可以快速鉴定它们的结构。
2.3.1 环对结构的影响| $ \rm{X1}\xleftarrow[-\mathit{C}]{\rm{-}128\ \rm{Da}}\rm{ETM}\xrightarrow[-\mathit{A}]{-159\ \rm{Da}}\rm{X2} $ |
对比MS数据(表 1),杂质X1、X2与ETM的m/z之差分别为128 Da和159 Da,正好是分别去掉1个C环和A环后的物质。
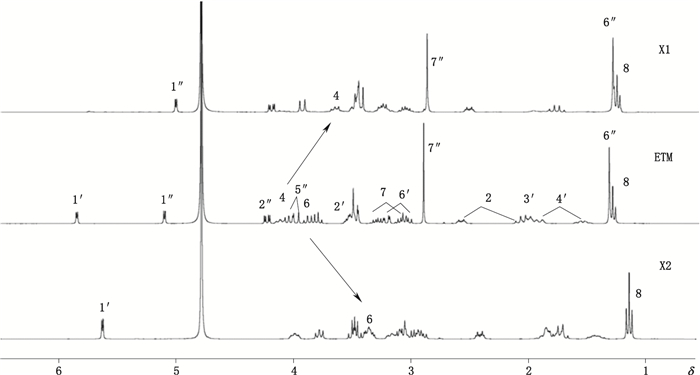
对比X1和ETM的13C-NMR谱(图 4),X1中明显少1个C环(蓝色),且只有4-C位处的位移向高场发生了移动,这是由于与4-C位处相连的糖苷键的断裂,使得4-C位处的电子云密度增大,故可初步推断X1是1-N-乙基-加洛糖胺;对比X1和ETM的1H-NMR谱(图 5),X1中无C环(ETM)所有质子信号,且与4-C位处相连的质子的化学位移由低场(δ4.04,ETM)移向高场(δ3.41,X1),说明此处的糖苷键断裂;进一步证明了X1的结构为1-N-乙基加洛糖胺。
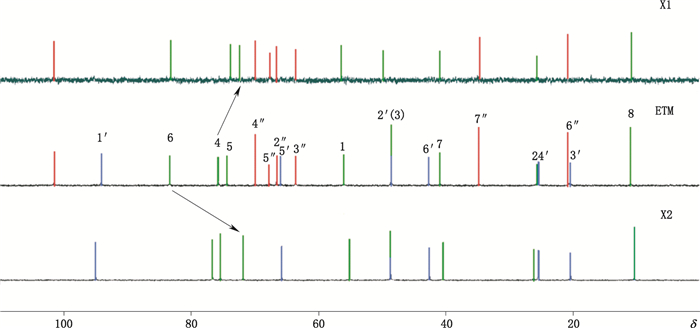
|
图 4 X1、X2和ETM的13C-NMR谱对比图 Figure 4 Comparison of X1, X2 and ETM by 13C-NMR spectra |
|
图 5 X1、X2和ETM的1H-NMR谱对比图 Figure 5 Comparison of X1, X2 and ETM by 1H-NMR spectra |
对比X2和ETM的13C-NMR谱(图 4),X2中明显少1个A环(红色),且只有6-C位处的位移向高场发生了移动,这是由于6-C位处相连的糖苷键的断裂,增加了6-C位处的电子云密度,故可初步推断X2的结构为1-N-乙基-3′,4′-二-脱氧新霉胺;对比X1和ETM的1H-NMR谱(图 5),X2中无A环(ETM)所有质子信号,且与6-C位处相连的质子的化学位移由低场(δ3.88,ETM)移向高场(δ3.47,X2),说明此处的糖苷键断裂,进一步证明了X2的结构为1-N-乙基-3′,4′-二脱氧新霉胺。
2.3.2 取代基团对结构的影响| $ \rm{X3}\xleftarrow[-\rm{C}{{\rm{H}}_{\rm{3}}}, \rm{+H}]{\rm{-}14\ \rm{Da}}\rm{ETM}\xrightarrow[\rm{-H, CH}_{\rm{3}}]{+14\ \rm{Da}}\rm{X4} $ |
对比MS数据(表 1),发现杂质X3和X4与ETM的m/z之差为14 Da,正好是去掉和加上1个甲基后的结构。
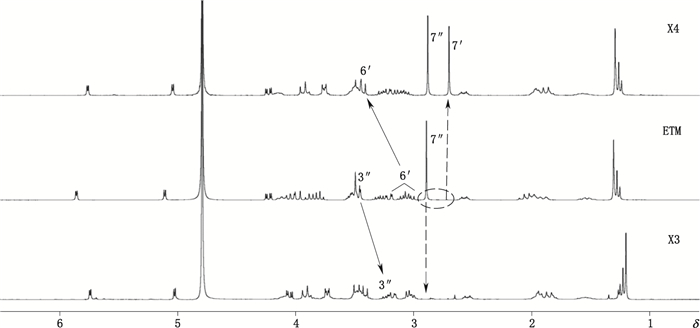
对比X3和ETM的13C-NMR谱(图 6),X3中的7″-C处未出峰,同时3″-C峰向高场发生了较大的移动,可推断是由于3″-N位去掉了甲基,增大了3″-C的电子云密度所致,由此可初步确定杂质X3的结构为3″-N-脱甲基依替米星;对比X3与ETM的1H-NMR谱(图 7),发现7″-甲基上质子(H7″)吸收峰(δ2.89,ETM)消失,且与N相连的3″-C上的H3″化学位移由低场(δ3.47,ETM)移到高场(δ3.32,X3),进一步说明3″-N位去掉了甲基,确证X3的结构为1-N-乙基-3″-N-脱甲基庆大霉素C1a。

|
图 6 X3、X4和ETM的13C-NMR谱对比图 Figure 6 Comparison of X3, X4 and ETM by 13C-NMR spectra |
|
图 7 X3、X4和ETM的1H-NMR谱对比图 Figure 7 Comparison of X3, X4 and ETM by 1H-NMR spectra |
最后,对比X4和ETM的13C-NMR谱(图 6):X4中明显多出1个碳,同时发现6′-C处的峰向低场发生了较大地移动,可推断是由于6′-N位增加了1个甲基,降低了6′-C的电子云密度所致,故可初步确定杂质X4的结构为1-N-乙基小诺霉素。对比杂质X4与ETM的1H-NMR谱(图 7),发现δ2.70处增加了1个甲基质子(H7′)的吸收峰,且与N相连的6′-C位上H6′的化学位移由高场(δ3.21,ETM)移到低场(δ3.49,X4),进一步证明6′-N位增加了1个甲基,确定X4的结构为1-N-乙基小诺霉素。
3 结论本文采用HPLC-ELSD法分析了依替米星样品中各组分的构成及液相分布,并进一步运用HPLC制备分离纯化出4种含量均不超过0.03%的杂质。综合运用各种NMR波谱技术,对ETM进行了碳氢化学位移的精确归属,在此基础之上,对比分析杂质和ETM的MS、1H-NMR和13C-NMR,快速鉴定了4种杂质的结构。杂质X1、X2与ETM对比,分别去掉一个C环和A环,1H-NMR和13C-NMR中均无相应的碳氢信号,且与糖苷键断裂位置相邻的碳氢化学位移均向高场发生了明显的移动,从而确定它们的结构分别为1-N-乙基加洛糖胺和1-N-乙基-3′,4′-二脱氧新霉胺;杂质X3、X4与ETM对比,正好是去掉和加上1个甲基,1H-NMR和13C-NMR中消失和增加了相应的甲基的碳氢信号,且与甲基相邻的碳氢化学位移分别向高场和低场发生了明显的移动,从而确定它们的结构分别为1-N-乙基-3″-N-脱甲基庆大霉素C1a和1-N-乙基小诺霉素。该研究一方面丰富了依替米星的杂质库,另一方面建立了一种快速鉴定氨基糖苷类抗生素及其杂质结构的分析方法,为药品的质量控制提供了参考依据和数据支撑。
| [1] |
US Food and Drug Administration.Guidance for Industry, ANDA Submissions-Refuse to Receive for Lack of Justification of Impurity Limits[EB/OL].(2016)[2016-12-7].http://101.96.10.70/www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm414598.pdf.
|
| [2] |
US Food and Drug Administration.Guidance for Industry, ANDAs:Impurities in Drug Products[EB/OL].(2010)[2016-12-7].http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm072861.pdf.
|
| [3] |
YUAN YZ, ZHANG M, FAN XL, et al. Impurity profiling of etimicin sulfate by liquid chromatography ion-trap mass spectrometry[J]. J Pharm Biomed, 2012, 70: 212. DOI:10.1016/j.jpba.2012.06.041 |
| [4] |
ÖZCAN K, AKSOY SÇ, KALKAN O, et al. Diversity and antibiotic-producing potential of cultivable marine-derived actinomycetes from coastal sediments of Turkey[J]. J Soil Sediment, 2013, 13(8): 1493. DOI:10.1007/s11368-013-0734-y |
| [5] |
BECKER B, COOPER MA. Aminoglycoside antibiotics in the 21st century[J]. ACS Chem Biol, 2013, 8(1): 105. DOI:10.1021/cb3005116 |
| [6] |
胡昌勤. 化学药品杂质谱控制的现状与展望[J]. 中国新药杂志, 2015, 24(15): 1727. HU CQ. Current situation and the trend in impurity profiling of chemical drugs[J]. Chin J New Drug, 2015, 24(15): 1727. |
| [7] |
范瑾, 赵敏, 刘军, 等. 半合成新抗生素-抗生素89-07的合成和结构测定[J]. 中国抗生素杂志, 1995, 20(6): 401. FAN J, ZHAO M, LIU J, et al. Synthesis and structure determination of semisynthetic antibiotic 89-07[J]. Chin J Antibiot, 1995, 20(6): 401. |
| [8] |
傅得兴, 李树芬, 张兵. 硫酸依替米星的药理及临床[J]. 中国新药杂志, 2000, 9(8): 524. FU DX, LI SF, ZHANG B. Pharmacology and clinic of etimicin sulfate[J]. Chin J New Drug, 2000, 9(8): 524. |
| [9] |
施宁华, 缪亦安, 张志坚, 等. 依替米星的耳毒性试验Ⅲ.依替米星与庆大霉素、阿米卡星对前庭功能影响的比较[J]. 中国抗生素杂志, 1999, 24(6): 445. SHI NH, MIU YA, ZHANG ZJ, et al. Ototoxicity of etimicinⅢ.Comparison in ototoxicity of vestibular function from etimicin with gentamicin and amikacin[J]. Chin J Antibiot, 1999, 24(6): 445. |
| [10] |
AL-MAJDOUB ZM, OWOSENI A, GASKELL SJ, et al. Effects of gentamicin on the proteomes of aerobic and oxygen-limited Escherichia coli[J]. J Med Chem, 2013, 56(7): 2904. DOI:10.1021/jm301858u |
| [11] |
杨利红, 李进, 胡昌勤. HPLC-ELSD法分析庆大霉素中小组分杂质[J]. 药物分析杂志, 2014, 34(1): 75. YANG LH, LI J, HU CQ. Determination of minor component impurities in gentamicin by HPLC-ELSD[J]. Chin J Pharm Anal, 2014, 34(1): 75. |
| [12] |
陈舟舟, 封成军, 林惠敏, 等. 硫酸依替米星的分离纯化工艺研究[J]. 中国抗生素杂志, 2013, 38(10): 744. CHEN ZZ, FENG CJ, LIN HM, et al. Studies on separation and purification of etimicin sulfate[J]. Chin J Antibiot, 2013, 38(10): 744. DOI:10.3969/j.issn.1001-8689.2013.10.006 |
| [13] |
袁耀佐, 张玫, 钱文, 等. 高效液相色谱-电喷雾-离子阱质谱法推定硫酸依替米星中有关物质的结构[J]. 分析化学, 2010, 38(6): 817. YUAN YZ, ZHANG M, QIAN W, et al. Characterization of related substances in etimicin sulfate sample by high performance liquid chromatography-electrospray ionization-Ion trap-mass spectrometry[J]. Chin J Anal Chem, 2010, 38(6): 817. |
| [14] |
WANG H, ZHANG ZJ, XIONG F, et al. Isolation and structure characterization of related impurities in etimicin sulfate by LC/ESI-MSn and NMR[J]. J Pharm Biomed, 2011, 55: 902. DOI:10.1016/j.jpba.2011.03.005 |
| [15] |
WU YN, ZHAO W, ZHU XY, et al. Improved liquid chromatography combined with pulsed electrochemical detection for the analysis of etimicin sulfate[J]. J Sep Sci, 2016, 39: 1471. DOI:10.1002/jssc.v39.8 |
| [16] |
周晓溪, 郭景文, 郑台, 等. 国产注射用氨苄西林钠杂质谱与其生产工艺的相关性研究[J]. 药物分析杂志, 2013, 33(3): 486. ZHOU XX, GUO JW, ZHENG T, et al. Correlation study between production process and impurity profile of domestic ampicillin sodium for injection[J]. Chin J Pharm Anal, 2013, 33(3): 486. |
| [17] |
张斗胜, 王悦雯, 李进, 等. 国产注射用阿奇霉素杂质谱及其与成盐工艺相关性的考察[J]. 药物分析杂志, 2011, 31(8): 1521. ZHANG DS, WANG YW, LI J, et al. The investigation between impurity profile of domestic azithromycin for injection and correlation of its salifiable craft[J]. Chin J Pharm Anal, 2011, 31(8): 1521. |
| [18] |
中国药典2015年版. 一部[S]. 2015: 1343 ChP 2015.Vol Ⅰ[S]. 2015:1343 |
 2017, Vol. 37
2017, Vol. 37 
