壳寡糖是壳聚糖经水解生成的一类低聚物,由2~10个氨基葡萄糖通过B-1,4-糖苷键连接而成的寡聚糖,也是天然糖中唯一大量存在的碱性氨基寡糖[1-2]。其具有水溶性好、安全无毒、易吸收等优点,在保健品、营养剂、食品添加剂、植物生长调节剂及饲料添加剂等方面具有良好的应用价值[2]。因具有较高的溶解度,很容易被吸收利用,特别是分子量低于10 000的壳寡糖更展现出独特的生理活性和功能性质[3]。作为一类新的生理活性物质,寡糖具有抑制病毒、细菌、真菌作用,同时对肿瘤细胞也有抑制作用[4-6],因此在植物生长调节及抗病、畜牧养殖等方面的应用具有极大的潜力[7-9],功能性寡糖的开发已经发展成为一个涉及医学、化学、工程等科学,应用于食品、医药、饲料、农业各领域的重要产业[10]。
目前壳寡糖检测方法一般采用化学试剂法,该方法成本低、易操作,但是灵敏度低,无法确定具体聚合度的壳寡糖含量[11-12]。也有采用高效液相色谱法[13]、毛细管电泳法[14-15]等,这些方法各有长处,但其分析成本高,步骤相对繁琐。而离子色谱法是报道的检测糖类最好的方法[16],因此,探索离子色谱测壳寡糖的实验条件,以寻找快速,精密度高度、重复性好的检测方法,可为实际生产壳寡糖质量控制奠定基础。
1 仪器、样品与试剂 1.1 仪器ICS-5000型离子色谱仪配电化学检测器(美国戴安),分析柱系统为CarboPac PA10碳水化合物分析柱(4 mm×50 mm)(美国戴安),保护柱系统为CarboPac PA10碳水化合物分析柱(4 mm×250 mm)(美国戴安)。
1.2 样品与试剂氢氧化钠(优级纯,上海凌峰化学试剂有限公司)、无水乙酸钠(优级纯,Acros Organics),壳二糖、壳三糖、壳四糖、壳五糖、壳六糖(大连中科格莱克生物科技有限公司,纯度≥98%)。实验用水为超纯水(18.2 MΩ.cm,美国密理博公司)。壳寡糖检测样品,分别为浙江省XX生物科技有限公司生产(1号),大连XX生物科技有限公司生产(2号),青岛XX生物工程有限公司生产(3号)。
2 实验结果与讨论 2.1 溶液的制备精密称取壳2~6糖对照品各0.100 g,用超纯水溶解于1 000 mL量瓶中定容,配成浓度为100 µg·mL-1的对照品储备液,吸取储备液适量于10 mL量瓶中,用超纯水稀释至刻度,即得对照品质量浓度为6 µg·mL-1的混合溶液。准确称取0.1 g样品,用超纯水溶解后定容至1 000 mL,用0.45 µm水性滤膜过滤,滤液4 ℃冷藏备用,使用时用超纯水稀释成6 µg·mL-1后用离子色谱进行测定。
2.2 色谱条件色谱柱系统:DIONEX CarboPac PA10保护柱(4.0 mm×50 mm)+DIONEX CarboPac PA10分析柱(4.0 mm×250 mm)。ED40 A电化学检测器配Au工作电极及Ag-AgCl参比电极,积分脉冲安培法检测。淋洗条件:A:100 mmol·L-1 NaOH;B:超纯水;30%A+70%B(v/v)等度洗脱;流速为0.60 mL·min-1;采用自动进样,进样量25 μL;色谱柱及检测池温度30 ℃。进样完毕后用200 mmol·L-1 NaOH进行冲洗,以保证测定系统的稳定性。
2.3 优化实验条件经过多次改变淋洗液的配比进行实验条件优化,增加流速可以实现壳寡糖对照品的分离效果增强,但是淋洗液的浓度过高又会导致壳寡糖洗脱速度提前,从而无法达到很好的分离效果。糖类在离子色谱上分离是基于阴离交换分离模式,但在壳寡糖分离时,由于带有氨基的基团在碱性流动相中是带正电荷,部分中和了糖类的阴离子,因此也削弱了糖类的离子电荷数,最终出峰顺序与常规糖类相反,随着载体颗粒直径增大,保留时间越小。
实验设置了25、30、35 ℃ 3个温度梯度,结果表明色谱柱及检测池温度30 ℃时最为理想。淋洗液配比和流速通过不同的测定,确定最优化条件为30%A+70%B(A:100 mmol·L-1氢氧化钠;B:超纯水);流速:0.60 mL·min-1,温度30 ℃时,可以将不同聚合度的壳寡糖在25 min内实现分离。
2.4 系统适用性壳寡糖2~6对照品混合溶液连续进样6次,记录色谱图,考察分离度。相邻色谱峰的分离度大于1.5,无互相干扰。色谱图见图 1。可见壳2-6糖在该色谱条件下均可得到良好分离,基线平稳。
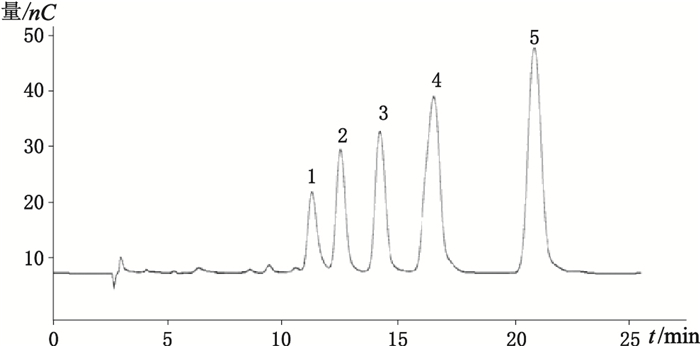
|
1.壳六糖(chitohexaose)2.壳五糖(chitopentaose)3.壳四糖(chitotetraose)4.壳三糖(chitotriose)5.壳二糖(chitobiose) 图 1 壳2~6糖对照品色谱图 Figure 1 Reference substance chromatogram chart of chitosan oligosaccharide 2-6 |
将壳寡糖对照品混合溶液以上述优化条件进行检测,测得糖的峰面积与对应浓度工作曲线进行线性回归,结果见表 1。结果表明在线性范围2.00~10.00 μg·mL-1,相关系数r≥0.999 0,线性关系良好。根据3倍信噪比(S/N=3)可分别计算出壳寡糖2~6糖的检出限。
|
|
表 1 标准曲线方程及检出限 Table 1 Calibration curves and calculated limits of detection(LOD) |
取1~3号样品,按供试品溶液的制备方法制备溶液,1~3号壳寡糖样品溶液,添加一定量的不同聚合度的壳寡糖对照品溶液后测定各聚合度壳寡糖的峰面积,计算其含量,考察方法的回收率在93.2%~105%之间。按优化的色谱条件连续进样6次,平行样品间的RSD在0.1%~1.6%之间,说明精密度良好。见表 2~4。
|
|
表 2 样品1加标回收率及RSD Table 2 The recovery and RSD of sample 1 |
|
|
表 3 样品2加标回收率及相对标准偏差 Table 3 The recovery and relative standard deviation of sample 2 |
|
|
表 4 样品3加标回收率及相对标准偏差 Table 4 The recovery and relative standard deviation of sample 3 |
在实验优化条件下,进行对壳寡糖产品纯度分析,选取3种壳寡糖样品进行测定,其测定分析图见图 2。从图中可以看到一些小峰,从理论上分析应该是样品中存在其他聚合度的糖,但是缺少相对应的对照品,所以有待证实。根据上述检测方法,可以在25 min内,完成对壳寡糖样品的检测,并且达到实验方法要求的精密度和准确性要求。
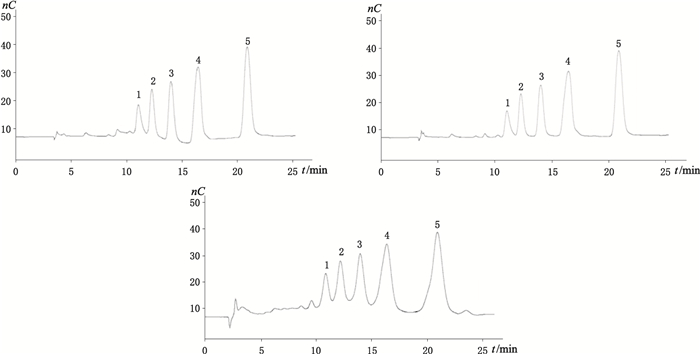
|
1.壳六糖(chitohexaose)2.壳五糖(chitopentaose)3.壳四糖(chitotetraose)4.壳三糖(chitotriose)5.壳二糖(chitobiose) 图 2 壳寡糖样品1~3色谱图 Figure 2 Chromatograms of chitosan oligosaccharide sample 1-3 |
根据壳寡糖对照品的浓度和峰面积的比值与供试品中相应聚合度壳寡糖的浓度和峰面积的比值相等的关系,便可求得供试品中各聚合度壳寡糖的浓度,各聚合度壳寡糖浓度之和与对照品的配制浓度的比值,即为2~6个聚合度壳寡糖的含量[17]。计算样品1~3中2~6个聚合度壳寡糖的含量之和分别为25.944、26.406、25.374 µg·g-1,配制的壳2~6糖对照品物质含量之和为30.000 µg·g-1,由此算得2~6个聚合度壳寡糖的纯度为86.5%、88.0%和84.6%。其计算结果见表 5。均符合国家2014年颁布的《关于批准壳寡糖等6种新食品原料的公告》中壳寡糖含量≥80%的要求。
|
|
表 5 样品1-3号测得值及纯度 Table 5 The content and purity of the sample 1-3 |
由于糖的种类、结构多样性,现在很难用一种分析手段对一种糖进行定性和定量分析,但是使用离子色谱脉冲安培检测方式,可以具有更高的灵敏度,更宽的线性范围。
本研究相较于以前的常规方法,克服了反应条件苛刻,手续烦琐的缺点,建立了高效阴离子交换色谱—积分脉冲安培检测法(HPAEC-IPAD)的壳寡糖对照品分离方法并检测了3种壳寡糖样品计算其纯度,该方法简便易行,精密度高,可用于检测市场上常见的壳寡糖保健品,随着离子色谱分析技术的发展,具有广阔的发展前景。
| [1] |
汤怀武, 王红春, 史爱民. 农业领域对壳寡糖改性的专利技术发展概述[J]. 江苏农业科学, 2015, 43(8): 444. TANG HW, WANG HC, SHI AM. Overview of patent technology development of chitosan oligosaccharide modification in agriculture[J]. Jiangsu Agr Sci, 2015, 43(8): 444. |
| [2] |
杜昱光. 壳寡糖的功能研究及应用[M]. 北京: 化学工业出版社, 2009, 50. DU YG. Research and Application of the Function of Chitosan Oligosaccharide[M]. Beijing: Chemical Industry Press, 2009, 50. |
| [3] |
马镝, 吴元华, 赵秀香. 壳寡糖的制备、分离分析方法及在农业上的应用[J]. 现代农药, 2007, 6(2): 1. MA D, WU YH, ZHAO XX. Preparation and purification and analysis of chito-oligosaccharide and its application in agriculture[J]. Mod Agrochem, 2007, 6(2): 1. |
| [4] |
许翔, 李吕木, 张民扬. 壳寡糖的生物学功能及其在畜禽营养中的应用[J]. 饲料博览, 2015, 6: 31. XU X, LI LM, ZHANG MY. Research progress on biological function of chitosan oligosaccharide and application in livestock nutrition[J]. Feed Rev, 2015, 6: 31. |
| [5] |
沈献周, 沈月新. 不同平均分子量的α-壳聚糖的抑菌作用[J]. 上海水产大学学报, 2000, 9(2): 138. SHEN XZ, SHEN YX. The antibiotic activity of α-chitosan with different molecular weights[J]. J Shanghai Fish Univ, 2000, 9(2): 138. |
| [6] |
周天, 刘晶, 周晓梅, 等. 壳聚糖对作物的生理效应及其增产作用[J]. 吉林师范大学学报(自然科学版), 2003(5): 18. ZHOU T, LIU J, ZHOU XM, et al. The effect of chitosan on the physiology and yield increase of crop plants[J]. J Jilin Univ(Nat Sci Edit), 2003(5): 18. |
| [7] |
王勤, 胡新良, 黄雪梅. 聚2, 2-二甲基三亚甲基碳酸酯与壳寡糖的接枝共聚反应研究[J]. 广州化工, 2014, 39(2): 27. WANG Q, HU XL, HUANG XM. Synthesis of copolymer of poly(2, 2-dimethyl-trimethylene carbonate) grafted onto chitooligosaccharide[J]. Guangzhou Chem, 2014, 39(2): 27. |
| [8] |
王乃强. 我国低聚糖的研发现状与前景[J]. 精细与专用化学品, 2007, 15(12): 1. WANG NQ. Development situation and prospect of oligosaccharide in China[J]. Fine Spec Chem, 2007, 15(12): 1. DOI:10.3969/j.issn.1008-1100.2007.12.001 |
| [9] |
李克成, 李鹏程, 邢荣娥, 等. 壳寡糖含量的测定方法比较[J]. 药物分析杂志, 2011, 31(8): 1530. LI KC, LI PC, XING RE, et al. Comparison of methods in determination of chitooligosaccharide[J]. Chin J Pharm Anal, 2011, 31(8): 1530. |
| [10] |
姜竹茂. 功能性低聚糖的发展及应用[J]. 食品安全导刊, 2010, 9(58): 58. JIANG ZM. Development and application of functional oligosaccharides[J]. China Food Safety, 2010, 9: 58. |
| [11] |
CENTI S, TATINI F, RATTO F, et al. In vitro assessment of antibody:Conjugated gold nanorods for systemic injections[J]. J Nanobiotechnol, 2014, 12(1): 1. DOI:10.1186/1477-3155-12-1 |
| [12] |
SU EP, KIM OH, KWAK JH, et al. Antihyperglycemic effect of short-term arginyl-fructose supplementation in subjects with prediabetes and newly diagnosed type 2 diabetes:randomized, double-blinded, placebo-controlled trial[J]. Trials, 2014, 16(1): 1. |
| [13] |
KROKEIDE IM, SYNSTAD B, GASEIDNES S, et al. Natural substrate assay for chitinases using high-performance liquid chromatography:A comparison with existing assays[J]. Anal Biochem, 2007, 363, 128. |
| [14] |
EL RASSI Z. Recent developments of capillary electrophoresis and capillary electrochromatography of carbohydrate species[J]. Electrophoresis, 1999, 20(15-16): 3134. DOI:10.1002/(ISSN)1522-2683 |
| [15] |
LEE KB, KIM YS, LINHARDT RJ. Capillary zone electrophoresis for the quantitation of oligosaccharides formed through the action of chitinase[J]. Electrophoresis, 1991, 12(9): 636. DOI:10.1002/(ISSN)1522-2683 |
| [16] |
牟世芬, 于泓, 蔡亚岐. 糖的高效阴离子交换色谱-脉冲安培检测法分析[J]. 色谱, 2009, 27(1): 667. MOU SF, YU H, CAI YQ. Analysis of sugars by high performance anion-exchange chromatography with pulse damperometric detection[J]. Chin J Chromatogr, 2009, 27(1): 667. |
| [17] |
蒋慧, 李恒, 张澜, 等. 高效液相色谱法测定壳寡糖的含量[J]. 发酵科技通讯, 2016, 45(4): 232. JIANG H, LI H, ZHANG L, et al. Determination of chitosan oligosaccharide by high performance liquid chromatography[J]. Bull Ferment Sci Technol, 2016, 45(4): 232. |
 2017, Vol. 37
2017, Vol. 37 