紫杉醇脂肪乳是由中国医学科学院药物研究所自主研发的一种Cremophor EL-free、载药量高、耐热压灭菌和长期贮存质量稳定的紫杉醇新型制剂[1]。动物体内实验结果表明,该脂肪乳安全、低毒、生物相容性好,其耐受剂量下的抗肿瘤效果不仅优于普通注射液,还显著优于紫杉醇白蛋白纳米粒,具有良好的发展前景[1-2]。
对于脂肪乳来说,包封的药物和游离药物可能会有不同的体内过程,过多的游离药物可能导致严重的副作用,所以包封率是控制其质量的重要指标之一[3-4]。常用的包封率的测定方法包括透析法[5-6]、葡聚糖凝胶柱色谱法[7]及超速离心法[6, 8]。
透析法是将一定体积的载药乳置于透析袋中,放入一定量介质中,连续电磁搅拌,通过测定外围介质中游离药物的浓度,间接计算包封率。此法虽操作简单,但样品测定耗时长,而且需要加入大量水性介质,易导致包封药物向水相扩散,从而导致测得的包封率可能较理论值偏低[9],葡聚糖凝胶柱色谱法是利用分子筛原理将包封药物与游离药物进行分离,但该法的分离时间较长(约数小时),且葡聚糖凝胶价格较贵,实验用量多(约5~8 g)[10],超速离心法是根据脂肪乳中各相密度不同,在离心力作用下沉降速度不同而对各相进行分离的,其包封率是通过测定水相中的游离药物间接计算得到。对于难溶于水的未被包封的游离药物,由于在超速离心过程中药物会沉降于油水界面或离心管底部,难以回收和准确定量,故测得的包封率结果可能偏高[11]。
微柱离心法是一种新型的包封率测定方法,该方法结合了葡聚糖凝胶的分子筛原理和离心作用的双重优势,与常规的葡聚糖凝胶柱色谱法相比,凝胶的用量大大减少,可实现制剂中包封药物和游离药物的快速分离[12]。在前期探索性实验中发现,以水和乙醇为洗脱液可以分别对紫杉醇脂肪乳中的包封药物和游离药物进行洗脱。据文献报道,用微柱离心法测定微粒制剂的包封率时主要以浊度法和磷脂浓度变化来反映微粒载体的洗脱程度,但以上2种方法均存在一定的不足[13-14]。鉴于大豆油作为脂肪乳的油相,含量高,检测方法成熟,测定时操作简便,结果准确,本研究选择大豆油作为辅助监测指标,来反映脂肪乳是否洗脱完全。通过考察洗脱过程中紫杉醇及大豆油的含量变化情况,对洗脱液的用量及洗脱方式进行系统研究,建立了紫杉醇脂肪乳包封率测定的微柱离心法。该法简单易行,可区分不同包封情况的紫杉醇脂肪乳,测定结果准确可靠。
1 仪器与试药Agilent 1100/1260型高效液相色谱仪(美国Agilent公司);TDZ5-WS型低速离心机(长沙湘仪离心机仪器有限公司);Agilent 1260蒸发光散射检测器(美国Agilent公司);葡聚糖凝胶Sephadex G-50(瑞典Pharmacia公司);紫杉醇(桂林晖昂生药有限责任公司);大豆油(铁岭新兴药业股份有限公司);空白脂肪乳,紫杉醇脂肪乳(自制,制备方法参考文献[1-2]);色谱纯甲醇、色谱纯乙腈(ANPEL Laboratory Technologies公司);水为市售娃哈哈纯净水;其余均为分析纯。
2 方法和结果 2.1 大豆油的含量测定[15] 2.1.1 色谱条件色谱柱:Lichrospher® 100 Diol(多孔的高纯球形硅胶)柱(250 mm×4.6 mm,5 μm);流动相:正庚烷-异丙醇-冰醋酸(97:3:0.1);流速:1.0 mL·min-1;进样量:10 μL;ELSD气化室温度:60 ℃;氮气流速:2.0L·min-1。
2.1.2 线性关系考察精密称取大豆油100 mg,置25 mL量瓶中,用异丙醇-正庚烷(2:1)稀释至刻度,摇匀,精密量取4 mL,置25 mL量瓶中,加流动相稀释至刻度,摇匀,作为大豆油的储备溶液。分别取上述储备液1.0、1.5、2.0、2.5、3.0 mL,置10 mL量瓶中,加流动相稀释至刻度,摇匀,制成浓度为64~192 μg·mL-1的溶液。取上述溶液10 μL,进行HPLC-ELSD检测。以进样浓度的对数log x(μg·mL-1)对峰面积的对数log y进行线性回归,得回归方程:
| $ {\rm{log}}\mathit{y}{\rm{ = 1}}{\rm{.849}}\;{\rm{log}}\;\mathit{x}{\rm{ + 2}}{\rm{.751}}\;\;\;\;\mathit{r}{\rm{ = 0}}{\rm{.999}}\;{\rm{9}} $ |
表明大豆油的进样浓度在64~192 μg·mL-1范围内,峰面积的对数值与浓度的对数值的线性关系良好。
2.1.3 精密度试验取“2.1.2”项下浓度为64、128、192 μg·mL-1的溶液,分别连续进样6次,RSD均小于2.0%。
2.1.4 回收率试验按紫杉醇脂肪乳处方比例称取相当于大豆油100 mg的其它成分(除大豆油外),置50 mL量瓶中,用异丙醇-正庚烷(2:1)稀释至刻度,摇匀,精密量取4 mL,置25 mL量瓶中,加流动相稀释至刻度,摇匀,作为其它成分的储备溶液。分别取“2.1.2”项下大豆油的贮备溶液和上述其它成分的储备溶液各0.8、1.0、1.2 mL,一同置5 mL量瓶中,加流动相稀释至刻度,摇匀,分别作为相当于供试品溶液浓度80%、100%、120%的回收测定溶液(n=9)。平均回收率为100.5%,RSD均小于1.0%。
2.1.5 样品含量测定取大豆油适量,用异丙醇-正庚烷(2:1)制成浓度分别为64~192 μg·mL-1的标准溶液,进行HPLC-ELSD检测。以进样浓度的对数log x(μg·mL-1)对峰面积的对数log y进行线性回归,得回归方程。再量取供试品溶液进行HPLC-ELSD检测,用回归方程计算其中大豆油含量。
2.2 紫杉醇的含量测定 2.2.1 色谱条件[16]色谱柱:Zorbax XDB-C18(十八烷基硅烷键合硅胶)柱(250 mm×4.6 mm,5 μm);流动相:甲醇-乙腈-水(23:36:41);检测波长:227 nm;柱温:40 ℃;流速:1.5 mL·min-1。
2.2.2 样品含量测定取紫杉醇适量,用乙醇制成浓度为48 μg·mL-1的对照品溶液。分别量取对照品溶液和供试品溶液进行HPLC检测,用外标法计算其中紫杉醇含量。
2.3 微柱的制备将Sephadex G-50用水浸泡,充分溶胀后,填充至10 mL注射器内(底部填有适量棉花),填充高度约8 mL,以2 000 r·min-1离心3 min,使凝胶柱脱水,形成平整均匀的凝胶柱待用。
2.4 方法的建立 2.4.1 水对包封药物及游离药物的洗脱 2.4.1.1 对紫杉醇脂肪乳取0.5 mL紫杉醇脂肪乳加于微柱上端,2 000 r·min-1离心3 min后,加1 mL水于微柱上端,2 000 r·min-1离心3 min,收集洗脱液,作为洗脱液1。共加水洗12次,收集的洗脱液依次编号为1~12次。取各次洗脱液,分别用异丙醇-正庚烷(2:1)及乙醇制成适宜浓度的供试品溶液。按“2.2.1”和“2.2.1”项下的色谱条件,分别测定供试品溶液中紫杉醇及大豆油含量,绘制洗脱曲线及累积洗脱曲线见图 1,图 2。结果表明,采用1 mL水洗2次后,紫杉醇脂肪乳中大豆油和紫杉醇的累积洗脱百分比均在98%以上,洗脱完全,表明水对大豆油和包封的紫杉醇均有很好的洗脱能力。为了保证脂肪乳中包封药物可以洗脱完全,本法采用水洗3次来回收包封的紫杉醇。
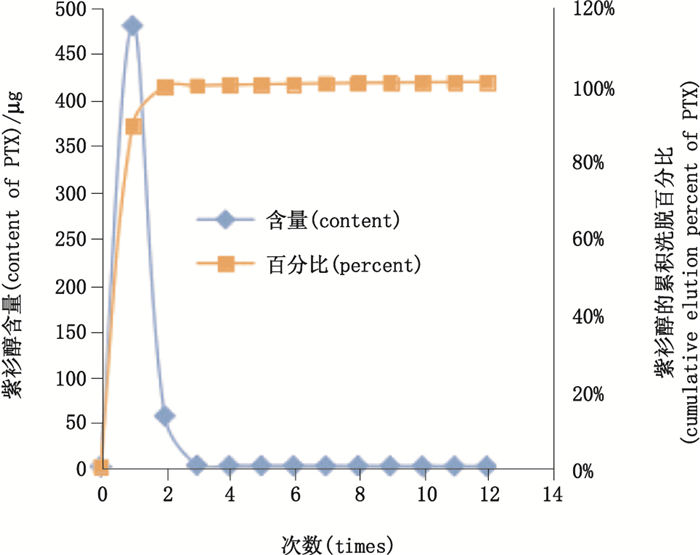
|
图 1 紫杉醇脂肪乳中紫杉醇的洗脱曲线及累积洗脱曲线 Figure 1 Elution curve and cumulative elution curve of PTX in PTX emulsion |
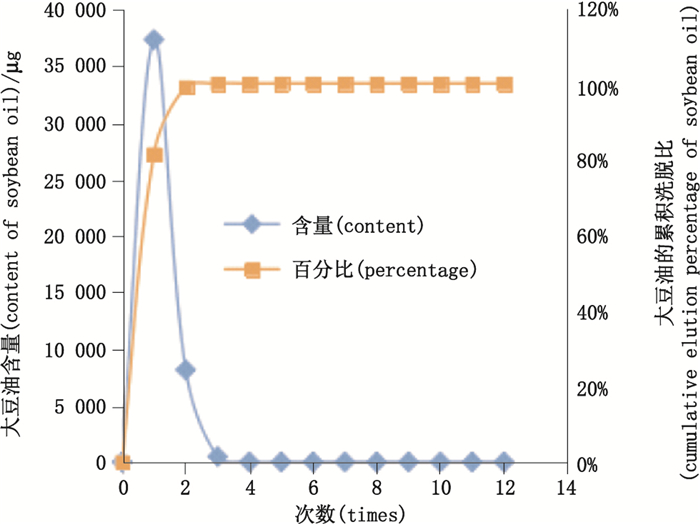
|
图 2 紫杉醇脂肪乳中大豆油的洗脱曲线及累积洗脱曲线 Figure 2 Elution curve and cumulative elution curve of soybean oil in PTX emulsion |
精密称取紫杉醇12 mg,置10 mL量瓶中,用乙醇定容至刻度,摇匀,制成浓度为1.2 mg·mL-1(与紫杉醇脂肪乳处方中紫杉醇浓度一致)的溶液,作为游离药物溶液。取0.5 mL上述溶液加在微柱上端,按“2.4.1.1”项下操作,取各次洗脱液,分别用乙醇制成适宜浓度的供试品溶液。按“2.2.1”项下的色谱条件,测定其中紫杉醇含量,绘制洗脱曲线见图 3,并与紫杉醇脂肪乳水洗脱曲线进行比较。结果表明,水对游离紫杉醇会有极少量的洗脱。这可能是由于紫杉醇在水中的溶解度极低,游离紫杉醇采用以乙醇制成的溶液形式上样,溶剂乙醇的存在促进了微量药物在水中的溶解及洗脱[17]。为此,进一步考察了不同乙醇用量对游离药物洗脱的影响,结果表明,当游离药物中乙醇的量减少时,水对游离药物的洗脱量会大大减少。考虑到紫杉醇脂肪乳处方中并不含乙醇,因此,水对以乙醇为溶剂情况下的游离药物的少量洗脱不会影响紫杉醇脂肪乳样品的包封率测定的准确性。

|
图 3 紫杉醇脂肪乳及紫杉醇游离药的洗脱曲线 Figure 3 Elution curve of PTX emulsion and free drug |
取“2.4.1.2”项下游离紫杉醇溶液0.5 mL加在微柱上端,2 000 r·min-1离心3 min后,加3 mL乙醇于微柱上端,2 000 r·min-1离心3 min,收集洗脱液,作为洗脱液1。共加乙醇洗3次,收集的洗脱液依次编号为1~3。取各次洗脱液,分别用乙醇制成适宜浓度的供试品溶液。按“2.2.1”项下的色谱条件,测定其中紫杉醇含量,并计算紫杉醇的累积洗脱百分比。结果表明,3 mL乙醇洗1次以上,游离紫杉醇的累积洗脱百分比即达到98%以上,洗脱完全,表明乙醇对游离紫杉醇有很好的洗脱能力。
2.4.3 包封药物及游离药物分离的洗脱曲线取紫杉醇适量,加乙醇制成浓度为12 mg·mL-1的溶液,取该溶液1 mL,缓慢加至10 mL空白脂肪乳中,充分振摇,即得外加法制备的包封不完全的紫杉醇脂肪乳。取该脂肪乳0.5 mL,加于微柱上端,2 000 r·min-1离心3 min后,每次用1 mL水洗,共加水洗3次,收集各次洗脱液依次编号1~3。再每次用3 mL乙醇洗,共加乙醇洗3次,收集各次洗脱液依次编号4-6次。取各次洗脱液,分别用异丙醇-正庚烷(2:1)及乙醇制成适宜浓度的供试品溶液。按“2.1.1”和“2.2.1”项下的色谱条件,分别测定供试品溶液中大豆油及紫杉醇含量,并绘制洗脱曲线,见图 4~5。图 4的洗脱曲线上出现2个峰,第1个峰为水洗脱的被包封的紫杉醇峰,第2个峰为乙醇洗脱的游离紫杉醇峰。图 5的洗脱曲线只在水洗脱部分出现1个峰,即脂肪乳中的大豆油的峰。对比2条洗脱曲线可知,油相成分大豆油作为辅助监测指标,可准确反映脂肪乳的洗脱程度,通过考察洗脱过程中紫杉醇及脂肪乳中油相成分大豆油的含量,更加直观地反映了包封药物与游离药物洗脱的分界点。采用建立的水和乙醇依次洗脱的方式,脂肪乳中的包封药物与游离药物可得到完全分离,且水洗3次和乙醇洗2次即可分别实现包封紫杉醇和游离紫杉醇的回收完全。
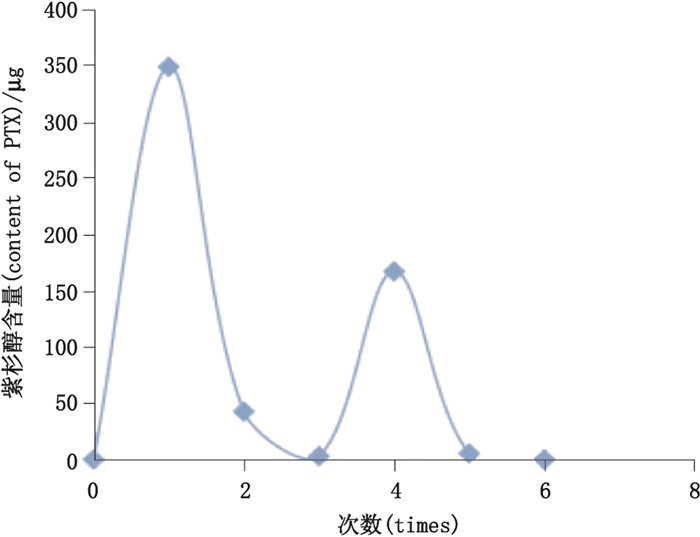
|
图 4 外加法制备的紫杉醇脂肪乳中紫杉醇的洗脱曲线 Figure 4 Elution curve of PTX in PTX emulsion prepared with external additive |

|
图 5 外加法制备的紫杉醇脂肪乳中大豆油的洗脱曲线 Figure 5 Elution curve of soybean oil in PTX emulsion prepared with external additive |
取紫杉醇脂肪乳,按高(0.6 mL)、中(0.5 mL)、低(0.4 mL)3种进样量,分别加于微柱上端,2 000 r·min-1离心3 min后,每次用1 mL水洗,共洗3次,再每次用3 mL乙醇洗,共洗2次,合并所有洗脱液,用乙醇制成适宜浓度的供试品溶液。按2.2.1项下色谱条件,测定其中紫杉醇含量(C1)。高、中、低每种上样量各平行实验3份。另取过柱离心前的紫杉醇脂肪乳,测定其中紫杉醇的总量(C)。计算柱回收率(%)=C1/C×100%。平均柱回收率为100.4%,RSD为0.60%(n=9),方法的回收率良好。
2.5.2 重复性试验取紫杉醇脂肪乳0.5 mL加于微柱上端,2 000r·min-1离心3 min后,每次用1 mL水洗,共洗3次,合并洗脱液,用乙醇制成适宜浓度的供试品溶液。平行5份。按“2.2.1”项下色谱条件,测定其中紫杉醇含量(C1)。另取过柱离心前的紫杉醇脂肪乳,测定其中紫杉醇的总量(C)。计算包封率(%)=C1/C×100%。平均包封率为99.4%,RSD为0.58%(n=5),方法的重复性良好。
2.6 紫杉醇脂肪乳样品包封率的测定取不同批号的紫杉醇脂肪乳3批,分别取0.5 mL加于微柱上端,按“2.5.2”项下方法操作。每个批号平行测定2份。计算包封率(%)=C1/C×100%。结果3批样品的包封率分别为99.2%、99.3%、99.5%(n=2)。
3 讨论 3.1 判断包封药物与游离药物分离情况的方法的选择在微粒制剂包封率方法的建立过程中,为更好地判断包封药物与游离药物的分离情况,有文献以洗脱后分散液的浊度来判断微粒载体是否洗脱完全[12],方法的实质是以微粒对透射光的作用为基础,大粒子以产生反射、折射作用为主,而小粒子主要产生散射,且存在多级散射,因此微粒浓度与光密度不存在严格的线性关系[18],故方法的准确度值得商榷。而且浊度法对于微粒制剂的测定适用与否与多种因素相关,如药物和载体材料的性质,粒子的粒径大小与分布。国内还有报道,采用微柱离心法结合磷脂浓度变化测定脂质体包封率,文献中多采用定磷法测定磷脂浓度[14],但该法操作既烦琐又危险,且磷脂作为一种混合物,组分复杂,在脂肪乳中含量低,采用色谱法进行测定时,在检测过程中干扰成分较多[19]。大豆油作为脂肪乳的油相成分,含量高,检测方法成熟,操作简便,准确快速。因此在确定洗脱液的用量及洗脱方式时,通过结合洗脱过程中大豆油的含量变化情况来反映脂肪乳的洗脱情况,有利于洗脱程序的建立,且测定结果较浊度法及测定磷脂浓度的方法更为准确简便。
3.2 包封药物及游离药物分离的洗脱曲线的意义为了直观地反映洗脱过程中包封药物与游离药物的分界点,在方法建立中,我们采用药物外加法制备了一种包封不完全的紫杉醇脂肪乳,通过考察其包封药物与游离药物的分离情况,确立了包封药物和游离药物的洗脱分界点。该脂肪乳的洗脱曲线表明,在建立的洗脱条件下,紫杉醇脂肪乳中的包封药物与游离药物可得到完全分离,由此确立了最终的洗脱方式及洗脱液用量。
3.3 微柱离心法可作为具有区分力的方法的依据采用建立的微柱离心法对紫杉醇脂肪乳初乳工艺研究中制备的初乳样品及调整工艺参数制得的不同粒径样品的包封率进行了测定,结果发现,该方法能区分不同包封情况下的紫杉醇脂肪乳,测定结果准确可靠。因此,微柱离心法可优选作为紫杉醇脂肪乳包封率的测定方法。
3.4 大豆油及紫杉醇含量测定方法的依据标准脂肪乳注射液(C14~C24)标准(见中国食品药品检定研究院进口药品复核标准(5),标准号自编206,页码No 206)中规定了大豆油的HPLC-ELSD测定方法。本实验室在参考上述标准规定的基础上,对流动相比例进行了一定的优化,建立了最终的紫杉醇脂肪乳中大豆油的HPLC-ELSD测定方法;紫杉醇含量测定的色谱条件和方法均参照文献[16]。
| [1] |
XIA XJ, GUO RF, LIU YL, et al. Formulation, characterization and hypersensitivity evaluation of anintravenous emulsion loaded with apaclitaxel-cholesterol complex[J]. Chem Pharm Bull(Tokyo), 2011, 59(3): 321. DOI:10.1248/cpb.59.321 |
| [2] |
YE J, LIU YL, XIA XJ, et al. Improved safety and efficacy of a lipid emulsion loaded with a paclitaxel-cholesterol complex for the treatment of breast tumors[J]. Oncol Rep, 2016, 36(1): 399. DOI:10.3892/or.2016.4787 |
| [3] |
张鹏霄. 以脂质复合分子为中间载体的紫杉醇亚微乳剂的研究[D]. 北京: 协和医学院药物研究所, 2011 ZHANG PX.Study on Paclitaxel Submicroemulsion with Lipid Complex as Intermediate Carrier[D].Beijing:Institute of Materia Medica, Peking Union Medical College, 2011 |
| [4] |
ZHANG XM, PATEL AB, GRAAF RA, et al. Determination of liposomal encapsulation efficiency usingproton NMR spectroscopy[J]. Chem Phys Lipid, 2004, 127(1): 113. DOI:10.1016/j.chemphyslip.2003.09.013 |
| [5] |
曲昌海, 尹兴斌, 张慧, 等. 异亚丙基莽草酸脂质体的包封率测定方法比较[J]. 中国实验方剂学杂志, 2013, 19(1): 21. QU CH, YIN XB, ZHANG H, et al. Comparative study of entrapment efficiency determination of isopropylideneshikimic acid liposome[J]. Chin J Exper Tradit Med Formul, 2013, 19(1): 21. |
| [6] |
戎丽娜, 张敏, 钱秀珍, 等. 顺磁性脂质体包封率测定方法的研究[J]. 药物分析杂志, 2010, 30(8): 1435. RONG LN, ZHANG M, QIAN XZ, et al. Study on entrapment efficiency of paramagnetic liposomes[J]. Chin J Pharm Anal, 2010, 30(8): 1435. |
| [7] |
赵锋, 栾瀚森, 罗华菲, 等. 葡聚糖凝胶色谱法用于纳米粒包封率的测定[J]. 中国药学杂志, 2012, 47(17): 1385. ZHAO F, LUAN HS, LUO HF, et al. Determining the encapsulation efficiency of dexamethasone-loaded nanoparticles using sephadex gel column chromatography[J]. Chin Pharm J, 2012, 47(17): 1385. |
| [8] |
TOUITOU E, DAYAN N, BERGELSON L, et al. Ethosomes-novel vesicular carriers for enhanced delivery:characterization and skin penetration properties[J]. J Controll Rel, 2000, 65: 403. DOI:10.1016/S0168-3659(99)00222-9 |
| [9] |
陆彬. 药物新剂型与新技术[M]. 第二版. 北京: 人民卫生出版社, 2005, 137. LU B. New Techniques and New Dosage Forms of Drugs[M]. 2nd ed. Beijing: People's Medical Publishing House, 2005, 137. |
| [10] |
崔腾. 微柱离心法-HPLC法测定卡培他滨脂质体包封率[J]. 中国医药工业杂志, 2012, 43(8): 682. CUI T. Determination of entrapment efficiency of capecitabine liposomes by microcolumn centrifugation-HPLC[J]. Chin J Pharm, 2012, 43(8): 682. |
| [11] |
耿思聪, 龚昊宇, 许航, 等. 微柱离心法测定克拉霉素离子对脂质体注射液的包封率[J]. 中国药剂学杂志, 2016, 14(1): 18. GENG SC, GONG HY, XU H, et al. Determination of entrapment efficiency of clarithromycin ion-pairliposome by a mini-column centrifugation method[J]. Chin J Pharm, 2016, 14(1): 18. |
| [12] |
李静, 姚亮, 陈伟, 等. 自制葡聚糖凝胶微型柱测定新藤黄酸聚乳酸-羟基乙酸共聚物纳米微球包封率[J]. 安徽中医学院学报, 2013, 32(6): 77. LI J, YAO L, CHEN W, et al. Determination ofencapsulation efficiency of gambogentic acid-PLGA nanopheres using self-assembled Sephadex mini-column[J]. J Anhui TCM Coll, 2013, 32(6): 77. |
| [13] |
陈孝储, 周欣, 李玉明, 等. 微柱离心法测定苯妥英钠脂质体包封率条件考察[C]. 第十一届全国青年药学工作者最新科研成果交流会论文集, 2012: 6 CHEN XC, ZHOU X, LI YM, et al.Determination of the Encapsulation Efficiency of Phenytoin Sodium Liposomes by Minicolumn Centrifugation Method[C].Procedings of the 11th National Youth Pharmaceutical Researchers'the Lastest Scientific Achievements Forum, 2012:6 |
| [14] |
陈孝储, 郭一沙, 宋菲, 等. 微柱离心结合胆固醇浓度变化测定水溶性药物脂质体包封率[J]. 沈阳药科大学学报, 2014, 31(11): 851. CHEN XC, GUO YS, SONG F, et al. Determination of encapsulation efficiency of water-soluble drug in liposomes by minicolumn centrifugation combined with the changes of cholesterol concentration[J]. J Shenyang Pharm Univ, 2014, 31(11): 851. |
| [15] |
中检所进口药品复核标准(5), 自编206, 脂肪乳注射液(C14~C24)标准[S]. 2001: 206 Validation Specification of Import Drug by National Institute of Food and Drug Control(5), Self Number 206, Lipid Emulsion Injection(C14~C24) Standards[S].2001:206 |
| [16] |
夏学军, 王艳宝, 徐佳茗, 等. 高效液相色谱法测定紫杉醇亚微乳含量[J]. 中国药业, 2014, 23(3): 26. XIA XJ, WANG YB, XU JM, et al. Content determination of paclitaxel submicroemulsion by HPLC[J]. China Pharm, 2014, 23(3): 26. |
| [17] |
PANCHAGNULA R. Pharmaceutical aspects of pacliraxel[J]. Intern J Pharm, 1998, 172: 1. DOI:10.1016/S0378-5173(98)00188-4 |
| [18] |
王汀, 李文秀, 邓英杰, 等. 微柱离心-药脂比测定脂质体药物包封率[J]. 沈阳药科大学学报, 2005, 5(1): 10. WANG T, LI WX, DENG YJ, et al. Centrifugation of minicolumn to remove free drugs from liposomes to determine the encapsulation efficiency by calculating the drug to phospholipid ratio[J]. J Shenyang Pharm Univ, 2005, 5(1): 10. |
| [19] |
章慧芳, 陆娅. 大豆磷脂中卵磷脂检测方法的研究[J]. 中国油脂, 2007, 32(7): 70. ZHANG HF, LU Y. Determination of soybean phosphatidylcholine[J]. China Oils Fats, 2007, 32(7): 70. |
 2017, Vol. 37
2017, Vol. 37 
