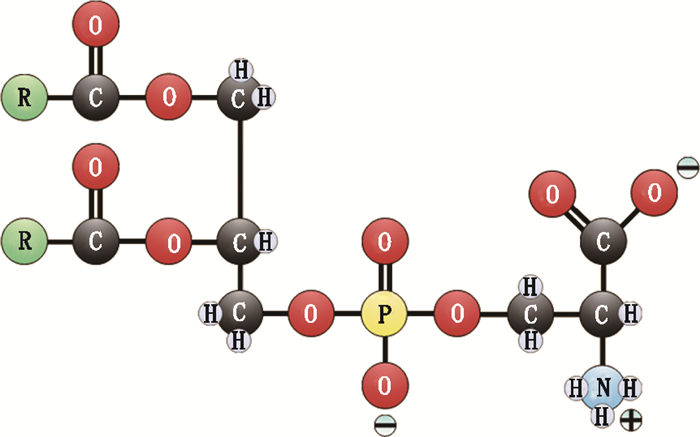
磷脂酰丝氨酸(phosphatidylserine,PS)是广泛存在于生物细胞中的一种重要的膜磷脂[1],是大脑中主要的酸性磷脂[2],是磷脂(membranephospholipids,PL)家族中唯一能够调控细胞膜关键蛋白功能状态的稀少磷脂[3],在生物代谢过程中起重要作用。PS的结构式见图 1。PS具有双亲性,由三部分组成:以甘油为主要骨架,由丝氨酸残基与磷酸残基相结合的带一个负电荷的基团构成其极性头部,2个较长链烃的非极性基团为尾部[1]。PS吸收后能够迅速通过血脑屏障进入大脑,与认知、情绪、学习、记忆等脑功能密切相关,目前已被应用于改善阿尔茨海默(氏)病、抗抑郁、抗压抑、缓解疲劳、修复大脑损伤、辅助激活酶等方面[1-6]。二十二碳六烯酸(docosahexaenoic acid,DHA)在健脑益智和保护视力等[6-7]方面具有显著作用。有研究表明[8],大脑和肝脏中的微粒体合成PS的最佳底物是18:0,22:6-PC,DHA可以促进PS的积累,DHA保护神经功能的作用部分得通过PS的积累完成,两者互相促进吸收,在提高大脑功能方面具有协同作用[6-9]。DHA不稳定,易氧化,且单独服用会增加胃肠负担[10],因此可将其与PS结合以发挥作用。由于PS的功效被人们广泛认可,越来越多的食品中添加PS作为功效性原料。
|
图 1 磷脂酰丝氨酸的分子结构 Figure 1 molecular structure of phosphatidylserine |
目前已报道测定PS的方法有:薄层色谱法(TLC)[11],适用于定性和半定量的目的;核磁共振波谱法(NMR)[12],不适于常规分析;液质联用(LC-MS)法[13],但具有不同脂肪酸链长度的PS的仪器响应有显著差异;高效液相色谱法是检测PS的主流方法,但由于PS的弱紫外吸收,又同时存在带相反电荷的基团,更增加了分离和定量的难度,常规的RP-HPLC难以实现PS的定量分析。针对以上困难,出现2种解决办法:一是将PS进行衍生化使其更有利于检测。如通过化学反应使PS分子改性,或直接连接发色团或荧光基团,用紫外或者荧光检测器(HPLC-FLD)[1]进行检测,可大大降低检测限,提高分离选择性。但是衍生化反应过程复杂,前处理操作烦琐,实验过程影响因素较多不易控制,衍生试剂又引入新的杂质并可能损伤色谱柱,不适用于PS的常规检测。另一种解决办法是以正相色谱分离配通用的蒸发光散射检测器(ELSD)[14, 15],其流动相组成复杂,需配备ELSD及高压氮气或空气,在实验室并不普及,其选择性、重复性都远不如紫外,具有一定的局限性。
本研究基于高效液相色谱-紫外(HPLC-UV)检测技术,采用较安全的正己烷-异丙醇混合溶剂为提取溶剂,以组成简单的乙腈-异丙醇为流动相,以应用日益广泛的Amide酰胺基色谱柱进行洗脱分离,通过摸索改进萃取溶剂及流动相的组成和配比,使两性物质PS在比较理想的保留时间,取得良好分离效果。本法应用于DHA冲剂中PS的测定,较以往方法[1, 14-15]前处理更简捷、环保,流动相配制更简单,分析评价更快速、准确,为其他功能食品中磷脂酰丝氨酸的含量测定提供新方法,对食品成分监测及其工艺研究具有重要意义。
1 仪器与材料Waters e2695型高效液相色谱仪系统配PDA-2998型二极管阵列检测器;Millipore Direct-Q纯水系统(美国Millipore);VORTEX-GENIE SI-0246漩涡混合仪(美国MoBio);KQ-250DE数控超声波清洗器(昆山市仪器有限公司);电子天平(德国赛多利斯,CPA225D,十万分之一)。
磷脂酰丝氨酸(L-α-phosphatidylserine,from egg yolk)对照品(Sigma公司,纯度≥99%,批号120M5210V);甲醇、乙腈、正己烷为色谱纯(美国Fisher);三氯甲烷、异丙醇(国药集团化学试剂有限公司,优级纯)。样品DHA颗粒(5 g·袋-1)由北京斯利安药业有限公司提供,批号为20160301、20160302、20160303。
2 实验方法 2.1 溶液的制备 2.1.1 PS对照品溶液准确称取PS对照品(按纯度标示折算)10.0 mg于10 mL量瓶中,以少量正己烷溶解后以异丙醇定容至刻度,制成质量浓度为1.0mg·mL-1的对照品溶液;以流动相稀释成PS质量浓度分别为0、0.1、0.2、0.5、0.6、0.8、1.0 mg·mL-1的系列对照品溶液。
2.1.2 供试品溶液精密称取DHA颗粒约0.5 g于10 mL量瓶中,加5 mL正己烷旋涡混匀,再加5 mL异丙醇超声(40 ℃,500 W,40 kHz)提取30 min,以异丙醇定容,取上清液过0.45 µm滤膜,即得。
2.1.3 阴性样品溶液按产品配方比例,制备不含PS的阴性样品,按“2.1.2”项下操作,即得。
2.2 色谱条件及系统适应性试验色谱柱:Waters XBridge Amide(4.6 mm×250 mm,3.5 µm;酰胺键合固定相),流动相:乙腈-异丙醇(7:3),流速:1.0 mL·min-1;进样量:20 μL;紫外检测波长:203 nm;柱温:45 ℃。
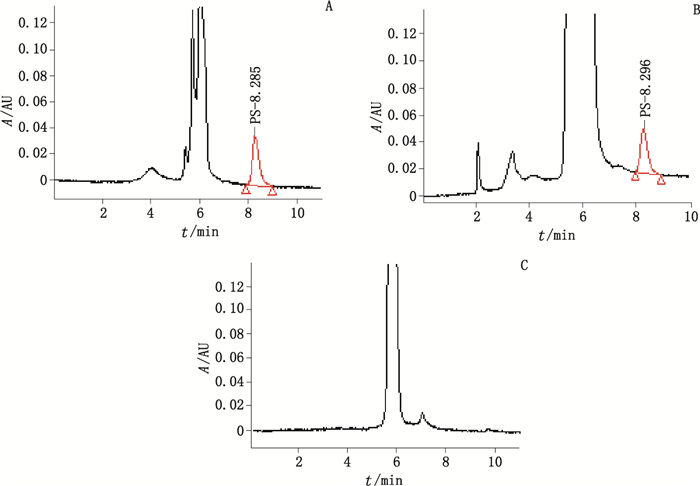
在上述色谱条件下,理论塔板数按PS峰计不低于5 000,对照品、供试品、阴性样品溶液色谱图见图 2。结果表明,PS的色谱峰与相邻杂质峰的分离度大于1.5,样品中的其他成分对待测成分的测定无干扰。对照品与阴性样品色谱同样在大约6 min处出现最大峰,推测为溶剂峰,不影响目标峰。
|
图 2 PS对照品(A)、供试品(B)及阴性样品溶液(C)HPLC色谱图 Figure 2 HPLC chromatograms of substances(A), sample(B)and negative sample(C) |
分别取对照品、供试品、阴性样品溶液进样分析,色谱图见图 2。可见,供试品的保留时间(8.285 min)与对照品的(8.296 min)基本一致,阴性样品在相应处未见出峰。表明本法用于检验DHA颗粒中的磷脂酰丝氨酸具有较强的专属性。
3.1.1 线性关系考察取“2.1.1”项下系列对照品溶液,按“2.2”项下参数设定,进样20 μL分析,以PS的质量浓度(X,mg·mL-1)为横坐标,对应的峰面积Y为纵坐标进行线性回归,回归方程:
| $ \mathit{Y}{\rm{ = 7}}{\rm{.611}} \times {\rm{1}}{{\rm{0}}^{\rm{5}}}\mathit{X}{\rm{ + 1}}{\rm{.632}} \times {\rm{1}}{{\rm{0}}^{\rm{3}}}\;\;\;\mathit{r}{\rm{ = 0}}{\rm{.999}}\;{\rm{9}} $ |
表明PS在0.1~1.0 mg·mL-1范围内,线性关系良好。
3.1.2 精密度同一供试品溶液,连续进样20 μL6次,结果PS峰面积的RSD为1.6%,保留时间的RSD为1.83%,表明仪器精密度良好。
3.1.3 稳定性同一供试品溶液,分别于0、4、8、12 h进样20 μL分析测定,根据色谱图的峰面积来考察PS在12 h内的稳定性,结果PS峰面积的RSD=3.1%,表明供试品溶液在12 h内稳定性良好。
3.1.4 回收率和重复性选取同一样品各0.25 g于10 mL量瓶中,对PS添加高低2个水平(分别加入1.0 mg·mL-1 PS对照品溶液3.5、1.5 mL),每个添加水平平行6份,按“2.1.2”项制备供试溶液,进样分析。考察方法的回收率和重复性。结果PS的高、低浓度的回收率(n=6)分别为101.2%和95.8%,RSD分别为1.3%和2.6%,表明该法准确度高,重复性良好。
3.2 样品测定分别取3批次的样品(批号20160301、20160302、20160303)各3份进行平行测定,以外标法计算样品中含PS的量,分别为10.5、10.3、10.6 mg·g-1,结果分别为标示量的105%、103%、106%。
4 讨论 4.1 色谱柱的选择分别采用Waters XBridge Amide(4.6 mm×250 mm,3.5 µm)、Hypersil APS-2(氨基)柱(4.6 mm×250 mm,5 µm)、Waters Symmetry C18(4.6 mm×250 mm,5 µm)及Thermo Beta Basic-18(4.6 mm×250 mm,5 µm)对PS对照品溶液进样分析,发现2个C18柱分析PS,均未见目标峰,而用Amide柱和氨基柱则都能较快出峰且分离良好,并且方法开发简便快速,HPLC图谱峰形好,不拖尾,基线相对平稳,灵敏度也满足分析要求。氨基柱采用氨丙基键合硅胶的固定相,Amide柱以酰胺键合固定相,两者具有相似保留机理。酰胺键合固定相没有氨丙基色谱柱内的碱性高,因此稳定性强且反应活性更弱,并克服常用氨基柱和硅胶柱使用过程中静电作用的影响。因此本研究选用更稳定、更耐用的Amide亲水作用色谱柱。亲水作用色谱的分离机理通常认为与静电、氢键和偶极作用等相关,本实验中PS属于非电离物质,无法进行离子交换,故与色谱柱之间无静电作用,PS在色谱柱上的分离可能是由于离子-偶极和氢键的协同作用。
4.2 流动相的选择在亲水色谱,乙腈通常为基本的或弱的溶剂相,而水则是最强的洗脱溶剂,由于极性醇类(异丙醇)的溶剂强度和质子化(提供氢离子)能力,会争夺固定相表面的极性活性位置,从而改变保留性质。考虑乙腈适用于Amide柱且对低波长的组分影响较小、噪音低,供试品中PS溶于异丙醇,因此以乙腈-异丙醇为基础流动相进行试验。本实验以PS在色谱柱上的分离度、峰形、保留时间、灵敏度等为考察指标,对不同比例、不同流速的乙腈-异丙醇流动相体系进行了比较。结果表明,以乙腈-异丙醇(7:3)为流动相,目标峰分离完全,且基线较平,峰形良好。再分别考察乙腈-异丙醇-水及乙腈-异丙醇-醋酸铵/氨水流动相体系,均在PS目标峰前出现较大干扰峰,而对PS峰并无增益,即确定乙腈-异丙醇的流动相体系。
4.3 检测波长的选择对PS对照品溶液进行紫外扫描,得到目标峰的最大吸收波长在203 nm左右。对照品与阴性样品色谱同样在大约6 min处出现最大峰,最大吸收波长在205 nm左右,推测为溶剂峰,不影响目标峰。观察203 nm下样品色谱图,其基线稳定且目标峰附近并无干扰峰,因此选定为检测波长。
4.4 柱温的选择流动相中的异丙醇具有较强的溶解洗脱能力,但其粘度较大,适于在较高的柱温下使用。实验证明,在一般情况下,适当升高柱温可明显降低柱压。考察35、40、45 ℃ 3种柱温对样品溶液中PS分离效果的影响,发现柱温越高,出峰越理想,峰形尖锐对称,分离度也满足要求。由于Amide色谱柱稳定性好并可耐受较高的柱温,柱温定为45 ℃。
4.5 样品提取方法PS在非极性溶剂(如低级烷烃类)中具有较好的溶解性,在低浓度下极性溶剂(如低碳醇类)对PS有高选择性,但容易出现乳化现象。因此,PS的萃取溶剂常常使用氯仿-甲醇或正己烷-异丙醇混合溶剂体系。功能食品大多添加功效成分,相对天然产物基质较简单,使用以上2种溶剂体系分别取样分析测定,结果并无显著性差异。本法选用更加安全、环保、经济并能与流动相相合的正己烷-异丙醇混合溶剂为提取溶剂,通过比较优化,采用先加5 mL正己烷旋涡混匀,再加5 mL异丙醇超声(40 ℃,500 W,40 kHz)提取30 min,最后以异丙醇定容,获得较理想的提取效率。
4.7 小结本文建立的HPLC-UV法快速测定DHA冲剂中PS的含量,使用实验室最常见的HPLC-UV,以正己烷-异丙醇混合溶剂为提取溶剂,以最普通的氨基色谱柱和组成简单的乙腈-异丙醇的流动相进行洗脱分离检测,通过不断的摸索试验,总结出操作步骤更为简捷、环保的,工作效率更高、结果可靠且普遍适用的检测方法。经方法学证明,本法专属性、重复性好,准确度高,适应性强,为含磷脂酰丝氨酸功能食品的全面质量控制提供一种新的方法。
| [1] |
LIN Q, ZHANG J, PEI WJ, et al. Determination of phosphatidylserine in milk-based nutritional products using online derivatization high-performance liquid chromatography[J]. J Chromatogr A, 2015(1381): 260. |
| [2] |
GLADE MJ, SMITH K. Phosphatidylserine and the human brain[J]. Nutr, 2015, 31(6): 781. |
| [3] |
KIDD PM. Phosphatidylserine, membrane nutrient for memory.A clinical and mechanistic assessment[J]. Altern Med Rev, 1996, 1(2): 70. |
| [4] |
MCDANIE MA, MAIER SF, EINSTEIN GO. "Brain-specific" nutrients:a memory cure?[J]. Nutrit, 2003, 19(11/12): 957. |
| [5] |
YANG SL, DUAN ZQ. Insight into enzymatic synthesis of phosphatidylserine in deep eutectic solvents[J]. Catal Commun, 2016, 82: 16. DOI:10.1016/j.catcom.2016.04.010 |
| [6] |
LIU SH, CHANG CD, CHEN PH, et al. Docosahexaenoic acid and phosphatidylserine supplementations improve antioxidant activities and cognitive functions of the developing brain on pentylenetetrazol-induced seizure model.[J]. Brain Res, 2012, 1451: 19. DOI:10.1016/j.brainres.2012.02.060 |
| [7] |
KIM HY. Biochemical and biological functions of docosahexaenoic acid in the nervous system:modulation by ethanol[J]. Chem Phys Lipids, 2008, 153(1): 34. DOI:10.1016/j.chemphyslip.2008.02.014 |
| [8] |
KIM HY, BIGELOW J, KEVALA JH. Substrate preference in phosphatidylserine biosynthesis for docosahexaenoic acid containing species[J]. Biochemistry, 2004, 43(4): 1030. DOI:10.1021/bi035197x |
| [9] |
李阅兵, 刘承初, 谢晶, 等. ω-3脂肪酸及磷脂酰丝氨酸的益智作用研究进展[J]. 中国油脂, 2011, 36(9): 51. LI YB, LIU CC, XIE J, et al. Research advance in the function on intelligence of ω-3 fatty acid and phosphatidylserine[J]. China Oils Fats, 2011, 36(9): 51. |
| [10] |
CHEN S, CHEN R. Docosahexaenoic acid-containing phospholipids and triglycerides based nutritional supplements[J]. Recent Patents Food Nutr Agric, 2010, 2(3): 213. |
| [11] |
AKITO KK, MASASHI S, RIKA E, et al. Soybean-derived phosphatidylserine improves memory function of the elderly Japanese subjects with memory complaints[J]. J Clin Biochem Nutr, 2010, 47(3): 246. DOI:10.3164/jcbn.10-62 |
| [12] |
MACKENZIE A, VYSSOTSKI M, NEKRASOV E. Quantitative analysis of dairy phospholipids by 31P NMR[J]. J Am Oil Chem Soc, 2009, 86(8): 757. DOI:10.1007/s11746-009-1403-6 |
| [13] |
MACIEL E, FARIA R, SANTINHA D, et al. Evaluation of oxidation and glyco-oxidation of 1-palmitoyl-2-arachidonoyl-phosphatidylserine by LC-MS/MS[J]. J Chromatogr B, 2013, 929: 76. DOI:10.1016/j.jchromb.2013.04.009 |
| [14] |
BRAUN M, FLUECK B, COTTING C, et al. Quantification of phospholipids in infant formula and growing up milk by high-performance liquid chromatograhy with evaporative light scattering detector[J]. J Aoac Int, 010, 93(3): 948. |
| [15] |
石丹, 王晓彦, 魏显纲, 等. 高效液相色谱检测奶粉中磷脂酰丝氨酸分析方法的建立[J]. 营养学报, 2015, 37(1): 88. SHI D, WANG XY, WEI XG, et al. Establishment of analytical method for detection of phosphatidylserine in mlik powder by high performance liquid chromatography[J]. Acta Nutrim Sina, 2015, 37(1): 88. |
 2017, Vol. 37
2017, Vol. 37 
