2. 吉林省人参工程技术研究中心, 长春 130118
2. Ginseng Engineering Technology Research Center of Jilin Province, Changchun 130118, China
鹿角脱盘为鹿科动物梅花鹿(Cervus nippon Temminck)或马鹿(Cervus elaphus Linnaeus)锯茸后翌年春季脱落的角基,呈盘状,又称“珍珠盘”、“鹿角帽”、“鹿花盘”,与鹿角属一物,《神农本草经》中列为上品,具有温补肾阳,强筋骨,行血消肿之功效;因其骨化程度高,质地坚硬,所以不宜直接使用,需经过适当的方法对其有效部位进行提取,提高其利用效率,使其更好地发挥疗效[1-2]。基于传统单一的水煎煮法,本实验采用盐酸、氢氧化钠、生理盐水、75%乙醇和蒸馏水对鹿角脱盘进行加热提取,获得鹿角脱盘5种提取部位。
鹿角脱盘主要化学成分有蛋白质、矿质元素、氨基酸、多糖、脂质类、胆固醇等,有研究显示其药用价值很大程度上取决于水解氨基酸的含量[3-4]。关于氨基酸的测定方法,文献报道的主要有柱前衍生高效液相色谱偶联紫外检测器法(HPLC-UV)、柱前衍生高效液相色谱偶联蒸发光散射检测器法(HPLC-ELSD)、柱前衍生超高效液相色谱串联质谱法(UPLC-MS)、高效薄层色谱(HPTLC)、离子色谱等,其中柱前衍生HPLC-UV法因同时具有成本低,操作简单,定量准确,检出限低,抗干扰能力强,灵敏度高和线性关系好等优点而被广泛采用[5-9]。因此,本文采用酸水解,异硫氰酸苯酯(PITC)柱前衍生RP-HPLC法检测鹿角脱盘及其提取部位中的氨基酸种类和含量,以期为鹿角脱盘的深加工提供理论依据和参考。
1 仪器与试剂 1.1 仪器LC-10AT高效液相色谱仪,SPD-10Avp紫外检测器(Shimadzu公司);N2000色谱工作站;博纳艾杰尔Venusil C18氨基酸专用分析柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶)氨基酸水解管(北京中科越洋科技有限公司);PB-10酸度计(Sartorius集团);透析袋MWCO:2 KD(Spectrum Laboratories公司);Alpha 1-4 LSC冷冻干燥机(Martin Christ公司)。
1.2 试剂鹿角脱盘粉末由长春市东大鹿业有限公司提供;乙腈、甲醇和正己烷为色谱纯(美国赛默飞世尔科技有限公司);纯净水(杭州娃哈哈有限公司);异硫氰酸苯酯(PITC)为分析纯(Sigma-Aldrich中国有限公司);21种氨基酸HPLC分析对照品[天冬氨酸(Asp)、谷氨酸(Glu)、天冬酰胺(Asn)、丝氨酸(Ser)、谷氨酰胺(Gln)、甘氨酸(Gly)、组氨酸(His)、精氨酸(Arg)、苏氨酸(Thr)、丙氨酸(Ala)、脯氨酸(Pro)、酪氨酸(Tyr)、缬氨酸(Val)、甲硫氨酸(Met)、胱氨酸(Cys & Cys)、半胱氨酸(Cys)、异亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe)、色氨酸(Trp)、赖氨酸(Lys)]均购自于上海源叶生物技术有限公司;其他试剂均为分析级。
2 方法与结果 2.1 鹿角脱盘5种提取部位的制备称取鹿角脱盘超微粉5份,每份10.00 g,分别用0.1 mol·L-1盐酸溶液、0.1 mol·L-1氢氧化钠溶液、0.9%生理盐水、75%乙醇水溶液和蒸馏水以1:20(g·mL-1)料液比4 ℃条件下浸泡过夜,100 ℃提取3 h,滤过,鹿角脱盘酸提取液和碱提取液分别用1 mol·L-1氢氧化钠溶液和1 mol·L-1盐酸溶液调节pH 7.0,与鹿角脱盘盐提取液一起透析除盐,以水为透析缓冲液4 ℃条件下透析24 h,每12 h更换1次透析缓冲液,冻干,得酸溶液提取部位(A)、碱溶液提取部位(B)、盐溶液提取部位(C);鹿角脱盘醇提取液挥干乙醇后,冻干得醇溶液提取部位(D);鹿角脱盘水提取液直接冻干得鹿角脱盘水溶液提取部位(E)。
2.2 色谱条色谱柱:博纳艾杰尔Venusil C18氨基酸专用分析柱(4.6 mm×250 mm,5 μm);流动相:流动相A为乙腈-水(4:1),流动相B为0.1 mol·L-1乙酸钠溶液(乙酸调pH 6.5)-乙腈(97:3),梯度洗脱(0 min,100%B;11 min,98.5%B;21.7 min,92.4%B;23.9 min,89%B;27 min,86.6%B;39 min,70%B;42 min,30%B;45 min,0%B;52 min,0%B;55 min,100%B;70 min,100%B);流速:1 mL·min-1;检测波长:254 nm;柱温:36 ℃;进样量:20 μL。在上述条件下,各氨基酸分离度良好,见图 1。
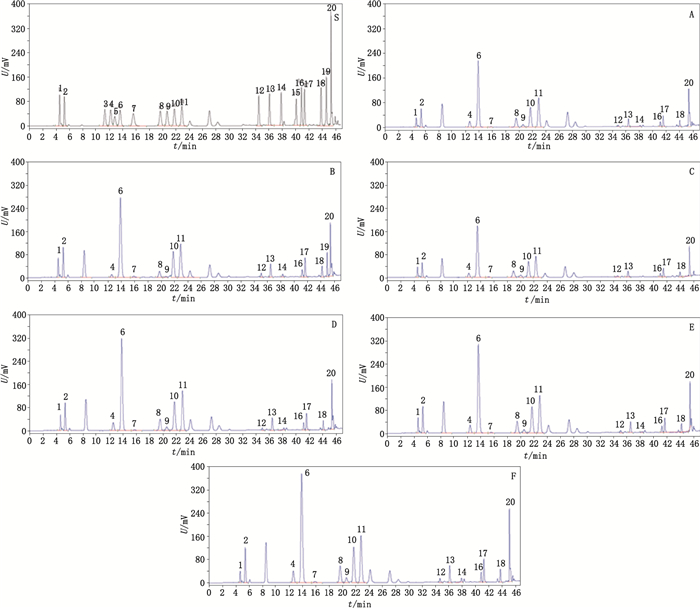
|
1. Asp 2. Glu 3. Asn 4. Ser 5. Gln 6. Gly 7. His 8. Arg 9. Thr 10. Ala 11. Pro 12. Tyr 13. Val 14. Met 15. Cys and Cys & Cys 16. Ile17. Leu 18. Phe 19. Trp 20. Lys 图 1 衍生后氨基酸对照品(S)、鹿角脱盘酸溶液提取部位(A)、碱溶液提取部位(B)、盐溶液提取部位(C)、醇溶液提取部位(D)、水提取部位(E)及鹿角脱盘原粉(F)色谱图 Figure 1 HPLC chromatograms of amino acid standard(S),the acid extraction(A),the alkali extraction(B),the salt extraction(C),the alcohol extraction(D),the water extraction(E)and powdered deer antler base(F)after derivatization |
精密称取Asp、Glu、Asn、Ser、Gln、Gly、His、Arg、Thr、Ala、Pro、Tyr、Val、Met、Cys & Cys、Cys、Ile、Leu、Phe、Trp和Lys 21种氨基酸对照品适量,加0.1 mol·L-1盐酸超声溶解,配制Cys & Cys浓度为0.625 μmol·mL-1,其他氨基酸浓度为1.25 μmol·mL-1的21种氨基酸混合对照品溶液。4 ℃保存。精密吸取上述混合对照品溶液500 μL,分别加入衍生剂A(精密量取PITC 2 mL,用乙腈定容至10 mL)125 μL和衍生剂B(精密量取三乙胺2 mL,用乙腈定容至10 mL)500 μL,室温暗处孵育1 h,加1 mL正己烷萃取2次,每次10 min,吸取下层溶液与20 μL醋酸溶液混合,0.45 μm滤膜滤过,即得。
2.4 水解氨基酸样品溶液的制备精确称取鹿角脱盘5种提取部位各30 mg和鹿角脱盘超微粉100 mg,置于酸解管中,采用酸水解法处理样品[10],加入6 mol·L-1盐酸10 mL,1%苯酚1 mL,抽真空充氮气(此过程重复3次),于110 ℃烘箱中水解24 h,80 ℃挥干盐酸,加入2 mL水重溶后挥干(此过程重复2次),尽可能除掉盐酸;加入适量水溶解后,以水定容于10 mL量瓶中,按“2.3”项所述方法衍生化,即得。
2.5 线性关系考察分别取衍生后的混合对照品溶液0.01、0.025、0.05、0.075、0.1、0.25、0.5、0.75、1 mL,分别加20%乙腈水溶液定容至1 mL,按“2.2”所述条件进行液相色谱分析。以各氨基酸衍生物峰面积Y为纵坐标,浓度X(μmol·mL-1)为横坐标,绘制标准曲线,计算回归方程,得21种氨基酸检测浓度范围0.001 9~2.700 0 μmol·mL-1,21种氨基酸线性回归方程见表 1。
|
|
表 1 21种氨基酸的线性回归方程、检测限和定量限(ng) Table 1 Linear regression equation, LOD and LOQ of 21 kinds of amino acids |
取衍生后的混合对照品溶液适量,用20%乙腈水溶液逐级稀释,进样测定,以信噪比3:1时确定21种氨基酸的检测限,信噪比10:1时确定21种氨基酸的定量限,结果见表 1。
2.7 精密度试验取衍生后的混合对照品溶液连续进样6次,测定峰面积。计算21种氨基酸峰面积的RSD,结果为0.61%~1.7%,表明仪器精密度良好。
2.8 稳定性试验取“2.4”项下水解氨基酸样品溶液500 μL,分别于0、2、4、6、8、10、12 h进样,测定峰面积。结果21种氨基酸峰面积RSD在0.79%~2.3%之间,表明供试品溶液在12 h内稳定性良好。
2.9 重复性试验取同一批鹿角脱盘粉按照“2.4”项下所述方法对样品进行酸解后衍生化,平行测定6次,测定峰面积,计算氨基酸含量。结果水解氨基酸含量的RSD在0.93%~2.5%之间,表明本方法重复性良好。
2.10 加样回收率试验精密称取已测得含量(Asp:0.446 1 mg;Glu:1.230 9 mg;Asn:0 mg;Ser:0.505 6 mg;Gln:0 mg;Gly:3.337 5 mg;His:0.148 9 mg;Arg:1.303 9 mg;Thr:0.329 4 mg;Ala:1.340 1 mg;Pro:1.900 5 mg;Tyr:0.193 7 mg;Val:0.432 6 mg;Met:0.180 8 mg;Cys and Cys & Cys:0 mg;Ile:0.251 4 mg;Leu:0.855 1 mg;Phe:0.411 2 mg;Trp:0 mg;Lys:0.690 7 mg)的鹿角脱盘超微粉50 mg,加入“2.3”项下混合对照品溶液1 mL,按照“2.4”项下所述方法对样品进行酸解后衍生化,进样测定,计算得21种氨基酸平均回收率在93.2%~102.8%之间,RSD在0.65%~2.6%之间。
2.11 样品含量测定取“2.4”项下制备的水解氨基酸样品溶液,进样测定。HPLC色谱图及氨基酸含量结果分别见图 1、表 2。
|
|
表 2 5种鹿角脱盘提取部位和鹿角脱盘粉氨基酸组成及含量(x±SD,n=3) Table 2 Amino acid composition and content in five extractions and powdered deer antler base |
用SPSS 19.0软件对所得数据进行单因素方差分析,不同提取部位同种氨基酸进行两两比较,以均值±标准差(x±SD)表示,P<0.05代表差异具有显著性,分析结果见表 2。
3 讨论与结论本实验建立了一种柱前衍生RP-HPLC检测21种氨基酸含量的方法,可有效分析水解蛋白质氨基酸组成情况,进而说明蛋白质特性;方法学考察结果表明,该方法准确可靠,适合鹿角脱盘及其提取部位氨基酸含量的测定。之前也有文章报道了21种氨基酸检测方法,但由于种类较多出现了多种氨基酸保留时间相同的情况[10-11],而本实验中除结构相似的胱氨酸和半胱氨酸保留时间相同外,其余19种氨基酸均得到很好的分离,使氨基酸定量更准确。另实验过程中酸性氨基酸Asp和Glu,在本方法梯度条件下最先被洗脱下来,但分离度并不好,通过加入适量醋酸可以提高两者分离度[12],经验证,醋酸与衍生后样品比例为1:25时分离效果最好。测定结果表明,鹿角脱盘粉、鹿角脱盘酸、醇和水提取部位中检测出了16种氨基酸,碱提取部位检测出17种氨基酸,盐提取部位检测出15种氨基酸,这是因为Gln和Asn在酸解过程中转化为Glu和Asp,所以在各样品中均未能检出,酸水解过程中Trp易被破坏,对Trp的检测通常采用碱水解酸中和法,碱提取部位检测出Trp,这可能与利用氢氧化钠进行提取有关[13-14]。与鹿角脱盘原粉相比,5种提取部位总氨基酸含量均显著提高(P<0.05),说明适当的提取,能够使鹿角脱盘中的氨基酸富集。同时,测定结果显示,各样品中甘氨酸占总氨基酸的比例在23.42%~27.53%之间,接近于氨基酸总量的30.00%,说明鹿角脱盘及其5种提取部位中的大部分氨基酸是由Ⅰ型胶原蛋白水解产生的[15-16]。
3.1 鹿角脱盘及其提取部位医学价值鹿角脱盘粉和5种提取部位中含量最高的4种氨基酸分别为Gly、Ala、Pro和Arg,其中Gly、Ala和Pro是2015年版中国药典中鹿角胶的质量标准之一[1]。鹿角脱盘水提物、醇提物和碱提物中Gly、Ala和Pro含量都高于药典鹿角胶的标准。鹿角脱盘及其5种提取部位药用氨基酸占总氨基酸均在60%以上,高于海参胶原蛋白的54.36%,说明鹿角脱盘及其提取部位均有很好的药用价值[17]。
3.2 鹿角脱盘及其提取部位营养学价值鹿角脱盘碱溶液提取部位的必需氨基酸与总氨基酸的含量比值和必需氨基酸与非必需氨基酸的含量比值分别为25.92%和34.99%,高于同类型的阿胶生品、炒品、海参胶原蛋白等[17-18];鹿角脱盘及其提取部位中Asp、Glu、Gly和Ala 4种呈味氨基酸占总氨基酸比例高于海参胶原蛋白的53.01%,说明鹿角脱盘及其提取部位有较好的营养价值[19-20]。
| [1] |
中国药典2015年版. 一部[S]. 2015: 321 ChP 2015.Vol Ⅰ[S].2015:321 |
| [2] |
包海鹰, 张颖悟, 邓明鲁. 国产鹿角的研究状况及开发前景[J]. 吉林农业大学学报, 1995(4): 96. BAO HY, ZHANG YW, DENG ML. Researching situation and exploiting prospects of antlers produced in China[J]. J Jilin Agric Univ, 1995(4): 96. |
| [3] |
WU FF, LI HQ, JIN LJ, et al. Deer antler base as a traditional Chinese medicine:a review of its traditional uses, chemistry and pharmacology[J]. J Ethnopharmacol, 2013, 145(2): 403. DOI:10.1016/j.jep.2012.12.008 |
| [4] |
赵卉, 刘继永, 王峰, 等. 鹿茸等五种鹿产品中氨基酸含量及组成对比分析[J]. 时珍国医国药, 2015, 26(5): 1056. ZHAO H, LIU JY, WANG F, et al. Comparative analysis of amino acid composition in velvet antler, deer blood, and other three kinds of deer products[J]. Lishizhen Med Mater Med Res, 2015, 26(5): 1056. |
| [5] |
芮鸿飞, 张晓瑜, 刘兴泉, 等. 柱前衍生-反相高效液相色谱法测定黄酒中游离氨基酸和生物胺[J]. 食品科学, 2016, 37(8): 159. RUI HF, ZHANG XY, LIU XQ, et al. Simultaneous determination of free amino acids and biogenic amines in Chinese rice wine by RP-HPLC with pre-column phenylisothiocyanate(PITC)derivatization[J]. Food Sci, 2016, 37(8): 159. DOI:10.7506/spkx1002-6630-201608028 |
| [6] |
王菲菲, 张聿梅, 马双成, 等. 高效薄层色谱、柱前衍生-超高效液相色谱和离子色谱分析疏血通注射液中游离氨基酸的比较[J]. 药学学报, 2016, 51(3): 439. WANG FF, ZHANG YM, MA SC, et al. Comparison study of determination methods of free amino acid in Shuxuetong injection by HPTLC, pre-column derivation-UPLC, and ion chromatography[J]. Acta Pharm Sin, 2016, 51(3): 439. |
| [7] |
缪潇瑶, 于静, 安叡, 等. 不同品种沙蚕中氨基酸含量的HPLC测定及多元统计分析[J]. 药物分析杂志, 2016, 36(1): 53. MIAO XY, YU J, AN R, et al. Determination of amino acid in different kinds of nereid by HPLC and the multivariate statistical analysis[J]. Chin J Pharm Anal, 2016, 36(1): 53. |
| [8] |
赫欣睿, 武中庸, 叶永丽, 等. 高效液相色谱法测定氨基酸的研究进展[J]. 分析测试学报, 2016, 35(7): 922. HE XR, WU ZY, YE YL, et al. Research progress on detection of amino acids by high performance liquid chromatography[J]. J Instrum Anal, 2016, 35(7): 922. |
| [9] |
WAHL O, HOLZGRABE U. Amino acid analysis for pharmacopoeial purposes[J]. Talanta, 2016, 154: 150. DOI:10.1016/j.talanta.2016.03.071 |
| [10] |
赵岩, 侯莹莹, 唐国胜, 等. 柱前衍生RP-HPLC测定淫羊藿中氨基酸含量[J]. 药物分析杂志, 2014, 34(8): 1412. ZHAO Y, HOU YY, TANG GS, et al. Determination of amino acids in Epimedium brevicornu Maxim.by RP-HPLC[J]. Chin J Pharm Anal, 2014, 34(8): 1412. |
| [11] |
赵岩, 唐国胜, 侯莹莹, 等. 柱前衍生RP-HPLC法测定狗尾草种子氨基酸含量[J]. 西北农林科技大学学报自然科学版, 2015, 43(9): 185. ZHAO Y, TANG GS, HOU YY, et al. Determination of amino acids in seeds of Setaria viridis(L.)Beauv by pre-column derivatization RP-HPLC[J]. J Northwest A & F Univ(Nat Sci Ed), 2015, 43(9): 185. |
| [12] |
陈萍红, 王书芳, 龚行楚. 柱前衍生RP-HPLC法测定阿胶中13种氨基酸[J]. 中草药, 2013, 44(14): 1995. CHEN PH, WANG SF, GONG HC. Determination of 13 amino acids in asini corri colla by RP-HPLC with precolumn derivatization[J]. Chin Tradit Herb Drugs, 2013, 44(14): 1995. |
| [13] |
丁永胜, 牟世芬. 氨基酸的分析方法及其应用进展[J]. 色谱, 2004, 22(3): 210. DING YS, MOU SF. Development of analytical methods for amino acids and their applications[J]. Chin J Chromatogr, 2004, 22(3): 210. |
| [14] |
周虹, 毛建霏, 罗玲, 等. 微波碱水解法测定农产品中色氨酸含量[J]. 食品与发酵科技, 2014, 50(3): 79. ZHOU H, MAO JF, LUO L, et al. Determination of tryptophane in agro-products via microwave alkalineh hydrolysis[J]. Food and Ferment Technol, 2014, 50(3): 79. |
| [15] |
何兰. 牛骨胶原蛋白的提取及复合海绵的制备研究[D]. 武汉: 华中农业大学, 2012 HE L.Study on Extract of Bovine Bone Collagen and Preparation of Composite Sponge [D].Wuhan:Huazhong Agriculture University, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10504-1012457770.htm |
| [16] |
LIU DS, LIANG L, REGENSTEIN JM, et al. Extraction and characterization of pepsin-solubilised collagen from fins, scales, skins, bones and swim bladders of bighead carp(Hypophthalmichthys nobilis)[J]. Food Chem, 2012, 133: 1441. DOI:10.1016/j.foodchem.2012.02.032 |
| [17] |
崔凤霞. 海参胶原蛋白生化性质及胶原肽活性研究[D]. 青岛: 中国海洋大学, 2007 CUI FX.Study on the Biochemical Characterization of Collagen and Activity of Collagen Peptide Extracted from the Body Wall of Sea Cucumber Stichopus japonicus [D].Qingdao:Ocean University of China, 2007 http://d.wanfangdata.com.cn/Thesis/Y1112233 |
| [18] |
崔金玉. 阿胶炮制工艺及质量控制研究[D]. 沈阳: 辽宁中医药大学, 2008 CUI JY.The Study of Processing Technology and Quality Control of Colla Corri Asini [D].Shenyang:Liaoning University of Traditional Chinese Medicine, 2008 http://cdmd.cnki.com.cn/Article/CDMD-10162-2009031827.htm |
| [19] |
任杰, 曹日亮, 武果桃, 等. 复方中药对猪肉中4种鲜味氨基酸含量的影响[J]. 养猪, 2014(6): 52. REN J, CAO RL, WU GT, et al. The impact of compound traditional Chinese medicine(TCM)on the change in flavor amino acids content in pork[J]. Swine Prod, 2014(6): 52. |
| [20] |
黄高凌, 王衍庆. 花蛤净化前后主要营养成分及鲜味氨基酸的比较[J]. 食品科学, 2006, 27(10): 477. HUANG GL, WANG YQ. Comparison of nutritious constituents and tasty amino acids of bivalve hemolymph both before and after purification[J]. Food Sci, 2006, 27(10): 477. DOI:10.3321/j.issn:1002-6630.2006.10.120 |
 2017, Vol. 37
2017, Vol. 37 
