生物胺是一类含氮的低分子量碱性有机化合物,根据氨基数目分为单胺与多胺两类。单胺主要有酪胺、苯乙胺、色胺、组胺等。一定量的单胺类化合物对血管和平滑肌有明显的收缩和舒张作用[1]。多胺类主要包括腐胺、尸胺、亚精胺与精胺。多胺在细胞增殖分化、核酸功能调节、蛋白质合成、脑发育、神经生长和再生的调控等方面起到重要的作用[2-4];多胺还具有抗氧化作用[5],特别是Eisenberg等[6]报道了亚精胺诱导自噬延长寿命的作用。他们发现在人体衰老过程中细胞内亚精胺浓度会降低;亚精胺可显著延长酵母、果蝇、线虫和人免疫细胞的寿命;此外,衰老小鼠给予亚精胺能有效抑制氧化应激反应。亚精胺通过抑制组蛋白乙酰转移酶(histone acetyltransferases,HAT)引起组蛋白H3的去乙酰化,从而抑制衰老酵母的氧化应激和坏死。相反,内源性亚精胺枯竭可导致高度乙酰化,而产生活性氧,引起早期死亡与减少寿命。Büttner等[7]通过研究建立的黑腹果蝇、秀丽隐杆线虫帕金森(PD)病理模型发现给药亚精胺能减轻一系列PD相关的退化过程。LaRocca等[8]研究表明,亚精胺对动脉有很强的抗衰老作用,通过增加一氧化氮生物利用度,减少氧化应激,改变结构因素以及增强自噬。何恩鹏等[9]研究发现,亚精胺可增加抗氧化酶的活性,减少自由基的积累,提高骨骼肌细胞膜代谢能力和抗损伤能力,显著推迟小鼠疲劳发生。
中医认为,气是维持机体生命活动的精微物质,气虚可导致机体的脏腑功能减退。补气药具有补五脏,安精神,长肌肉,耐寒暑,久服轻身延年之功效[10]。它们延缓衰老的作用是否与生物胺,特别是亚精胺有关值得研究。
由于大部分生物胺自身没有紫外吸收基团也没有荧光特性,因此目前对生物胺的研究主要是进行衍生化分析。生物胺的衍生试剂主要有丹磺酰氯(dansyl chloride)、邻苯二甲醛(o-phthalaldehyde)、苯甲酰氯(benzoyl chloride)、9-氯甲酸芴甲酯(9-fluorenylmethyl chloroformate)、6-氨基喹啉基-N-羟基琥珀酰亚胺基氨基甲酸脂(6-aminoquinolyl-N-hydroxysuccinimidyl carbamate)、4-氯-3,5-二硝基三氟甲苯(4-chloro-3,5-dinitrobenzotrifluoride)等[11-12]。丹磺酰氯应用最为普遍,具有反应快,操作方法简便,副产物少,衍生物稳定等优点,衍生物同时具有荧光特性和特异的紫外吸收,既可以用荧光检测,也可以用紫外检测[11-12]。RP-HPLC是检测生物胺的常用方法[11-12],因此,本文以丹磺酰氯为衍生试剂,柱前衍生化RP-HPLC法鉴别和测定白术、人参、红参、西洋参、党参、炒扁豆、刺五加、绞股蓝、红景天9种常用补气药中的生物胺类成分。
1 仪器与材料岛津公司LC-10AT高效液相色谱仪,配有Shimadzu LC-10A二元泵;岛津公司Shimadzu SPD-M10A DAD检测器;岛津公司Shimadzu CTO-10AS柱温箱;岛津公司Shimadzu色谱工作站;岛津公司Shimadzu shim-pack C18色谱柱(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶),岛津公司Shimadzu C18保护柱(12.5 mm×4.6 mm,5 μm)。常州国华电器有限公司SHA-C恒温振荡器;上海安亭科学仪器厂TDL-40B离心机;IKA公司VORTEX-3旋涡混合器;赛多利斯公司BP61S型精密电子天平(0.1 mg~61 g);上海精科雷磁公司PHS-3C精密pH计;Eppendorf公司微量移液枪。
甲胺(methylamine)、色胺(tryptamine)、2-苯乙胺(2-phenylethylamine)、腐胺二盐酸盐(putrescine dihydrochloride)、尸胺二盐酸盐(cadaverine dihydrochloride)、组胺二盐酸盐(histamine dihydrochloride)、5-羟色胺盐酸盐(serotonin hydrochloride)、酪胺(tyramine hydrochloride)、亚精胺三盐酸盐(spermidine trihydrochloride)、多巴胺盐酸盐(dopamine hydrochloride)、精胺四盐酸盐(spermine tetrahydrochloride),均购自Sigma-Aldrich公司(美国),纯度均大于98%。
内标1,7-二氨基庚烷(1,7-diaminoheptane)购自Sigma-Aldrich公司(德国);衍生化试剂丹磺酰氯(dansyl chloride)购自Sigma-Aldrich公司(美国)。乙腈为色谱纯,水为双蒸水,其余试剂为分析纯。
白术(Atractylodes macrocephala Koidz.)、人参(Panax ginseng C. A. Mey.)、红参(Panax ginseng C. A. Mey.的蒸制品)、西洋参(Panax quinquefolium L.)、党参[Codonopsis pilosula(Franch.)Nannf.]、炒扁豆(Dolichos lablab L.的炒制品)、刺五加[Acanthopanax senticosus(Rupr. et Maxim.)Harms]、绞股蓝[Gynostemma pentaphllum(Thunb.)Makino]、红景天[Rhodiola crenulata(Hook. f. et Thoms.)H. Ohba]均购自北京同仁堂药店西安分店,经西北大学生命科学学院房敏峰教授鉴定为正品药材。
2 方法与结果 2.1 溶液的制备 2.1.1 内标溶液精密称取1,7-二氨基庚烷适量,用0.1 mol·L-1盐酸制成0.1 mg·mL-1的溶液,即得。
2.1.2 衍生剂溶液精密称取丹磺酰氯适量,用丙酮制成5 mg·mL-1的溶液,即得。
2.1.3 对照品工作溶液精密称取11个生物胺的对照品适量,分别置10 mL量瓶中,分别用0.1 mol·L-1盐酸溶解并稀释至刻度,摇匀,制成质量浓度为2.5 mg·mL-1(以各生物胺单体计)的对照品储备液。分别吸取各生物胺对照品储备液1.0 mL,置同一25 mL量瓶中,用0.1 mol·L-1盐酸稀释至刻度,摇匀,得0.1 mg·mL-1混合溶液;精密吸取此混合溶液0.010、0.025、0.050、0.100、0.250、0.500、1.000、2.500、5.000 mL,分别置10 mL量瓶中,用0.1 mol·L-1盐酸稀释至刻度,摇匀,制成质量浓度分别为0.10、0.25、0.50、1.00、2.50、5.00、10.00、25.00、50.00 mg·L-1的系列混合对照品溶液。
精密吸取上述系列混合对照品溶液0.5 mL,分别置5 mL量瓶中,依次加入内标溶液0.02 mL、衍生剂溶液0.5 mL与pH 10.5碳酸钠-碳酸氢钠缓冲溶液1 mL,混匀,60 ℃水浴反应45 min,放至室温,加入氨水0.1 mL,室温避光反应30 min,乙腈稀释至刻度,0.45 μm微孔滤膜过滤,取续滤液作为对照品工作溶液。
2.1.4 供试品溶液及空白对照溶液准确称取人参等9味药材各10 g,分别置100 mL具塞锥形瓶中,加入1 mol·L-1的盐酸30 mL和内标溶液0.1 mL,混匀,室温振荡提取60 min,过滤,滤液置50 mL离心管中,3 600 r·min-1离心10 min,取上清液置50 mL量瓶中,连续提取2次,合并上清液,用1 mol·L-1盐酸定容,得药材提取液。精密吸取药材提取液10 mL,置50 mL离心管中,用2 mol·L-1氢氧化钠溶液调pH至12,加入正丁醇-二氯甲烷(1:1,v/v)10 mL,涡旋振荡5 min,3 600 r·min-1离心10 min,吸取有机层,再重复2次,合并萃取液,加入1 mol·L-1盐酸1 mL混合后,40 ℃水浴氮气吹干,加入0.1 mol·L-1盐酸1 mL溶解,即得衍生化前的溶液。取此衍生化前的溶液0.5 mL,置5 mL量瓶中,不加内标溶液,按“2.1.3”项下自加“衍生剂溶液0.5 mL”起操作进行衍生化,即得供试品溶液;取衍生化前的溶液0.4 mL,置5 mL量瓶中,不加内标溶液,加入丙酮0.5 mL代替衍生剂溶液,按“2.1.3”项下自加“pH 10.5碳酸钠-碳酸氢钠缓冲溶液1 mL”起操作,即得空白对照溶液。
2.2 色谱条件色谱柱:Shimadzu C18分析柱(250 mm×4.6 mm,5 μm),Shimadzu C18保护柱(12.5 mm×4.6 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱(0~7 min,45%A→50%A;7~25 min,50%A→90%A;25~35 min,90%A;35~40 min,90%A→45%A);流速:0.8 mL·min-1;柱温:30 ℃;检测波长:254 nm;进样量:20 μL。内标与11个生物胺在选定的色谱条件下被有效分离,且人参等9味药中其他组分对11个生物胺与内标的测定均没有干扰,以人参为例见图 1。
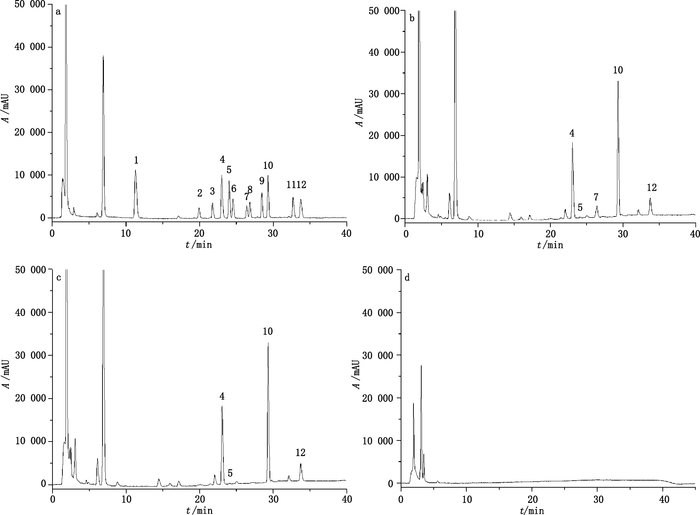
|
1.甲胺(methylamine,MET)2.色胺(tryptamine,TRP)3. 2-苯乙胺(2-phenylethylamine,PEA)4.腐胺(putrescine,PUT)5.尸胺(cadaverine,CAD)6.组胺(histamine,HIS)7. 1,7-二氨基庚烷(1,7-diaminoheptane,DMP)8. 5-羟色胺(serotonin,5-HT)9.酪胺(tyramine,TYR)10.亚精胺(spermidine,SPD)11.多巴胺(dopamine,DA)12.精胺(spermine,SPM) a. 10 mg·L-1对照品工作溶液(10 mg·L-1 working solution of reference substances)b.人参加内标(Ginseng Radix et Rhizoma spiked with internal standard)c.人参不加内标(Ginseng Radix et Rhizoma unspiked with internal standard)d.人参不加丹磺酰氯(Ginseng Radix et Rhizoma unspiked with dansyl chloride)a. 10 mg·L-1对照品工作溶液(10 mg·L-1 working solution of reference substances)b.人参加内标(Ginseng Radix et Rhizoma spiked with internal standard)c.人参不加内标(Ginseng Radix et Rhizoma unspiked with internal standard)d.人参不加丹磺酰氯(Ginseng Radix et Rhizoma unspiked with dansyl chloride) 图 1 11个生物胺衍生物的色谱图 Figure 1 Chromatograms of eleven biogenic amine derivatives |
精密吸取系列对照品工作溶液20 μL进样测定,以11个生物胺质量浓度(X)为横坐标,各生物胺与内标衍生物的峰面积比值(Y)为纵坐标,建立标准曲线,用加权最小二乘法计算标准曲线的回归方程及相关系数。以信噪比(S/N)为3:1作为检测限(LOD),以信噪比(S/N)为10:1作为定量限(LOQ),结果见表 1。甲胺、尸胺、组胺、亚精胺与精胺质量浓度在0.10~10.00 mg·L-1范围内线性关系良好;色胺与腐胺质量浓度在0.10~50.00 mg·L-1范围内线性关系良好;2-苯乙胺、5-羟色胺、酪胺与多巴胺质量浓度在0.25~10.00 mg·L-1范围内线性关系良好。各生物胺的检测下限在0.015~0.075 mg·L-1之间,定量下限在0.05~0.25 mg·L-1之间。
|
|
表 1 11个生物胺的保留时间、线性方程、线性范围、相关系数、检测限及定量限 Table 1 Retention time, linear equation, linear range, correlation coefficient, limits of detection and quantification of eleven biogenic amines |
取10 mg·L-1对照品工作溶液,当日内平行进样5次,计算各生物胺衍生物峰面积的RSD,求得日内精密度;连续测定3 d,每天平行进样5次,计算各生物胺衍生物峰面积的RSD,求得日间精密度。结果甲胺、色胺、2-苯乙胺、腐胺、尸胺、组胺、5-羟色胺、酪胺、亚精胺、多巴胺、精胺11个生物胺的日内精密度(n=5)分别为0.83%、0.91%、1.2%、2.4%、1.0%、1.2%、1.4%、0.61%、1.5%、0.99%和1.8%;日间精密度(n=15)分别为2.2%、1.5%、1.9%、4.0%、1.6%、2.4%、2.0%、0.88%、2.4%、2.6%和3.6%。
2.5 重复性试验以绞股蓝为例,取同一批绞股蓝药材5份,按“2.1.4”项下方法制得供试品溶液,进样分析。甲胺、腐胺、尸胺、酪胺、亚精胺、精胺的平均含量(n=5)分别为2.36、14.15、1.59、3.02、9.61、5.05 µg·g-1,RSD分别为3.6%、4.1%、4.0%、5.0%、4.6%、3.9%。其余8味药材按上述方法进行重复性试验,结果各生物胺含量的RSD(n=5)均小于5.0%。表明方法重复性良好。
2.6 稳定性试验以绞股蓝为例,取同一绞股蓝供试品溶液,室温放置,分别于0、2、4、6、8、12、24 h进样分析,结果甲胺、腐胺、尸胺、酪胺、亚精胺、精胺峰面积的RSD(n=5)分别为0.47%、0.51%、0.59%、0.49%、0.65%、0.55%。其余8味药材按上述方法进行稳定性试验,结果各生物胺峰面积的RSD(n=5)均小于5.0%。表明9味药材供试品溶液在室温下24 h稳定。
2.7 回收率试验以人参与绞股蓝为例,取已知含量人参和绞股蓝药材各15份,每份5.0 g,精密称定,分别精密加入1、5、10 mg·L-1混合对照品溶液4.0 mL,每个浓度5份,按“2.1.4”项下方法,制得供试溶液,进样分析,计算生物胺的含量;以回收率=(实测值-已知量)/加入量×100%,计算各生物胺的加样回收率,结果见表 2。其余7味药材按上述方法进行回收率试验。结果9味药材中各生物胺的加样回收率在70.4%~96.3%之间。
|
|
表 2 11个生物胺的加标回收率(mean ± RSD,%,n =5) Table 2 Recoveries of eleven biogenic amines in spiked samples |
取5批9味药材,制备供试品溶液,进样分析,记录各生物胺峰面积,采用内标法,以回归方程计算各生物胺含量,结果见表 3。
|
|
表 3 9味补气药中生物胺含量(mean±SD,µg·g-1,n=5) Table 3 The contents of biogenic amines in nine kinds of Chinese Tonic-Qi herbs |
结果表明白术、党参、炒扁豆中均含有甲胺、腐胺、尸胺、亚精胺与精胺;人参、刺五加中均含有腐胺、尸胺、亚精胺与精胺;红参中均含有腐胺、亚精胺与精胺;西洋参中含有腐胺、尸胺、组胺、亚精胺与精胺;绞股蓝中含有甲胺、腐胺、尸胺、酪胺、亚精胺与精胺;红景天中含有甲胺、腐胺与亚精胺。9种补气药中亚精胺含量均较高,含量从高到低依次是人参、西洋参、炒扁豆、绞股蓝、党参、刺五加、红景天、白术、红参(图 2)。9种补气药中,除红景天外,其余8味药均含有精胺,且炒扁豆中含量最高,达(34.66±2.79)µg·g-1。
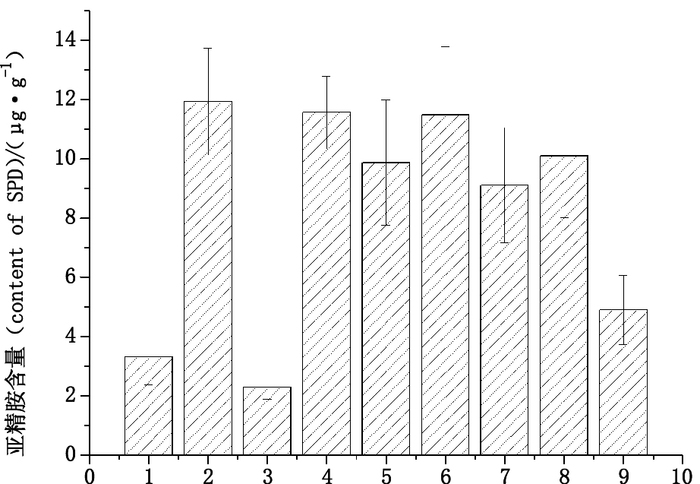
|
1.白术(Atractylodis Macrocephalae Rhizoma)2.人参(Ginseng Radix et Rhizoma)3.红参(Ginseng Radix et Rhizoma Rubra)4.西洋参(Panacis Quinquefolii Radix)5.党参(Codonopsis Radix)6.炒扁豆(Stir-baked Lablab Semen Album)7.刺五加(Acanthopanacis Senticosi Radix et Rhizoma Seu Caulis)8.绞股蓝(Rhizoma Seu Herba Gynostemmatis)9.红景天(Rhodiolae Crenulatae Radix et Rhizoma) 图 2 9味补气药中亚精胺的含量 Figure 2 The content of spermidine in nine kinds of Chinese Tonic-Qi herbs |
样品中各生物胺衍生物峰是通过与生物胺对照品衍生物峰的保留时间比较来鉴别,结合质谱并通过在白术等9味药材的供试品溶液中加入对照品工作溶液以测得相应的色谱峰值升高,及更换流动相体系以样品中各生物胺的衍生物与生物胺对照品的衍生物相应的色谱峰变化一致来确证。
本文所建立的柱前衍生化RP-HPLC法[13]可鉴别及测定了9种补气药中的生物胺。本方法具有灵敏度高,测定结果准确、稳定性好等优点,可用于中药中生物胺类成分的鉴别与测定。
3.2 9味补气药中生物胺的含量9味补气药中均含有生物胺类成分,但成分种类又各不相同。在所分析的9味补气药中主要含有腐胺、亚精胺与精胺,部分药含有甲胺与尸胺,仅极个别药含有组胺与酪胺。据我们所知这是首次发现白术、人参、红参、西洋参、党参、炒扁豆、刺五加、绞股蓝、红景天中含有这些生物胺。
9味补气药中均含有较高含量的亚精胺。中医认为,衰老首要是因肾虚,其次是脾虚,再次是气血两虚。故补肾、健脾、益气是延缓衰老的基本途径,活血化瘀是延缓衰老的主要方法[14]。补气药具有补五脏,安精神,长肌肉,耐寒暑,久服轻身延年之功效。而人参、西洋参、党参、白扁豆、刺五加、绞股蓝、红景天、白术等补气药都是著名的抗衰老中药,且具有一定的抗疲劳功效[15]。这与亚精胺所具有的抗衰老与抗疲劳作用[6-9]是一致的。因此,亚精胺应该是补气药抗衰老延年益寿作用的关键有效成分之一。
| [1] |
HALÁSZ A, BARÁTH Á, SIMON-SARKADI L, et al. Biogenic amines and their production by microorganisms in food[J]. Trends Food Sci Technol, 1994, 5(2): 42. DOI:10.1016/0924-2244(94)90070-1 |
| [2] |
SILLA SANTOS MH. Biogenic amines:their importance in foods[J]. Inter J Food Microbiol, 1996, 29(2-3): 213. DOI:10.1016/0168-1605(95)00032-1 |
| [3] |
TASSONI A, GERMANA MA, BAGNI N. Free and conjugated polyamine content in Citrus sinensis Osbeck, cultivar brasilino N.L.92, a navel orange, at different maturation stages[J]. Food Chem, 2004, 87(4): 537. DOI:10.1016/j.foodchem.2004.01.001 |
| [4] |
KALAČ P, KRAUSOVÁ P. A review of dietary polyamines:formation, implications for growth and health and occurrence in foods[J]. Food Chem, 2005, 77(1-2): 219. |
| [5] |
YEN GC, KAO HH. Antioxidative effect of biogenic amine on the peroxidation of linoleic acid[J]. Biosci Biotechnol Biochem, 1993, 57(1): 115. DOI:10.1271/bbb.57.115 |
| [6] |
EISENBERG T, KNAUER H, SCHAUER A, et al. Induction of autophagy by spermidine promotes longevity[J]. Nat Cell Biol, 2009, 11(11): 1305. DOI:10.1038/ncb1975 |
| [7] |
BÜTTNER S, BROESKAMP F, SOMMER C, et al. Spermidine protects against α-synuclein neurotoxicity[J]. Cell Cycle, 2014, 13(24): 3903. DOI:10.4161/15384101.2014.973309 |
| [8] |
LAROCCA TJ, GIOSCIA-RYAN RA, HEARON CM, et al. The autophagy enhancer spermidine reverses arterial aging[J]. Mech Ageing Dev, 2013, 134(7-8): 314. DOI:10.1016/j.mad.2013.04.004 |
| [9] |
何恩鹏, 汤莉莉, 郭玉江. 亚精胺对小鼠骨骼肌自由基代谢及抗疲劳效果研究[J]. 食品科学, 2014, 35(9): 229. HE EP, TANG LL, GUO YJ. Influence of spermidine on free radical metabolism in skeletal muscle and its anti-fatigue effect in mice[J]. Food Sci, 2014, 35(9): 229. DOI:10.7506/spkx1002-6630-201409045 |
| [10] |
张恩户, 张琪, 胡锐. 补气药延缓衰老抗氧化机制的文献再评价[J]. 环球中医药, 2011, 4(6): 490. ZHANG EH, ZHANG Q, HU R. Review on anti-oxidant effect of Chinese Tonic-Qi herbs[J]. Global Tradit Chin Med, 2011, 4(6): 490. |
| [11] |
ÖNAL A. A review:Current analytical methods for the determination of biogenic amines in foods[J]. Food Chem, 2007, 103(4): 1475. DOI:10.1016/j.foodchem.2006.08.028 |
| [12] |
ORDÓÑEZ JL, TRONCOSO AM, GARCÍA-PARRILLA MDC, et al. Recent trends in the determination of biogenic amines in fermented beverages-A review[J]. Anal Chim Acta, 2016, 939: 10. DOI:10.1016/j.aca.2016.07.045 |
| [13] |
张宁, 王翠玲, 侯宝龙, 等. 柱前衍生化RP-HPLC法鉴别及测定麻黄中的生物胺类成分[J]. 药物分析杂志, 2015, 35(3): 389. ZHANG N, WANG CL, HOU BL, et al. Identification and determination of biogenic amines in Ephedrae Herba by RP-HPLC with pre-column derivatization[J]. Chin J Pharm Anal, 2015, 35(3): 389. |
| [14] |
孙晓生, 杨柳. 抗衰老机制与药物的研究进展[J]. 广州中医药大学学报, 2009, 26(6): 593. SUN XS, YANG L. Advances in the study of anti-aging mechanism and drugs[J]. J Guangzhou Univ Tradit Chin Med, 2009, 26(6): 593. |
| [15] |
崔换天, 王丽, 王洪武, 等. 常用抗疲劳中药作用机制及研究进展[J]. 吉林中医药, 2015, 35(4): 415. CUI HT, WANG L, WANG HW, et al. Mechanisms of anti-fatigue Chinese medicine[J]. Jilin J Tradit Chin Med, 2015, 35(4): 415. |
 2017, Vol. 37
2017, Vol. 37 
