2. 中药制药过程新技术国家重点实验室, 连云港 222001;
3. 北京大学药学院天然药物学系, 北京 100191;
4. 大连工业大学食品学院, 大连 116034;
5. 西北农林科技大学生命科学学院, 杨凌 712100
2. State Key Laboratory of Pharmaceutical Process New-tech for Chinese Medicine, Lianyungang 222001, China;
3. School of Pharmaceutical Science, Peking University, Beijing 100191, China;
4. College of Food Science, Dalian Polytechnic University, Dalian 116034, China;
5. College of Life Sciences, Northwest Agriculture & Forestry University, Yangling 712100, China
龙血通络胶囊(原名为龙血通胶囊)是由中药龙血竭经提取精制获得酚类有效部位后制成的制剂,具有活血化瘀通络之功效,用于中风病中经络恢复期血瘀证的治疗。近年来,龙血通络胶囊处方中药味龙血竭的化学成分有了一定程度的研究,所含化学成分主要为酚类[1-6]、皂苷类[7-8]和甾醇类成分[9],但是经提取精制后的龙血通络胶囊化学成分尚未见报道。本文采用RRLC-Q-TOF MS方法,对龙血通络胶囊中化学成分进行鉴别和结构解析,为阐明该品种物质基础和提高质量控制水平提供实验基础。
1 仪器与试药Agilent 1290-6538 Q-TOF液质联用仪、电喷雾(ESI)离子源(Agilent公司);Kromasil C18色谱柱(150 mm×4.6 mm,3.5 μm;填料:十八烷基硅烷键合硅胶;Eka Chemicals公司);Mettler AE240电子分析天平(精度为万分之一)、Mettler XP-6电子(精度为百万分之一)(梅特勒公司);Centrifuge 5415D高速离心机(Eppendorf公司);KQ-250DB型超声波清洗仪(昆山超声仪器有限公司);Milli-Q Academic纯水机(密理博公司)。
对照品龙血素A(批号111660-200402)、龙血素B(批号111558-201407)、7,4′-二羟基黄酮(批号111787-201002)、白藜芦醇(批号111535-200502)、芹菜素(批号111901-201102)均购自中国食品药品检定研究院;7-羟基黄酮(批号229-705-3,质量分数大于97%)购自TCI公司;紫檀茋(批号20110723,质量分数大于99%)购自杭州广林生物医药科技有限公司;甘草素(批号MUST-15021104,质量分数99.07%)购自成都曼斯特公司;对照品10-羟基-11-甲氧基龙血酮为大连工业大学朱靖博老师赠送,HPLC面积归一化法计算质量分数均大于98%;对照品2,6-二甲氧基-4,4′-二羟基二氢查耳酮、2-甲氧基-4,4′-二羟基二氢查耳酮、7,4′-二羟基高异黄烷、7,4′-二羟基-8-甲氧基高异黄烷、2,6-二甲氧基-4′-羟基二氢查耳酮、4,4′-二羟基-3′-甲氧基查耳酮为实验室自制,经波谱(LC-MS和NMR)进行结构确证,HPLC面积归一化法计算质量分数均大于98%。
乙腈、甲酸为色谱纯,水为超纯水,其余试剂均为分析纯。
龙血通络胶囊(批号150601)由江苏康缘药业股份有限公司生产。
2 方法 2.1 色谱条件采用Kromasil C18(150 mm×4.6 mm,3.5 μm)色谱柱,以乙腈(A)-0.1%甲酸水溶液(B)为流动相,梯度洗脱(0~18 min,25%A→40%A;18~33 min,40%A→45%A;33~45 min,45%A→95%A),流速1.0 mL·min-1(分流进入质谱接口的流速约为0.4 mL·min-1),柱温30 ℃,进样量5 μL。
2.2 质谱条件采用ESI离子源,正、负离子扫描模式,毛细管电压4 kV,雾化气压力275.8 kPa,干燥气流速10 L·min-1,加热毛细管温度350 ℃,源内裂解电压135 V,质量扫描范围m/z 100~1 000,碰撞能量为15~30 V。
2.3 对照品溶液的制备取上述“1”项中15种对照品适量,分别加甲醇制成每1 mL含15 µg的单一对照品溶液。
2.4 供试品溶液的制备取龙血通络胶囊内容物,研细,取粉末约0.25 g,加70%乙醇水25 mL,超声提取(功率250 W,频率40 kHz)30 min,放冷,滤过,取续滤液过0.22 μm滤膜,即得。
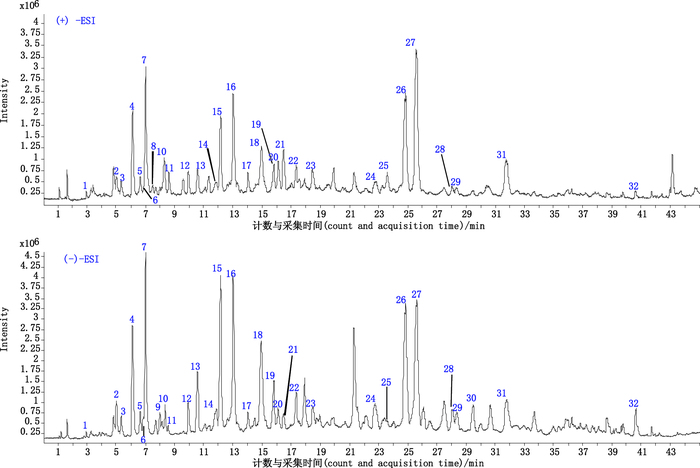
3 结果按“2.1”和“2.2”项中分析条件,龙血通络胶囊中化学成分能得到较好的分离,对其进行正、负离子模式分析,得到其RRLC-Q-TOF MS总离子流(TIC)色谱图(图 1)。本文采用的化合物鉴定基本流程:首先通过正负离子质谱信息、离子丰度等方法确定色谱峰的准分子离子,根据Q-TOF MS的精确相对分子质量及同位素分布情况得到分子式,结合文献报道[1-2, 10-15]推断出可能的候选化合物,再采用响应较好的离子模式进行Q-TOF MS/MS分析,结合Q-TOF MS/MS碎片信息、对照品裂解情况和文献进行推断。采用本法共鉴定出龙血通络胶囊中32个化合物,其中通过对照品数据推断出15个化合物,通过文献数据[1-3, 9-15]推断出17个化合物。具体结果如表 1所示。
|
图 1 龙血通络胶囊的RRLC-Q-TOF MS总离子流图 Figure 1 The total ion chromatograms of Longxue Tongluo capsules obtained by RRLC-Q-TOF MS |
|
|
表 1 龙血通络胶囊化学成分鉴定分析结果 Table 1 Identification results of chemical constituents in Longxue Tongluo capsules |
由表 1可知,龙血通络胶囊中含有多个黄酮类成分,其中大多数是黄酮苷元,包括黄酮、二氢黄酮、黄烷、高异黄烷、二氢查耳酮和黄酮二聚体。
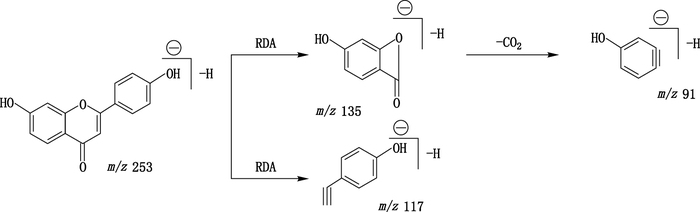
3.1.1 黄酮、二氢黄酮和黄烷酮的鉴定化合物4、5、14和17为黄酮,化合物18为二氢黄酮,化合物9为黄烷酮,化合物7为高异黄烷酮。一级扫描中产生[M+H]+和[M-H]-离子,实验选择灵敏度好、干扰小的[M-H]-离子进行MS/MS分析。黄酮苷元易中性丢失CO、CO2和发生Retro-Diels-Alder(RDA)裂解。以化合物4(7,4′-二羟基黄酮)为例,在负离子模式下,产生高丰度的m/z 253.05 [M-H]-,将此离子作为母离子进行MS/MS的碰撞诱导裂解,可进一步发生RDA裂解产生碎片离子峰m/z 135.01(C7H3O3)和117.04(C8H5O),m/z 135.01(C7H3O3)进一步中性丢失CO2产生m/z 91.02(C6H3O),其裂解路径见图 2,化合物5、14和17发生类似裂解。化合物5含有甲氧基,易丢失CH3·产生m/z 268.04的离子,然后中性丢失CO产生m/z 240.04的离子,同时发生与上述黄酮一致的RDA裂解,根据文献[10-12]将其鉴定为7,3′-二羟基-4′-甲氧基黄酮。
|
图 2 7,4′-二羟基黄酮RDA裂解途径示意图 Figure 2 Fragmentation pathways of 7, 4′-dihydroxyflavone |
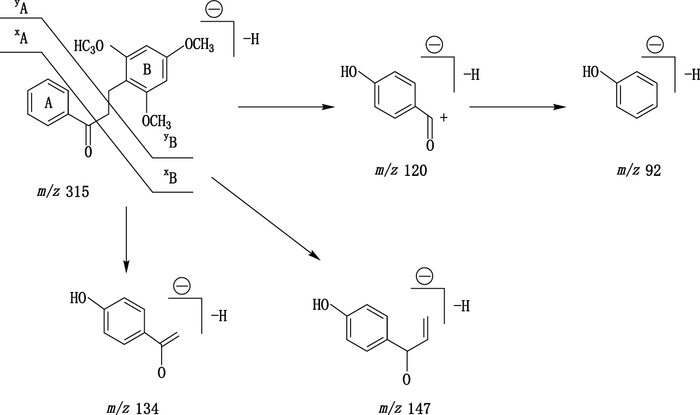
化合物1、3、10、12、13、15、16、22、25、26和27在一级扫描中产生较强[M+H]+和[M-H]-离子,实验选择灵敏度好、干扰小的[M-H]-离子进行MS/MS分析,该类化合物在进行MS2分析时A环与B环之间的连接键易发生断裂。以龙血素B(化合物27)为例,龙血素B在UPLC-Q-TOF MS下产生高丰度的m/z 317.14 [M+H]+和m/z 315.12 [M-H]-,以[M-H]-离子进行MS2分析,主要碎片离子为m/z 147.04(C9H7O2)、134.04(C8H6O2)、120.02(C7H4O2)和92.03(C6H4O),其裂解路径见图 3。其他化合物发生类似裂解,根据对照品比对情况和文献[2, 9-10, 13]报道判断化合物10、15、16、22、25、26和27为二氢查耳酮,化合物1为二氢查耳酮变体,化合物3、12和13为查耳酮,详见表 1。
|
图 3 龙血素B裂解途径示意图 Figure 3 Proposed fragmentation pathways for loureinin B in the negative ion mode |
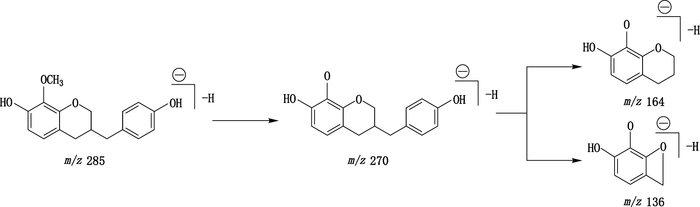
化合物2、20、21和24为高异黄烷,化合物8为1个变形的高异黄烷,在UPLC-Q-TOF MS下产生[M+H]+和[M-H]-,其裂解途径主要为RDA裂解,与“3.1.1”项黄酮类化合物类似。以7,4′-二羟基-8-甲氧基高异黄烷(化合物21)为例,因含有甲氧基,易丢失CH3·产生m/z 270.09 [M-H-CH3·]-,然后发生RDA裂解或在C3-C9位发生苄基的断裂,其裂解路径见图 4。
|
图 4 7,4′-二羟基-8-甲氧基高异黄烷裂解途径示意图 Figure 4 Proposed fragmentation pathways for 7, 4′-dihydroxy-8-methoxy homoisoflavan in the negative ion mode |
根据UPLC-Q-TOF MS正负离子情况结合文献[2, 9, 15],初步判断化合物11、23、28、29、30和32为黄酮寡聚体。该类化合物除发生2个苷元连接键的断裂外,主要裂解途径与其组成的苷元类似。以(2R)-8-methylsocotrin-4′-ol(化合物30)为例,其裂解路径见图 5。
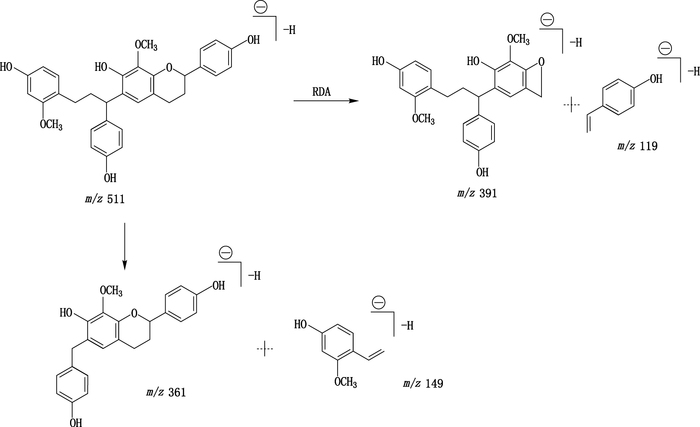
|
图 5 (2R)-8-methylsocotrin-4′-ol裂解途径示意图 Figure 5 Proposed fragmentation pathways for(2R)-8-methylsocotrin-4′-ol in the negative ion mode |
化合物6、19和31为二苯乙烯类化合物,在负离子模式下,均产生高丰度的[M-H]-离子,正离子模式下也能产生[M-H]+离子,但强度较弱,因此,选择[M-H]-做母离子用于获取碎片离子。白藜芦醇(化合物6)在二级碎裂过程中,两环依次丢失一分子的C2H2O而出现高丰度的碎片离子峰m/z 185.06(C12H9O2)和m/z 143.05(C10H7O),其裂解途径见图 6;化合物19和31的裂解过程与白藜芦醇相似,但是由于其含有甲氧基,故同时易丢失CH3·基团。
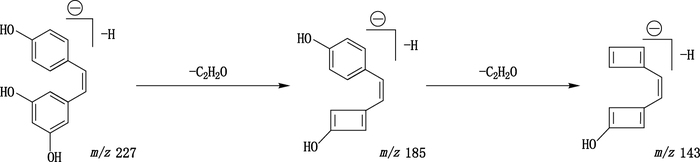
|
图 6 白藜芦醇裂解途径示意图 Figure 6 Proposed fragmentation pathways for resveratrol in the negative ion mode |
本试验供试品溶液的制备方法参考了文献[16],也考察了70%乙醇、50%乙醇和乙醇提取情况,结果50%乙醇提取效果稍差,乙醇与70%乙醇提取效果无明显差别,最终确定了本文的制备方法。通过对RRLC色谱条件进行考察和优化,使各色谱峰达到较好的分离,结合碎片分析及大量对照品的使用,能较好地区分龙血通络胶囊中存在的同分异构体。
采用上述方法对龙血通络胶囊中化学成分进行了质谱分析,结合对照品的裂解规律及文献报道,共鉴别出32个化合物,其中29个为黄酮类化合物,3个为二苯乙烯类化合物,15个化合物经对照品比对确证。本研究结果为后期开展龙血通络胶囊质量控制、作用机制与体内过程研究提供依据和可借鉴的分析方法。
| [1] |
SU XQ, SONG YL, ZHANG J, et al. Dihydrochalcones and homoisoflavanes from the red resin of Dracaena cochinchinensis(Chinese dragon's blood)[J]. Fitoterapia, 2014, 99: 64. DOI:10.1016/j.fitote.2014.09.006 |
| [2] |
ZHU YD, ZHANG P, YU HP, et al. Anti-helicobacter pylori and thrombin inhibitory components from Chinese dragon's blood, Dracaena cochinchinensis[J]. J Nat Prod, 2007, 70(10): 1570. DOI:10.1021/np070260v |
| [3] |
苏小琴, 李曼曼, 顾宇凡, 等. 龙血竭酚类成分研究[J]. 中草药, 2014, 45(11): 1511. SU XQ, LI MM, GU YF, et al. Phenolic constituents from Draconis Resina[J]. Chin Tradit Herb Drugs, 2014, 45(11): 1511. DOI:10.7501/j.issn.0253-2670.2014.11.002 |
| [4] |
屠鹏飞, 陶晶, 胡迎庆, 等. 龙血竭黄酮类成分研究[J]. 中国天然药物, 2003, 1(1): 27. TU PF, TAO J, HU YQ, et al. Flavones from the Wood Dracaena conchinchinensis[J]. Chin J Nat Med, 2003, 1(1): 27. |
| [5] |
秦建平, 李家春, 吴建雄, 等. 基于UPLC结合化学计量学方法的龙血竭指纹图谱研究[J]. 中国中药杂志, 2015, 40(6): 1114. QIN JP, LI JC, WU JX, et al. Fingerprint analysis of Resina Draconis from different manufacturers by UPLC coupled with chemometrics[J]. China J Chin Mater Med, 2015, 40(6): 1114. |
| [6] |
ZHENG QG, LI HZ, ZHANG YJ, et al. Flavonoids from the resin of Dracaena cochinchinensis[J]. Helv Chim Acta, 2004, 87: 1167. DOI:10.1002/(ISSN)1522-2675 |
| [7] |
ZHENG QA, ZHANG YJ, LI HZ, et al. Steroidal saponins from fresh stem of Dracaena cochinchinensis[J]. Steroids, 2004, 69(2): 111. DOI:10.1016/j.steroids.2003.11.004 |
| [8] |
高嫄, 普德兵, 李蓉涛, 等. 龙血竭形成过程中甾体皂苷成分的变化[J]. 云南中医中药杂志, 2014, 35(6): 75. GAO Y, PU DB, LI RT, et al. Changes of steroidal saponins in the formation of Sanguis Draconis[J]. Yunnan J Tradit Chin Med Mater Med, 2014, 35(6): 75. |
| [9] |
刘芳, 戴荣继, 吕芳, 等. 龙血竭总酚提取物化学成分的分离鉴定[J]. 北京理工大学学报, 2014, 34(1): 102. LIU F, DAI RJ, LÜ F, et al. Isolation and structural identification of compounds from total phenols extract of dragon's blood[J]. Trans Beijing Inst Technol, 2014, 34(1): 102. |
| [10] |
YANG WZ, YE M, QIAO X, et al. Collision-induced dissociation of 40 flavonoid aglycones and differentiation of the common flavonoid subtypes using electrospray ionization ion-trap tandem mass spectrometry and quadrupole time-of-flight mass spectrometry[J]. Eur J Mass Spectrom, 2012, 18(6): 493. DOI:10.1255/ejms.1206 |
| [11] |
LIU RX, YE M, GUO HZ, et al. Liquid chromatography/electrospray ionization mass spectrometry for the characterization of twenty-three flavonoids in the extract of Dalbergia odorifera[J]. Rapid Commun Mass Spectrom, 2005, 19(11): 1557. DOI:10.1002/(ISSN)1097-0231 |
| [12] |
韦宏, 文东旭, 刘晓松, 等. 广西血竭石油醚和醋酸乙酯部位中的化学成分(Ⅱ)[J]. 中国中药杂志, 1998, 23(10): 616. WEI H, WEN DX, LIU XS, et al. Constituents in petroleun ether and ethyl acetate extract fractions of Dracaena cochinensis(Lour.)S.C.Chen[J]. China J Chin Mater Med, 1998, 23(10): 616. DOI:10.3321/j.issn:1001-5302.1998.10.017 |
| [13] |
周宏志, 王锦亮, 杨崇仁. 剑叶血竭素—国产血竭中一个新的二聚查尔酮[J]. 药学学报, 2001, 36(3): 200. ZHOU ZH, WANG JL, YANG CR. Cochinchinenin—a new chalcone dimmer from the Chinese dragon blood[J]. Acta Pharm Sin, 2001, 36(3): 200. |
| [14] |
ZHENG QA, ZHANG YJ, YANG CR. A new meta-homoisoflavan from the fresh stems of Dracaena cochinchinensis[J]. J Asian Nat Prod Res, 2006, 8(6): 571. DOI:10.1080/1028602042000204126 |
| [15] |
QIAN H, SAITO Y, MATSUO Y, et al. Chalcane-stilbene conjugates and oligomeric flavonoids from Chinese dragon's blood produced from Dracaena cochinchinensis[J]. Phytochemistry, 2015, 119: 76. DOI:10.1016/j.phytochem.2015.09.009 |
| [16] |
秦建平, 吴建雄, 李家春, 等. 不同产地龙血竭中5种成分的HPLC法测定[J]. 现代药物与临床, 2013, 28(4): 547. QIN JP, WU JX, LI JC, et al. Determination of five components in Draconis Resina from different habitats by HPLC[J]. Drugs Clin, 2013, 28(4): 547. |
 2017, Vol. 37
2017, Vol. 37 
