2. 黑龙江中医药大学 药学院, 哈尔滨 150040;
3. 辽宁省天然产物制药工程技术研究中心, 沈阳 110036
2. Heilongjiang University of Chinese Medicine, College of pharmacy, Harbin 150040, China;
3. Natural Products Pharmaceutical Engineering Technology Research Center of Liaoning Province, Shenyang 110036, China
虫草素(cordycepin)又称冬虫夏草素、虫草菌素、蛹虫草菌素,是一种具有广泛生物活性和药理作用的脱氧核苷类似物,也是第一个从真菌中分离出来的核苷类抗菌素[1-2]。早在1951年Cunningham等[3]从Cordyceps militaris原浆液中分离得到一种抗菌性物质,定名为虫草素,并在Nature上发表。该物质后被证实是我国中药冬虫夏草(Cordyceps sinensis)的有效成分[4]。虫草素在中医医理上具有与冬虫夏草一样的阴阳同补和双向调节人体平衡的功能。从西医医理角度看[4-6],虫草素具有抗肿瘤,抗衰老,抗菌,抗病毒,免疫调节,改善新陈代谢,清除自由基等多种药理作用,有良好的临床应用前景。目前虫草素的研究现正成为药物化学、抗衰老、美容、保健品领域中一个极其活跃的领域[7]。
在中药化学成分和药物的吸收、分布、代谢、排泄、毒性与药效(简称ADMET/Act.)研究平台建立过程中,通过文献[8-10]研究,我们建立了体外虫草素肝微粒体温孵培育法模拟人体肝微粒体药物代谢,研究中药化学成分的生物转化,通过液质联用的检查方法,确定虫草素在肝微粒体中的代谢产物,从而为探索其在肝脏中的代谢途径,转化规律以及临床研究提供参考,进而更科学地指导临床用药。同时为研究虫草素的体内外代谢奠定方法学基础,并为规模化制备虫草素的代谢产物提供方法。
1 材料与方法 1.1 仪器与试剂安捷伦1200高效液相色谱仪(Agilent公司),安捷伦1260高效液相色谱仪(Agilent公司),布鲁克7.0 T FT-ICR质谱系统(Bruker公司),沃特世高效液相色谱仪系统及Waters LCT Premier XE系统(Waters公司),DiamonsilTM ODS C18色谱(250 mm×4.6 mm,5 µm;填料:十八烷基硅烷键合硅胶;迪马公司),TGL-20M台式离心机(转速2 0000 r·min-1,1.5 mL,湖南湘仪离心机仪器有限公司),AL204电子天平(梅特斯-托利多仪器(上海)有限公司),HZQ-Q全温震荡器(哈尔滨市东联电子技术开发有限公司),RE 52-99旋转蒸发仪(上海亚荣生化仪器厂),KQ5200E型超声波清洗器(昆山市超声仪器有限公司)。
氧化型辅酶Ⅱ(NADP)和还原型辅酶Ⅰ(NADH)购自上海如吉生物技术发展有限公司;6-磷酸葡萄糖(G-6-P)和6-磷酸葡萄糖脱氢酶(G-6-P DH)购自南京都莱生物公司;三(羟甲基)氨基甲烷(Tris)购自国药集团化学试剂有限公司;BSA标准品(纯度≥98%)购自Sigma公司;盐酸,甲醇(分析纯)、甲醇(色谱纯)购自山东禹王实业有限公司化工分公司;氯化镁(带6个结晶水,MgCl2·6H2O)购自天津市瑞金特化妆品有限公司;苯巴比妥钠注射液购自沈阳市第四人民医院;虫草素本实验室自制[11-13],其化学结构经光谱和波谱学鉴定[14],纯度≥98%。虫草素是由3′-脱氧核糖和腺苷脱水缩合形成C-N苷键构成,见图 1。

|
图 1 虫草素的化学结构式 Figure 1 Chemical structure of Cordycepin |
体质量(250±10)g,雄性SD大鼠由辽宁长生生物科技有限公司提供,8周龄,合格证号211002300007964。无病原体,在室温20~26 ℃,12:12 h昼夜循环下饲养。除实验前24 h禁食(但仍给水)外,其余正常进食。
1.3 实验方法 1.3.1 大鼠肝微粒体的制备及其蛋白浓度测定SD大鼠按60 mg·kg-1剂量腹腔注射苯巴比妥生理氯化钠溶液,每天1次,连续3 d。最后24 h禁食,拉颈椎处死,开腹取肝脏,用滤纸吸干水分,称质量。按文献报道的二次离心法制备肝微粒体[11],用Lowry法测定肝微粒体蛋白浓度[12]。取BSA标准品适量,加水稀释成0、64.0、128.0、192.0、256.0、320.0 µg·mL-1的标准蛋白溶液,在660 nm处测定紫外吸收,每个浓度平行操作3份,绘出工作曲线。然后将待测肝微粒体蛋白用水稀释100倍后,取0.5 mL在同样条件下测定,由工作曲线得出未知蛋白的含量。
1.3.2 虫草素肝微粒体的温孵培养采用表 1的NADP再生体系[13-15],进行多组组合实验,根据HPLC色谱行为分析原形及其代谢产物,比较代谢效果,选出最佳代谢体系。转化体系为2 mL,按照培养体系分别添加各种辅酶至pH 7.4,0.05 mol·L-1的Tris-HCl缓冲液中,放入预热好的37 ℃全温振荡器温孵5 min,再加入虫草素0.2 mg,开始反应。反应过程中,每20 min在液面上通氧气30 s,30 min后将培养瓶从振荡器中取出,迅速加入冷的6 mL甲醇终止代谢反应,即得温孵产物。
|
|
表 1 NADPH再生系统条件的优化 Table 1 Optimization of NADP regeneration system conditions |
温孵产物涡旋振荡30 s,离心(转速5 000 r·min-1)10 min,准确吸取上清液,在氮气下吹干后,残留物用1 mL甲醇复溶,涡旋振荡后,离心(5 000 r·min-1)10 min,吸取上清液,过0.22 µm微孔滤膜,进样10 µL进行HPLC-DAD以及HPLC-MS检测。
1.3.4 HPLC-DAD检测条件温孵产物按“1.3.3”项下方法进行样品处理后,经HPLC-DAD研究代谢情况。具体条件:采用安捷伦1200高效液相色谱仪,DiamonsilTM ODS C18色谱(250 mm×4.6 mm,5 µm),以甲醇-水(15:85)为流动相,流速0.5mL·min-1,检测波长260 nm,洗脱时间32 min,进样量10 µL。
1.3.5 HPLC-MS检测条件温孵产物按“1.3.3”项下方法进行样品处理后,进行HPLC-MS检测。一级液质条件:采用安捷伦1260高效液相色谱串联布鲁克7.0 T FT-ICR质谱系统,DiamonsilTM ODS C18色谱(250 mm×4.6 mm,5 µm),以含0.1 %甲酸的甲醇-含0.1%甲酸的水(15:85)为流动相,流速0.5mL·min-1,洗脱时间32 min,进样量10 µL。;电离模式为电喷雾电离(ESI),扫描模式为正离子扫描,雾化器气压4.0×102 kPa,干燥气流速10 L·min-1,干燥气温度200 ℃。二级液质条件:采用沃特世高效液相色谱串联Waters LCT Premier XE Q-TOF质谱系统(HPLC-Q-TOF),DiamonsilTM ODS C18色谱(250 mm×4.6 mm,5 µm),以含0.1 %甲酸的甲醇-含0.1%甲酸的水(15:85)为流动相,流速0.5 mL·min-1,洗脱时间32 min,进样量10 µL;电离模式为电喷雾电离(ESI),扫描模式为正离子扫描,碰撞气为氮气,毛细管电压2.8 kV,锥孔电压3.0 V,源温度110 ℃,洗脱气体流量10 L·min-1,碰撞能量15~25 eV。
1.3.6 数据库的建立在药物代谢的研究中,对药物代谢产物结构的鉴定是相当重要的环节,如果代谢产物结构得以鉴定,则药物代谢途径和药物代谢酶的确定就变得简单。本项目组根据文献研究建立关于虫草素化学成分、代谢产物及结构相似物的数据库来进行药物代谢产物结构鉴定,最终建立的数据库包括264种化合物,其中涵盖了各种化合物的中文名称、英文名称、InChIKey、CAS、分子式、精确相对分子质量、二级碎片离子以及参考文献。该数据库对本项目组鉴定代谢产物有很大的帮助,对已知化合物的代谢物的鉴定更快捷和准确。
根据二级质谱得到的碎片推测代谢产物时,利用碎片质量差异推测中性丢失对代谢产物的鉴定有很大的帮助[16-18]。因此,本项目组建立了中性丢失的数据库,其中包括147种中性丢失,涵盖了其中文名称、英文名称、离子源和相对分子质量[19]。通过该数据库,结合相关知识和相关软件,为代谢产物的鉴定起到支持和补充作用。
2 结果 2.1 微粒体蛋白含量测定以BSA标准蛋白溶液的吸收度A对其蛋白浓度C作工作曲线,得回归方程:
A=0.002 3C +0.073 r=0.998 8
微粒体蛋白用水稀释100倍后,在同样条件下测定的吸收度值为0.673,由回归方程得出待测蛋白质量浓度为258.8 μg·mL-1,故原微粒体蛋白质量浓度为25.88 mg·mL-1。
2.2 温孵体系的优化采用NADPH再生系统(表 1),其温孵产物按按“1.3.4”项下方法进行HPLC-DAD检测研究代谢情况,比较代谢效果,筛选出最佳代谢体系。经过对温孵体系的优化,发现虫草素在肝微粒体中发生转化。选择转化色谱峰明显,转化产物丰富的孵育条件定为最佳孵育条件。最终确定温孵体系为:肝微粒体酶2.0 mg·mL-1,NADP 1.0 mmol·L-1,NADH 0.5 mmol·L-1,G-6-P 10.0 mmol·L-1,G-6-P DH 1.0IU·mL-1,MgCl2 4.0 mmol·L-1,虫草素0.10 mg·mL-1。
2.3 液质联用分析 2.3.1 空白对照法把虫草素在肝微粒体中温孵培养后的转化组与标准组和空白组的总离子流色谱图进行比对,见图 2,通过观察代谢组比空白组和标准组新增加的色谱峰,则该物质即可能为代谢产物。3个总离子流色谱图见图 2。结果发现,在总离子流色谱图中观察到转化组较空白组和标准组有新增加的色谱峰,进一步通过MS-DIAL(http://prime.psc.riken.jp/Metabolomics_Software/MS-DIAL/index.html)软件对代谢数据进行处理。
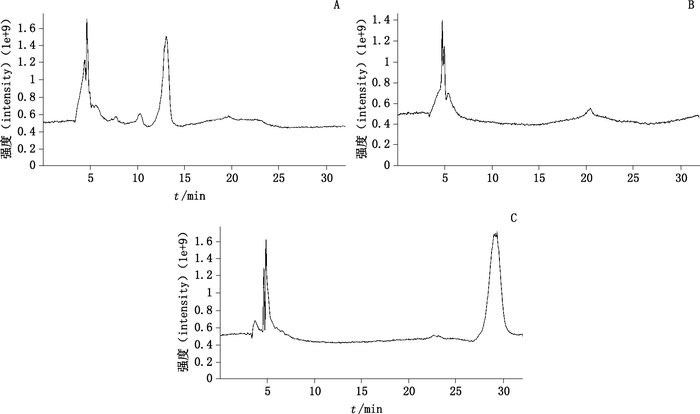
|
A.转化组(the transformation group)B.空白组(the blank group)C.标准组(the standard group) 图 2 总离子色谱图 Figure 2 Total ion chromatograms |
按“1.3.5”项下方法对样品进行检测,通过软件MS-DIAL对转化样品进行处理,除去与空白组和标准组相同的数据外,结果显示,经离心取上清液之后过滤的转化样品较空白组和标准组有8个保留时间出现了新增加的色谱峰,其分别对应着不同的质荷比,结果见表 2。将这些保留时间下对应的质荷比与我们建立的数据库进行对比,对于新增加的色谱峰进行二级质谱检测。
|
|
表 2 转化样品HPLC-MS结果 Table 2 HPLC-MS results of transformation samples |
Waters HPLC-Q-TOF-MS/MS对相关保留时间的离子进行碎裂,得到了一系列的离子碎片,通过二级碎片分析软件MassLynx V4.1对碎片与母离子进行分析,与之前建立的数据库进行比对,进一步对二级离子碎片进行比对,如果特征碎片或官能团离子能够相符,则确定该代谢物就是数据库中的物质[20]。另外,还有一些数据库中没有的高强度的离子,根据中性丢失等数据库和软件进行推测。结果表明,虫草素在肝微粒体中代谢后,检测到8个代谢物,鉴定了其中5个代谢产物,8个代谢产物分子式等相关信息见表 3,其各个选择离子流色谱图依次见图 3,其中5个代谢产物的结构,见图 4。
|
|
表 3 虫草素在肝微粒体中转化的代谢产物 Table 3 Metabolites of Cordycepin in liver microsomal |

|
图 3 虫草素在肝微粒体中代谢物M1~M8的选择离子流色谱图 Figure 3 Selected ion current chromatograms of metabolites M1-M8 of cordycepin in liver microsomal |
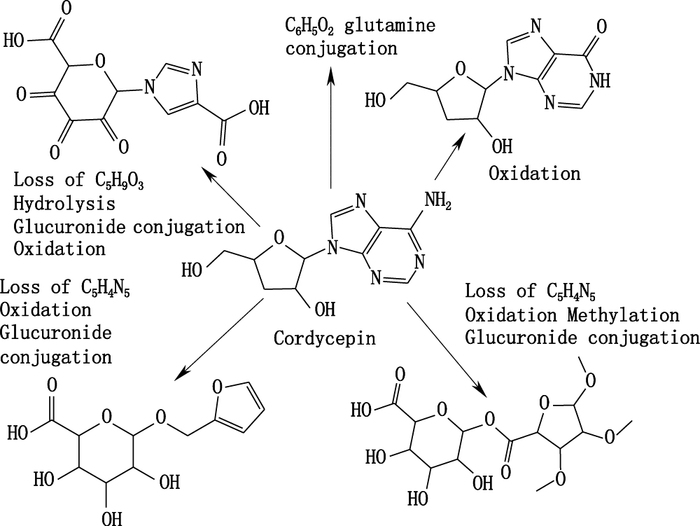
|
图 4 虫草素在肝微粒体中代谢可能的途径 Figure 4 Possible pathways for the metabolites of cordycepin in liver microsomal |
虫草素的转化产物M1的保留时间为4.64 min,其(+)ESI-MS一级全扫描质谱条件下,产生的[M+H]+为283.019 4,软件推测分子式可能为C10H6N2O8,误差为1.0×10-6。二级质谱检测得到的特征碎片有m/z 167、186、247、265。分析推测,m/z167为脱去三氧化葡萄糖醛酸后产生的碎片离子,m/z186为化合物中咪唑环开环裂解后得到的碎片离子,m/z 265为化合物三氧化葡萄糖醛酸的羧基结构脱去1个水分子得到4-羧基咪唑的碎片离子,m/z 247为m/z 265的碎片离子中的咪唑环上的羧基脱去1个水分子得到的碎片离子,结合CFM-ID(http://cfmid.wishartlab.com/)拟合数据,给出化合物的结构式。
虫草素的转化产物M2的保留时间为4.64 min,其(+)ESI-MS一级全扫描质谱条件下,产生的[M+H]+为426.076 1,软件推测分子式可能为C10H16N7O10P,误差为1.9×10-6。
虫草素的转化产物M4的保留时间为5.61 min,其(+)ESI-MS一级全扫描质谱条件下,产生的[M+H]+为383.116 0,软件推测分子式可能为C14H22O12,误差为6.3×10-6。二级质谱检测得到的特征碎片有m/z 203、207。分析推测m/z 203为脱去葡萄糖醛酸后3,4,5-三甲氧基-2-羧基呋喃产生的碎片离子,m/z 207为脱去葡萄糖醛酸后3,4,5-三甲氧基-2-羧基四氢呋喃产生的碎片离子,结合CFM-ID拟合数据,给出化合物的结构式,其二级质谱图见图 5-A。
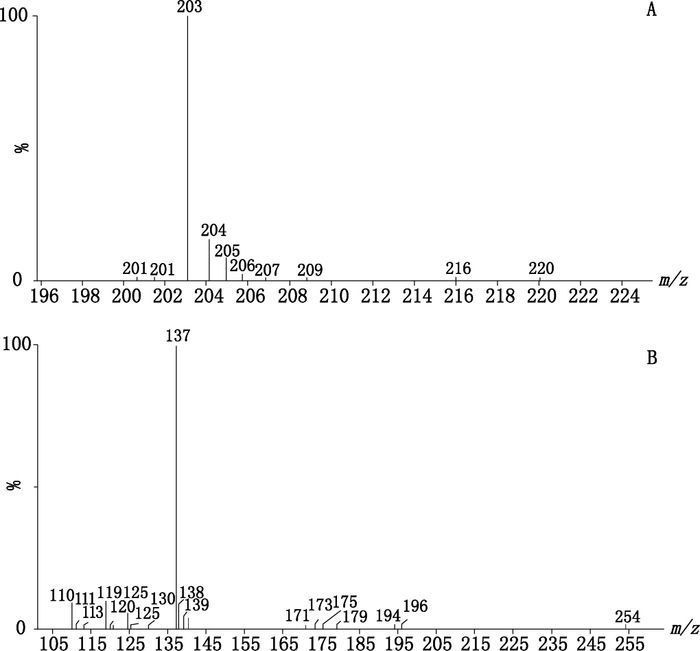
|
A.代谢物M4(metabolite M4)B.代谢物M7(metabolite M7) 图 5 虫草素在肝微粒体中代谢物的二级质谱图 Figure 5 HPLC-MS/MS spectrograms of the metabolites of cordycepin in liver microsomal |
虫草素的转化产物M5的保留时间为10.34 min,其(+)ESI-MS一级全扫描质谱条件下,产生的[M+H]+为255.096 4,软件推测分子式可能为C11H14N2O5,误差为4.5×10-6。二级质谱检测得到的特征碎片有m/z 108、109、125、150、168、180、237。在M5的二级质谱图中,其[M+H]+为255.047 1,与其产生的碎片离子m/z 109差值为146。符合数据库中谷氨酰胺的中性丢失数据,因此可以确定M5是C6H5O2与谷氨酰胺的结合物。
虫草素的转化产物M6的保留时间为12.85 min,其(+)ESI-MS一级全扫描质谱条件下,产生的[M+H]+为275.075 2,软件推测分子式可能为C11H14O8,误差为3.4×10-6。二级质谱检测得到的特征碎片有m/z 129、139、159、227。m/z 129为葡萄糖醛酸环断裂后的碎片,m/z 139为断裂葡萄糖醛酸环后脱去3.4.5-三羟基戊酸后的碎片离子,m/z 159为脱去2-羟甲基呋喃的葡萄糖醛酸的碎片离子,m/z 227为断裂呋喃环的2位羟甲基以及葡萄糖醛酸的2位羰基和5位羟基得到的碎片离子,结合CFM-ID拟合数据,给出化合物的结构式。文献[21]表明,可由3′-脱氧核糖经反应生成呋喃环。
虫草素的转化产物M7的保留时间为12.98 min,其(+)ESI-MS一级全扫描质谱条件下,产生的[M+H]+为253.093 2,软件推测分子式可能为C10H12N4O4,误差为-0.3×10-6。二级质谱检测得到的特征碎片有m/z 110、137。m/z 110为脱去3′-脱氧核糖后的腺嘌呤中六元环开环后得到的碎片,m/z137为脱去3′-脱氧核糖后腺嘌呤的碎片离子峰。因此确定M7为3′-脱氧次黄嘌呤核苷。上述离子与文献[22]及结合CFM-ID拟合数据,给出化合物的结构式,其二级质谱图见图 5-B。
虫草素的转化产物M8的保留时间为13.09 min,其(+)ESI-MS一级全扫描质谱条件下,产生的[M+H]+为527.162 0,软件推测分子式可能为C20H30O16,误差为-2.6×10-6,结构尚未鉴定。
3 讨论虫草素是冬虫夏草中重要的生物活性成分之一,具有抗肿瘤,治疗白血病,调节免疫力,治疗心血管疾病,抗菌,抗炎等作用,具有很高的保健功效和药用研究价值。近几年,虫草素生物活性作用研究报道越来越多,而且机理研究越来越深入,为虫草素作为药品进入临床应用提供更多的科学依据。
本实验建立了一种有效的肝微粒体药物代谢酶体外代谢虫草素的体系,模拟人体肝脏,探讨虫草素在肝脏中的代谢产物。可应用于虫草素的代谢研究,本文采用高效液相色谱串联傅里叶离子回旋共振质谱(HPLC-FT-ICR),得到虫草素8个代谢物的一级质谱的精确分子量,确定了7个化合物的分子式,采用高效液相色谱串联Waters LCT Premier XE Q-TOF质谱(HPLC-Q-TOF)进行代谢物的二级质谱检测,由于该方面的相关报道较少,根据碎片分析初步推测了5个代谢物的化学结构。由得到的代谢产物来看,虫草素在肝微粒体代谢酶系中主要发生了氧化、还原、水解和结合等反应,从而为探索其在肝脏中的代谢途径,转化规律及其生物活性和/或毒性的研究提供参考。此法可尝试推广至其他中药化学成分的体外代谢研究,为中药化学成分的体内外代谢研究奠定方法学基础。
| [1] |
董宏鸿, 李建军, 周行, 等. 蛹虫草中虫草素的提取及药理活性研究进展[J]. 吉林医药学院学报, 2016, 37(6): 465. DONG HH, LI JJ, ZHOU H, et al. Study on extraction and pharmacological activity of from Cordyceps militaris[J]. J Jilin Med Univ, 2016, 37(6): 465. |
| [2] |
胡贤达, 岳颖, 武鹏, 等. 虫草素药理作用研究及展望[J]. 中国生化药物杂志, 2015, 35(12): 180. HU XD, YUE Y, WU P, et al. Progress and prospects on pharmacological research of cordycepin[J]. Chin J Biochem Pharm, 2015, 35(12): 180. |
| [3] |
CUNNINGHAM KG, MANSON W, SPRING FS, et al. Cordycepin, a metabolic product isolated from cultures of Cordycepin militaris[J]. Nature, 1950, 166(4231): 949. |
| [4] |
万朋, 高俊涛, 吕世杰. 蛹虫草化学成分及药理作用研究进展[J]. 上海中医药杂志, 2015, 49(6): 95. WAN P, GAO JT, LÜ SJ. Research progress of component and pharmacological effects of Cordyceps militaris[J]. Shanghai J Tradit Chin Med, 2015, 49(6): 95. |
| [5] |
王多, 鲍荣, 王芳, 等. 虫草素抗肿瘤作用分子机制研究进展[J]. 中国药理学与毒理学杂志, 2015, 29(4): 643. WANG D, BAO R, WANG F, et al. Research progress on molecular mechanism of antitumor effect of cordycepin[J]. Chin J Pharmacol Toxicol, 2015, 29(4): 643. |
| [6] |
ARAMWIT P, PORASUPHATANA S, SRICHANA T, et al. Toxicity evaluation of cordycepin and its delivery system for sustained in vitro anti-lung cancer activity[J]. Nanoscale Res Lett, 2015, 10(1): 1. DOI:10.1186/1556-276X-10-1 |
| [7] |
李如意, 宋厚盼, 魏艳霞, 等. 冬虫夏草药理作用的研究进展[J]. 环球中医药, 2016, 9(10): 1284. LI RY, SONG HP, WEI YX, et al. Research advances of pharmacological activities of Cordyceps[J]. Global Tradit Chin Med, 2016, 9(10): 1284. DOI:10.3969/j.issn.1674-1749.2016.10.043 |
| [8] |
赵爽, 王贝贝, 田娟, 等. HPLC-MS法测定去氢骆驼蓬碱在人肝微粒体中代谢产物[J]. 中医药学报, 2015, 43(3): 11. ZHAO S, WANG BB, TIAN J, et al. Determination of metabolites in human liver microsomes by HPLC-MS[J]. Acta Chin Med Pharmacol, 2015, 43(3): 11. |
| [9] |
王献, 王玲. HPLC-QTOFMS和MS/MS分析鉴定PF573228肝微粒体体外代谢产物[J]. 中南民族大学学报(自然科学版), 2014, 33(3): 9. WANG X, WANG L. Structural elucidation of in vitro metabolites of PF573228 by HPLC-QTOF MS and MS/MS[J]. J South Cent Univ Natl(Nat Sci Ed), 2014, 33(3): 9. |
| [10] |
苑霖. 间尼索地平在细胞色素P450酶中的代谢及其代谢产物研究学[D]. 石家庄: 河北医科大学, 2014 YUAN L.Study on the Metabolism of m-Nisoldipine in Recombinant Cytochrome P450 Enzymes and the Metabolites in Rat Tissues[D].Shijiazhuang:Hebei Medical University, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10089-1014248205.htm |
| [11] |
GIBSON GG, SKETT P. Intoduction to Drug Metabolism[M]. 2nd ed. London: Chapman & Hall, 1996.
|
| [12] |
LOWRY OH, ROSEBROUGH NJ, FARR AL, et al. Protein measurement with the Folin phenol reagent[J]. J Biol Chem, 1951, 193(4): 265. |
| [13] |
贾天柱. 肉豆蔻的研究进展[J]. 中草药, 1996, 27(11): 690. JIA TZ. Research progress of nutmeg[J]. Chin Herb Med, 1996, 27(11): 690. |
| [14] |
李碧, 方雄, 褚福浩, 等. 琥珀酸半醛脱氢酶抑制剂筛选方法的建立及其在天麻成分筛选中的应用[J]. 北京中医药大学学报, 2016, 39(8): 664. LI B, FANG X, ZHU FH, et al. Screening succinate semialdehyde dehydrogenase inhibitors:an established model and its application in Tall Gastrodia Tuber[J]. J Beijing Univ Tradit Chin Med, 2016, 39(8): 664. |
| [15] |
李飞, 杨秀伟, 程燕, 等. 肉豆蔻木脂素的体外代谢初步研究[J]. 中国新药杂志, 2008, 17(7): 560. LI F, YANG XW, CHENG Y, et al. In vitro metabolism of myrislignan in the seeds of Myristica fragrans[J]. Chin J New Drugs, 2008, 17(7): 560. |
| [16] |
贺峦. 液质联用技术(LC-MS)在中药成分分析中的应用[J]. 科技风, 2016, 10(19): 188. HE L. Application of liquid chromatography coupled with mass spectrometry(LC-MS)in analysis of traditional Chinese medicine[J]. Technol Wind, 2016, 10(19): 188. |
| [17] |
章斌, 娄子洋. 液质联用技术在中药代谢物及代谢组学研究中的应用分析[J]. 第二军医大学学报, 2011, 32(6): 658. ZHANG B, LOU ZY. Application of LC-MS technique in metabolite and metabonomic research of traditional Chinese medicine[J]. Acad J Second Mil Med Univ, 2011, 32(6): 658. |
| [18] |
张莉, 张丽萍, 孙成春. 液-质联用技术在中药研究中的应用[J]. 解放军药学学报, 2010, 26(6): 558. ZHANG L, ZHANG LP, SUN CC. Application of liquid chromatography coupled with mass spectrometry in the study of traditional Chinese medicine[J]. Pharm J Chin PLA, 2010, 26(6): 558. |
| [19] |
刘淑莹. 中药质谱分析[M]. 北京: 科学出版社, 2012, 100. LIU SY. Mass Spectrometry Analysis of Traditional Chinese Medicine[M]. Beijing: Science Press, 2012, 100. |
| [20] |
潘芳芳. HPLC-QTOF-MS联用技术在药物杂质分析中的运用[D]. 杭州: 浙江工业大学, 2013 PAN FF.Application of HPLC-QTOF-MS in the Analysis of Drug Impurities[D].Hangzhou:Zhejiang University of Technology, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10337-1013365099.htm |
| [21] |
ENSLOW KR, BELL AT. The role of metal halides in enhancing the dehydration of xylose to furfural[J]. Chemcatchem, 2015, 7(3): 479. DOI:10.1002/cctc.v7.3 |
| [22] |
MEDICI R, LEWKOWICZ ES, IRIBARREN AM. Arthrobacter oxydans as a biocatalyst for purine deamination[J]. FEMS Microbiol Lett, 2008, 289(1): 20. DOI:10.1111/fml.2008.289.issue-1 |
 2017, Vol. 37
2017, Vol. 37 
