2. 江西中医药大学, 南昌 330004
2. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
五倍子具有敛肺、止汗、涩肠、固精、止血、解毒等功效,临床上通常用于肺虚久咳、自汗盗汗、久痢久泻、各种出血等[1]。醋五倍子增强其收敛涩肠止泻的功能。本品主要含没食子酸和鞣花酸等[2-6]成分,为传统的抗菌药。
《江西省炮制规范》[7]和《中药炮制学辞典》[8]中记载,五倍子醋蒸后酸性增强,收敛涩肠止泻的功能增强。《中华本草》[9]记载醋调五倍子对毛囊炎和蜂窝织炎、传染性软疣、足癣等有一定疗效。目前这些感染性疾病大多采用抗生素治疗,而抗生素易产生耐药性,因此,开发及发掘抗菌的传统中草药如醋五倍子饮片有一定临床意义和社会价值。
目前关于醋蒸五倍子的研究报道较少,其传统炮制方法为:取大小均匀的净五倍子,用米醋拌匀,置小甑内蒸1日至透,取出,晒干[10]。由于五倍子质地坚硬,炮制品火候难以控制。传统醋蒸五倍子没有具体的工艺参数,没有统一的质量标准,经验性强,可操作性差,难以指导大规模生产。
传统采用单一指标对炮制工艺进行研究,不符合中药多成分多靶点的用药模式,而加权评分法采用多指标的方法对工艺进行筛选,更具有客观性。因此,本文采用多指标加权评分法,即没食子酸和鞣花酸的含量与抗菌圈大小,使用L9(34)正交试验表,优选醋五倍子的工艺技术参数,为该饮片的炮制及质量控制提供科学依据。
1 仪器与材料LC-20AT型高效液相色谱仪,SPDM20A检测器(岛津企业管理(中国)有限公司)。CPA2250型万分之一的电子分析天平(赛多利斯科学仪器北京有限公司)。KQ-300 DE型数控超声波清洗器(功率300 W,频率40 kHZ,昆山市超声仪器有限公司)。色谱柱为Kromasil十八烷基硅烷键合硅胶(C18)柱(4.6 mm×150 mm,5 μm),北京久吉仪器仪表公司。
对照品没食子酸(批号:110831-200803),购自中国食品药品检定研究院,供含量测定用,纯度大于99%;对照品鞣花酸(批号:130810)购自深圳博泰康泰医药科技有限公司,供含量测定用,纯度大于98%。甲醇、乙腈均为色谱纯,购自美国Fisher公司;三氟乙酸为分析纯,购自国药集团化学试剂有限公司,水为娃哈哈纯净水。龙门米醋购自北京二商龙和田宽食品有限公司。金黄色葡萄球菌ATCC6538(批号:A1008B)购自上海鲁微科技有限公司。牛津杯(不锈钢材质,规格:内径6 mm,外径7.8 mm,高10 mm)购自北京易秀博古生物科技有限公司。
五倍子原药购自北京同仁堂,产地为四川,经中国中医科学院中药研究所冯学锋研究员鉴定为漆树科植物盐肤木Rhus chinensis Mill.和青麸杨Rhus potaninii Maxim.叶上的虫瘿,主要由五倍子蚜Melaphis chinensis(Bell)Baker寄生而形成。
净五倍子的制备方法:敲开,除去杂质[1]。
醋五倍子样品的制备方法:取净五倍子,按照L9(34)正交表进行试验,得到9份样品(正交试验1#-9#)。
2 方法与结果 2.1 HPLC法测定没食子酸和鞣花酸的含量 2.1.1 色谱条件色谱柱为Kromasil十八烷基硅烷键合硅胶(C18)柱(4.6 mm×150 mm,5 μm),流动相为乙腈(A)-0.1%三氟乙酸溶液(B),梯度洗脱(0~8 min,95%B;8~14 min,95%B→90%B;14~17 min,90%B→85%B;17~26 min,85%B;26~42 min,85%B→80%B,100%甲醇冲柱10 min,95% B平衡30 min),流速0.8 mL·min-1,柱温25 ℃,检测波长280 nm,进样体积10 μL。色谱图见图 1。
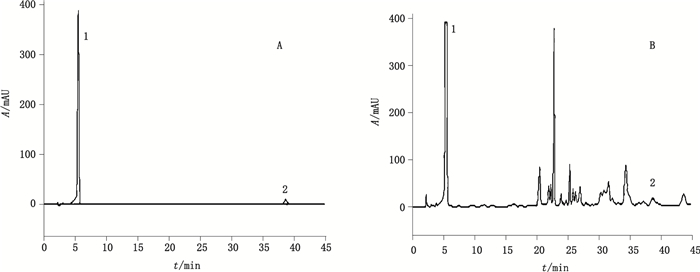
|
1.没食子酸(gallic acid)2.鞣花酸(ellagic acid) 图 1 对照品(A)及醋五倍子(B)的HPLC图 Figure 1 HPLC of reference substances(A)and vinegared Galla Chinensis(B) |
精密称取没食子酸和鞣花酸的对照品适量,置25 mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,制得质量浓度分别为0.106、0.103 g·L-1的对照品储备液。
2.1.3 供试品溶液的制备取正交试验的样品,粉碎过四号筛,每份约0.25 g,精密称定,置100 mL具塞锥形瓶中,精密加入甲醇25 mL,称量,超声处理(功率300 W,频率45 kHz)30 min,取出,放置,待其冷却至室温,称量,用甲醇补足减失的量,摇匀,滤过,弃去初滤液,取续滤液,过0.2 μm微孔滤膜,即得。
2.1.4 线性关系考察分别取没食子酸、鞣花酸的对照品适量,精密称定,置同一25 mL量瓶中,加甲醇溶解,添加甲醇至刻度,摇匀。依次进行等度稀释,得没食子酸和鞣花酸质量浓度分别为0.403 6、0.031 2、0.605 5、0.062 5、0.807 3、0.078 1、1.009 1、0.093 7、1.210 9、0.109 3、1.412 7、0.156 2 g·L-1的溶液,每个浓度均进样10 μL。以质量浓度为横坐标(X),峰面积为纵坐标(Y)制作标准曲线,回归方程分别为:
| $ \begin{array}{l} Y = 2.71 \times {10^7}X + 2.38 \times {10^6}\;\;\;\;r = 0.999\;5\\ Y = 2.28 \times {10^7}X - 8.87 \times {10^4}\;\;\;\;r = 0.999\;1 \end{array} $ |
表明没食子酸和鞣花酸分别在4.04~14.13和0.31~1.56 μg范围内呈线性关系。
2.1.5 精密度试验取正交试验1#样品,按照“2.1.3”项下方法制备供试品溶液,按照“2.1.1”项下条件进样10 μL测定,连续进样6次,分别记录没食子酸、鞣花酸的峰面积,计算RSD分别为0.42%和0.67%,表明仪器的精密度良好。
2.1.6 稳定性试验取同一供试品溶液10 μL,于0、1、2、6、12、24 h分别进样测定,记录没食子酸和鞣花酸的峰面积,计算RSD分别为1.40%和1.80%,表明24 h内样品稳定性良好。
2.1.7 重复性试验取正交试验1#样品6份,每份约0.25 g,精密称定,按照“2.1.3”项下方法制备供试品溶液,按照“2.1.1”项下条件进样10 μL测定,分别进样,记录没食子酸和鞣花酸的峰面积,计算RSD分别为1.04%和3.04%,表明样品的制备方法重复性良好。
2.1.8 加样回收率试验精密称取正交1#样品6份(已知没食子酸和鞣花酸的含量分别为83.440和5.787 1 mg·g-1),每份约0.125 g,分别精密加入没食子酸对照品和鞣花酸对照品适量,制备供试品溶液,测定,计算没食子酸和鞣花酸的平均回收率(RSD)分别为102.52%(1.23%)和97.99%(2.41%)。见表 1。
|
|
表 1 加样回收率试验(n=6) Table 1 The recovery test |
分别取正交试验1#~9#样品,按“2.1.3”项下制备供试品溶液,按“2.1.1”项下色谱条件进行测定,测定各个样品的峰面积,计算没食子酸和鞣花酸的含量。
2.2 体外抗菌实验 2.2.1 药液的制备将正交试验的9份样品,粉碎过四号筛,分别称取25 g,加入100 mL的蒸馏水中,加热煎煮30 min。煎煮2次,滤过,合并2次滤液,浓缩成质量浓度为0.25 g·mL-1的药液备用。
2.2.2 菌液的制备将金黄色葡萄球菌(菌落)制成菌液,浓度相当于0.5麦氏比浊管的浓度。
2.2.3 牛津杯法[11-12]先在无菌平皿内加入已熔化的M-H琼脂培养基20 mL,作为底层,待凝固后再加入已经制备好的菌液100 μL,用涂布棒涂布均匀,再将已经灭菌好的牛津杯(内径6 mm,外径7.8 mm,高10 mm)均匀地放置在培养皿中。每个平板中放置5个牛津杯,其中4个加入同种药液200 μL,另外1个加入相应的溶剂作为阴性对照并做好标记。所有的培养皿直接放置于37 ℃恒温培养箱中培养24 h;观察菌落生产情况,用游标卡尺测量抑菌圈,计算平均值,进行对比研究。
2.3 正交试验 2.3.1 因素和水平的选择本实验在传统的炮制方法上进行正交试验,根据预实验,加醋量(A)、浸润时间(B)和蒸制时间(C)为重要因素,各因素分别安排3个水平进行试验,选用L9(34)正交表安排试验,见表 2。按照成分含量高低和活性,采用综合评分法[13]进行分数的计算:综合分=没食子酸含量/最大值×60%+抗菌抑菌圈的大小/最大值×30%+鞣花酸含量/最大值×10%。
|
|
表 2 L9(34)正交试验设计与结果 Table 2 Design and results of L9(34)orthogonal test |
取9份大小均一的净五倍子各50 g,按表 2中的实验设计,加入不同比例的醋拌匀,浸润不同时间后蒸制,在不同蒸制时间点取样,放置待其冷却至室温,得到9份样品。取每份样品测定,结果见表 2,方差分析见表 3。
|
|
表 3 方差分析 Table 3 Analysis of variance |
由表 3结果可以看出,影响因素的大小顺序为C > A > B,因素C对试验结果具有显著性影响(P < 0.05)。取各因素较高水平的组合,得到最佳工艺条件为A3B2C3,即用醋量为20%,浸润14 h,蒸制3 h。
2.3.3 验证试验称取50 g大小均匀的净五倍子生品3份,采用优选出的工艺条件进行炮制,没食子酸、鞣花酸、抑菌圈的大小和综合评分的均值分别为0.58、0.09、0.30、0.97,见表 4。说明优选的最佳工艺稳定、可行。
|
|
表 4 验证试验结果 Table 4 Results of verification |
本实验首次使用多指标加权法优选醋五倍子炮制工艺。没食子酸和鞣花酸的含量为化学指标,抗菌效果为药效指标。通过预实验,筛选醋蒸五倍子工艺中对其成分和活性影响较大的因素,即用醋量、醋浸润时间、蒸制时间。经过正交试验,优选出最佳醋制工艺醋量为20%,蒸制3 h,醋浸润时间为14 h。验证试验表明,优选的醋五倍子炮制工艺稳定可行。
3.2 抗菌实验《中华本草》记载醋调五倍子治疗毛囊炎和蜂窝织炎。毛囊炎和蜂窝织炎在老年人和婴幼儿中发病率较高,目前对毛囊炎和蜂窝织炎患者,医院大多采用青霉素类、头孢类等抗生素[14]进行治疗,虽然疗效显著,但是长期使用易产生耐药性,尤其对婴幼儿不利。选用中国传统中草药治疗能减少其副作用及耐药性产生。据文献记载,生五倍子有一定的抗菌效果,从预实验结果看出五倍子醋制后与生五倍子相比抗菌效果进一步增强,因此,开发醋制五倍子有一定临床意义。本实验选用蜂窝组织炎主要致病菌金黄色葡萄球菌,采用牛津杯法测定抗菌效果[15],在实验操作中应注意菌液和药液浓度及加入量要适中。为了比较不同炮制工艺品抗菌的差异性,在平行实验中菌液和药液加入量需准确加入并保持一致。在超洁净工作台操作,避免因操作带入杂菌。
3.3 结果分析从表 3方差分析结果可以看出,蒸制时间对其有显著性影响,醋量及浸润时间有一定的影响,但是没有显著性差异,五倍子醋制后抑菌效果增强。
本实验醋五倍子炮制工艺正交优选,可以规范醋五倍子的炮制工艺,保证醋五倍子饮片的质量及临床用药安全,醋制炮制为新的抗菌药物的挖掘提供了新的思路。
| [1] |
中国药典2010年版. 一部[S]. 2010: 62 ChP 2010. Vol I[S]. 2010:62 |
| [2] |
彭璐, 龚千锋, 李娆娆, 等. RP-HPLC测定五倍子3个炮制品中没食子酸和鞣花酸的含量[J]. 中国实验方剂学杂志, 2015, 21(18): 76. PENG L, GONG QF, LI RR, et al. Determination of contents of gallic acid and ellagic acid in three kinds of processed pieces of Galla Chinensis by RP-HPLC[J]. Chin J Exp Tradit Med Form, 2015, 21(18): 76. |
| [3] |
李春远, 唯嘉, 渠桂荣. 五倍子化学成分研究[J]. 中草药, 2008, 39(8): 1129. LI CY, WEI J, QU GR. Chemical constituents of Galla Chinensis[J]. Chin Tradit Herb Drugs, 2008, 39(8): 1129. |
| [4] |
杨寒冰, 杨文强, 宋敏, 等. 五倍子中酚性化学成分及其抗病毒活性[J]. 中国药科大学学报, 2016, 47(5): 566. YANG HB, YANG WQ, SONG M, et al. Phenolic constituents of Galla Chinensis and their antiviral activities[J]. J China Pharm Univ, 2016, 47(5): 566. DOI:10.11665/j.issn.1000-5048.20160510 |
| [5] |
王瑞生, 张振凌, 王胜超, 等. HPLC法同时测定五倍子发酵百药煎中没食子酸及鞣花酸含量[J]. 中国现代中药, 2016, 18(7): 831. WANG RS, ZHANG ZL, WANG SC, et al. Determination of gallic acid and ellagic acid in gallnut fermented Chinese Gall Leaven by HPLC[J]. Mod Chin Med, 2016, 18(7): 831. |
| [6] |
宋光志, 刘静, 谢道刚. 五倍子鞣酸对照品的制备及质量标准研究[J]. 世界科学技术-中医药现代化, 2004, 6(6): 63. SONG GZ, LIU J, XIE DG. Studies on preparetion and quality standard of tannin reference substance[J]. World Sci Technol Mod Tradit Chin Med, 2004, 6(6): 63. |
| [7] |
江西省中药饮片炮制规范[S]. 2008: 557 Specification for Processing Chinese Herbal Pieces in Jiangxi Province[S]. 2008:557 |
| [8] |
叶定江. 中药炮制学辞典[M]. 上海: 上海科技出版社, 2005, 497. YE DJ. Dictionary of Traditional Chinese Medicine Processing[M]. Shanghai: Shanghai Science and Technology Press, 2005, 497. |
| [9] |
国家中医药管理局. 中华本草[M]. 上海: 上海科学技术出版社, 1999. State Administration of Traditional Chinese Medicine. Chinese Materia Medica[M]. Shanghai: Shanghai Science and Technology Press, 1999. |
| [10] |
路甬祥. 中国传统工艺全集中药炮制[M]. 郑州: 大象出版社, 2004, 214. LU YX. Chinese Traditional Crafts Complete Set of Traditional Chinese Medicine Processing[M]. Zhengzhou: Elephant Press, 2004, 214. |
| [11] |
李仪奎. 中药药理实验方法学[M]. 上海: 上海科学技术出版社, 2006, 755. LI YK. Pharmacological Experimental Methodology of Traditional Chinese Medicine[M]. Shanghai: Shanghai Science and Technology Press, 2006, 755. |
| [12] |
刘健, 王海雁, 赵淑江. 牛津杯法测定五倍子对大黄鱼病原弧菌的体外抑菌活力[J]. 海洋科学, 2009, 33(11): 44. LIU J, WANG HY, ZHAO SJ. Determination of antibacterial activity of Galla Chinensis on pathogenic Vibrio of Pseudosciaena crocea in Oxford cup method[J]. Mar Sci, 2009, 33(11): 44. |
| [13] |
徐志伟, 曹岗, 蔡宝昌. 多指标综合评价麸炒白芍的炮制工艺[J]. 中草药, 2014, 45(13): 1867. XU ZW, CAO G, CAI BC, et al. Evalution of processing technology for bran-fried Paeoniae Alba Radix by multi-index comprehensive weighted mark method[J]. Chin Tradit Herb Drugs, 2014, 45(13): 1867. DOI:10.7501/j.issn.0253-2670.2014.13.011 |
| [14] |
丁翔宇, 张古英, 李佳佳, 等. 抗菌药物治疗儿童蜂窝织炎的药物经济学研究[J]. 中国医药导报, 2014, 11(27): 90. DING XY, ZHANG GY, LI JJ, et al. Pharmacoeconomics of antibiotic therapy in children with cellulitis[J]. Chin Med Rep, 2014, 11(27): 90. |
| [15] |
马琳, 刘盈. 皮肤金黄色葡萄球菌感染的抗菌药物选择[J]. 中国皮肤性病学杂志, 2013, 27(3): 225. MA L, LIU Y. The appropriate antimicrobial drug in Staphylococcal Aureus skin infection[J]. Chin J Dermatovenereol, 2013, 27(3): 225. |
 2017, Vol. 37
2017, Vol. 37 
