2. 广东省食品药品监督管理局, 广州 510080
2. Guangdong Food and Drug Administration, Guangzhou 510080
药材川贝母为百合科(Liliaceae)贝母属(Fritillaria L.)多种植物的干燥鳞茎,传统中医药理论认为川贝母具有清热润肺、化痰止咳的功效,主治肺热燥咳、咯痰带血、痰多胸闷等症,一直以来是止咳、化痰、平喘的良药[1-2]。我国的药用贝母属植物超过50种,中国药典2015年版共收录5大类贝母:川贝母、平贝母、伊贝母、浙贝母和湖北贝母,其中川贝母基原植物有:川贝母(Fritillaria cirrhosa D.Don)、暗紫贝母(Fritillaria unibracteata Hsiao et K.C.Hsia)、甘肃贝母(Fritillaria przewalskii Maxim.)、梭砂贝母(Fritillaria delavayi Franch.)、太白贝母(Fritillaria taipaiensis P.Y.Li)或瓦布贝母(Fritillaria unibracteata Hsiao et K.C.Hsia var.Wabuensis wabuensis(S.Y.Tang et S.C.Yue)Z.D.Liu,S.Wang et S.C.Chen)[3],川贝母鉴别方法包括显微鉴别法、薄层色谱法以及聚合酶链式反应-限制性片段长度多态性法(polymerase chain reaction-restriction fragment length polymorphisms,PCR-RFLP)。川贝母核糖体DNA(ribosomal deoxyri-bonucleic acid,rDNA)序列的转录间隔区1(internal transcribed spacer 1,ITS1)含有限制性内切酶Sma Ⅰ的单一位点(5′-CCCGGG-3′),而非川贝类的基因组在此处的序列为5′-CTCGGG-3′。因此对贝母基因组的rDNA-ITS1的区域进行PCR扩增并对产物进行Sma Ⅰ酶切,从而对川贝母类与非川贝类进行鉴定[4-6]。PCR-RFLP方法具有客观,特异性强及重复性好等特点而优于显微鉴别法、薄层色谱法。
本实验室在川贝母药材PCR-RFLP鉴定过程中发现,川贝母对照药材及部分市售药材PCR扩增中出现非目标条带,这对最终的结果判断产生了干扰。相同的现象出现在其他实验室的实际检验中,因此本研究对非目标条带产生的原因进行了分析,并鉴定为药材所带真菌污染。本研究对中国药典2015年版的川贝母PCR-RFLP鉴定方法中PCR引物进行了优化,防止了真菌微生物的干扰,为降低川贝母PCR-RFLP鉴定中的假阳性率提供参考。
1 材料与仪器 1.1 药材川贝母对照药材(中国食品药品检定研究院,批号:121000-201108);平贝母对照药材(中国食品药品检定研究院,批号:120924-201109);其他样品为市售川贝母、平贝母、瓦布贝母及伊贝母。
1.2 试剂植物基因组DNA提取试剂盒(DNeasy Plant Mini Kit,QIAGEN),PCR反应体系(PrimeSTAR Max Premix,Takara Bio),Sma Ⅰ限制性核酸内切酶(Thermo),GelRed核酸染料(Biotium),DNA琼脂糖凝胶回收试剂盒(DP209,TIANGEN),DNA marker(DL2000,TAKARA),PCR引物(P1:5′-CGTAACAAGGTTTCCGTAGGTGAA-3′,P2:5′-GCTACGTTCTTCATCGAT-3′,P2-2:5′-AATCTCCGCATCCGTGACCGCACC-3′,上海生工)。
1.3 仪器PCR仪(GeneAmp 9700,ABI),凝胶成像系统(GelDoc XR+,Biorad),电泳仪(Wide Mini Sub-cell GT,Biorad),紫外分光光度计(Nanophotometer P360,IMPLEN),分析天平(MS303S,Mettler Toledo),离心机(1-14K,SIGMA),纯水仪(Direct-Q 5,Milli-Q),水浴锅(WNB14,MEMMERT)。
2 方法 2.1 药材基因组提取 2.1.1 药材处理取药材1 g,依次用75%乙醇、灭菌超纯水清洗,用酒精棉球将表面擦拭干净,晾干后置于研钵中磨成极细粉末,称取粉末样品约30 mg备用。
2.1.2 基因组提取与定量按照植物基因组DNA提取试剂盒说明书进行操作。DNA样品用紫外分光光度计进行定量。
2.2 PCR-RFLP反应 2.2.1 PCR反应体系与条件PCR反应体系:在200 μL离心管中进行,反应总体积为50 μL:2 X PCR Premix预混液25 μL,鉴别引物(10 μmol·L-1)各1 μL,模板100 ng,补加无菌超纯水至50 μL。PCR反应参数:98 ℃预变性2 min,循环反应35次(98 ℃ 15 sec,55 ℃ 15 sec,72 ℃ 30 sec),72 ℃延伸3 min。
2.2.2 Sma Ⅰ酶切反应取PCR产物15 μL,总反应体积20 μL,反应条件按照内切酶说明书进行操作。
2.2.3 DNA琼脂糖凝胶电泳及成像DNA样品采用1.5%琼脂糖凝胶进行电泳,电压5 V·cm-1,电泳30~40 min,使用紫外凝胶成像仪拍照并保存图像。
2.3 DNA条带分析 2.3.1 DNA条带回收操作按琼脂糖凝胶回收试剂盒进行。
2.3.2 DNA测序DNA回收纯化样品采用连接T载体法挑取单克隆进行测序(由北京六合华大基因科技股份有限公司完成实验)。
2.3.3 测序结果分析对测序结果进行NCBI在线BLAST比对与同源性分析。
3 实验结果 3.1 中国药典法的鉴定结果 3.1.1 PCR-RFLP结果采用中国药典2015年版PCR-RFLP进行的鉴定结果见图 1。其中川贝母对照药材、市售川贝母1号、2号与4号样品PCR产物在250~300 bp处均出现双条带,Sma Ⅰ酶切后在约120 bp与200 bp处新增2条带;市售川贝母3号样品,市售瓦布贝母样品1号、2号样品PCR产物在约300 bp处出现单一条带,Sma Ⅰ酶切后在约120 bp与200 bp处新增2条带;平贝母对照药材,市售平贝母1号,市售伊贝母1号样品PCR产物出现大于300 bp的单一条带。根据中国药典2015年版的规定,可以判断泳道3、4、5、7、8、10对应样本为川贝母正品。但RFLP图谱中泳道1、3、4、10中位于100~250 bp的大条带无法确定是来源于PCR产物中的小条带还是PCR产物中的大条带经过酶切后的产物。
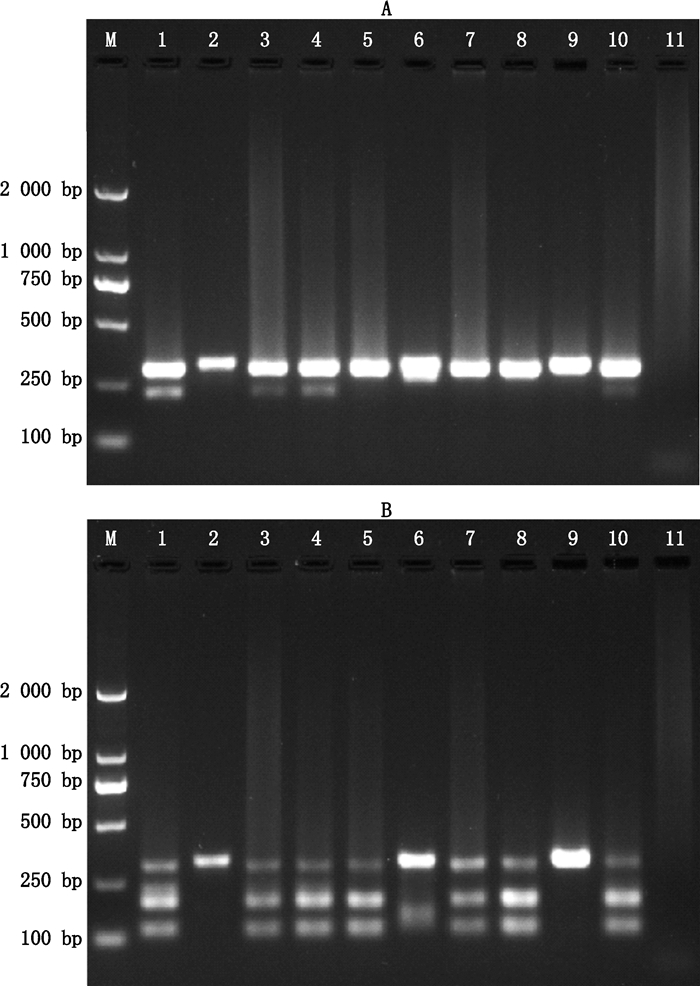
|
M. DNA marker DM20001.川贝母对照药材(reference drug of Fritillaria cirrhosa D.Don)2.平贝母对照药材(v of Fritillaria ussuriensis Maxim.)3~5,10.市售川贝母样品(commercial samples of Fritillaria cirrhosa D.Don)6.市售平贝母样品(commercial sample of Fritillaria ussuriensis Maxim.)7~8.市售瓦布贝母样品(commercial samples of Fritillaria unibracteata Hsiao et K.C.Hsiavar wabuensis)9.市售伊贝母样品(commercial sample of Fritillaria pallidiflora Schrenk.)11.空白对照(blank control) A. PCR产物(PCR product)B. Sma Ⅰ酶切产物(Sma Ⅰ digestion product) 图 1 中国药典法贝母样品PCR-RFLP产物琼脂糖凝胶电泳图谱 Figure 1 Agarose gel electrophoresis of DNA product in Fritillariae Cirrhosae Bulbus identification using PCR-RFLP method in Chinese Pharmacopoeia |
对中国药典2015年版PCR-RFLP中的引物(P1,P2)与GeneBank数据库中贝母rDNA进行序列比对表明,引物P1位于18S rDNA序列内,引物P2位于5.8S rDNA序列内,川贝母PCR产物大小约为310 bp,平贝母的PCR产物大小约为330 bp。图 1中PCR结果与预期不完全相符:川贝母对照药材、市售川贝母1号、2号与4号样品PCR除310 bp的目的条带外,还产生小于250 bp的未知条带,而且该条带在Sma Ⅰ酶切后依然存在。由于条带大小在中国药典2015年版规定的100~250 bp范围内,因此对最后的结果判断产生了一定影响。
3.1.2 可疑条带序列分析对1、3、4、10号样品PCR产物中约250 bp的条带分别进行了DNA琼脂糖凝胶回收,产物3′端加A后进行了T载体连接单克隆测序,测序结果在NCBI进行BLAST序列同源性比对分析。结果显示:1号样品条带序列与灰绿曲霉Aspergillus pseudoglaucus(GenBank:KX610153.1),冠突散囊菌Eurotium sp.(GenBank:KT898778.1)等真菌相应ITS1序列同源性为99%;3号样品条带序列与赤曲霉Aspergillus ruber(GenBank:KP131614.1),冠突散囊菌Eurotium sp.(GenBank:KM197171.1)等真菌相应ITS1序列同源性为99%;4号样品条带序列与灰绿曲霉Aspergillus pseudoglaucus(GenBank:KX610153.1),冠突散囊菌Eurotium sp.(GenBank:KX148650.1)等真菌相应ITS1序列同源性为99%;10号样品条带序列与未知真菌克隆(GenBank:GQ999252.1),曲霉属真菌Aspergillus(GenBank:KF225863.1)等真菌相应ITS1序列同源性为99%。曲霉属真菌为中药材中常见真菌[7-9],表明川贝母对照药材及市售川贝母样本基因组提取物中含有真菌基因组,以此可以确认图 1中可疑条带来自于药材污染真菌的扩增产物。
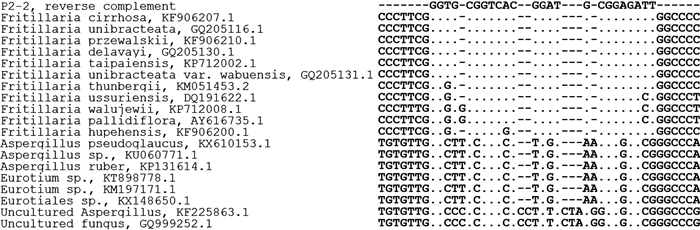
3.2 新引物设计与鉴定结果 3.2.1 新引物设计本实验选取川贝母rDNA-ITS2区域进行下游引物的重新设计(P2-2),PCR产物预期大小约为470 bp,Sma Ⅰ酶切后新增条带预期大小约为120 bp与350 bp。序列比对显示引物与川贝母组各物种ITS2对应序列一致,与其他类贝母序列同源性稍低,与真菌ITS2对应序列同源性较低(图 2)。
|
图 2 引物P2-2与贝母及真菌ITS2序列比对 Figure 2 Primer P2-2 sequence alignment with ITS2 of Fritillaria L.and fungus. |
采用引物P1与P2-2对样品重新进行PCR-RFLP鉴定,结果见图 3。所有贝母样品PCR产物在500 bp处均出现单一条带,未有杂带影响。川贝母药材样品PCR产物Sma Ⅰ酶切后在120 bp与350 bp处新增2条带;平贝母对照药材,市售平贝母样品PCR产物Sma Ⅰ酶切后未出现新增条带。根据Sma Ⅰ酶切后产生的条带大小来区分川贝母真伪,可以判断泳道3、4、5、7、8、10对应样本为川贝母正品,与中国药典2015年版方法所得结论相同,同时避免了PCR中的杂带对RFLP结果判断的影响。

|
M. DNA marker DM20001.川贝母对照药材(reference drug of Fritillaria cirrhosa D.Don)2.平贝母对照药材(reference drug of Fritillaria ussuriensis Maxim.)3~5,10.市售川贝母样品(commercial samples of Fritillaria cirrhosa D.Don)6.市售平贝母样品(commercial sample of Fritillaria ussuriensis Maxim.)7~8.市售瓦布贝母样品(commercial samples of Fritillaria unibracteata Hsiao et K.C.Hsiavar wabuensis)9.市售伊贝母样品(commercial sample of Fritillaria pallidiflora Schrenk.)11.空白对照(blank control) A. PCR产物(PCR product)B. Sma Ⅰ酶切产物(Sma Ⅰ digestion product) 图 3 新引物法贝母样品PCR-RFLP产物琼脂糖凝胶电泳图谱 Figure 3 Agarose gel electrophoresis of DNA product in Fritillariae Cirrhosae Bulbus detection using PCR-RFLP method with new primer designed |
中药材在生产、运输及贮存过程中容易受到微生物的污染,从而使药材的鉴定受到影响,微生物污染主要包括细菌污染和真菌污染。川贝母PCR-RFLP鉴定方法中PCR扩增引物P1(5′-CGTAACAAGGTTTCCGTAGGTGAA-3′)位于川贝母基因组18S rDNA序列内,引物P2(5′-GCTACGTTCTTCATCGAT-3′)位于5.8S rDNA序列内,而18S rDNA序列和5.8S rDNA序列在真核生物之间的保守性较高,因此该方法中的PCR反应也能对其他一些物种的ITS1序列进行扩增[10-11]。当川贝母药材污染真菌时,该方法会扩增出真菌ITS1条带并对结果判断产生影响。如果扩增出的真菌ITS1序列中含有Sma Ⅰ酶切位点时,甚至会产生假阳性结果。
日常川贝母药材的分子鉴定也证明了这一推断,本实验室共发现4例川贝母所带真菌产生PCR条带的情况,包括中国食品药品检定研究院提供的川贝母对照药材,通过ITS1测序证明实验中的未知条带来自于真菌。真菌污染可以来自于环境,也可能是药材自带的内生真菌[12-15],本实验未做真菌溯源分析。利用ITS2序列在物种间的差异相对较大,本实验通过将下游引物设置在ITS2区域内而防止了真菌相应条带的PCR扩增,以减少真菌污染对鉴定结果的干扰。
| [1] |
李萍, 季晖, 徐国钧, 等. 贝母类中药的镇咳祛痰作用研究[J]. 中国药科大学学报, 1993(6): 360. LI P, JI H, XU GJ, et al. Study on antitussive and expectorant effects of traditional Chinese medicine of Fritillaria[J]. Chin Pharm Univ, 1993(6): 360. |
| [2] |
孙涛, 彭成. 川贝母止嗽颗粒的平喘作用研究[J]. 时珍国医国药, 2013, 24(7): 1575. SUN T, PENG C. The study of anti-asthmatic effect of Bulbus Fritillariae Cirrhosae cough relieving granule[J]. Lishizhen Med Mater Med Res, 2013, 24(7): 1575. |
| [3] |
中国药典2015年版. 一部[S]. 2015: 36 ChP 2015, Vol Ⅰ[S]. 2015:36 |
| [4] |
WANG CZ, LI P, DING JY, et al. Simultaneous identification of Bulbus Fritillariae cirrhosae using PCR-RFLP analysis[J]. Phytomedicine, 2007, 14(9): 628. DOI:10.1016/j.phymed.2006.09.008 |
| [5] |
张文娟, 刘薇, 魏锋, 等. 聚合酶链式反应-限制性片段长度多态性法用于检定川贝母掺伪情况的研究[J]. 药物分析杂志, 2014, 34(10): 1830. ZHANG WJ, LIU W, WEI F, et al. Study on identifying adulterants in Fritillariae Cirrhosae Bulbus with polymerase chain reactionrestriction fragment length polymorphisms(PCR-RFLP)method[J]. Chin J Pharm Anal, 2014, 34(10): 1830. |
| [6] |
徐传林, 李会军, 李萍, 等. 川贝母药材分子鉴定方法研究[J]. 中国药科大学学报, 2010, 41(3): 226. XU CL, LI HJ, LI P, et al. Molecular method for the identification of Bulbus Fritillariae Cirrhosae[J]. Chin Pharm Univ, 2010, 41(3): 226. DOI:10.11665/j.issn.1000-5048.20100307 |
| [7] |
余倩, 殷强仲, 杨建平, 等. 成都市市售中药材中真菌的调查[J]. 华西预防医学, 1990, 4: 27. YU Q, YIN QZ, YANG JP, et al. Investigation of fungi in commercial Chinese herbal medicines of Chengdu[J]. Prevent Med West China, 1990, 4: 27. |
| [8] |
李闽真, 马群飞, 傅武胜, 等. 市售中药材霉菌污染情况和优势种群分布的研究[J]. 中国卫生检验杂志, 2013, 23(17): 3351. LI MZ, MA QF, FU WS, et al. Research on dominant species distribution and pollution status of molds in commercial Chinese herbal medicine[J]. Chin J Health Lab Technol, 2013, 23(17): 3351. |
| [9] |
蔡飞, 高微微, 李红玲, 等. 中药上黄曲霉毒素的污染现状与防除技术[J]. 中国中药杂志, 2010, 35(19): 2503. CAI F, GAO WW, LI HL, et al. Aflatoxin contamination of Chinese herbal medicine in China and its potential management strategies[J]. China J Chin Mater Med, 2010, 35(19): 2503. |
| [10] |
CHASE MW, FAY MF. Ecology barcoding of plants and fungi[J]. Science, 2009, 325(5941): 682. DOI:10.1126/science.1176906 |
| [11] |
CHENG T, XU C, LEI L, et al. Barcoding the kingdom plantae:new PCR primers for ITS regions of plants with improved universality and specificity[J]. Mol Ecol Resour, 2016, 16(1): 138. DOI:10.1111/1755-0998.12438 |
| [12] |
严铸云, 张琦, 马云桐, 等. 不同生长期川贝母内生真菌的多样性[J]. 华西药学杂志, 2008, 23(5): 521. YAN ZY, ZHANG Q, MA YT, et al. Diversity of endophytic fungi in Fritillaria cirrhosa D. Don[J]. West China J Pharm Sci, 2008, 23(5): 521. |
| [13] |
陈鹊, 王元彪, 刘正琼, 等. 暗紫贝母产生物碱内生真菌的筛选及生物碱抑菌活性的测定[J]. 中国抗生素杂志, 2012, 37(06): 406. CHEN Q, WANG YB, LIU ZQ, et al. Screening alkaloid-producing endophytic fungi isolated from Fritillaria unibracteata and testing the antimicrobial activity of alkaloid extracts[J]. Chin J Antibio, 2012, 37(6): 406. |
| [14] |
PAN BF, SU X, HU B, et al. Fusarium redolens 6WBY3, an endophytic fungus isolated from Fritillaria unibracteata var. wabuensis, produces peimisine and imperialine-3β-D-glucoside[J]. Fitoterapia, 2015, 103: 213. DOI:10.1016/j.fitote.2015.04.006 |
| [15] |
BAAYEN RP, O'DONNELL K, BREEUWSMA S, et al. Molecular Relationships of Fungi Within the Fusarium redolens-F. hostae Clade[J]. Phytopathology, 2001, 91(11): 1037. DOI:10.1094/PHYTO.2001.91.11.1037 |
 2017, Vol. 37
2017, Vol. 37 