2. 江苏省药物研究所, 南京 210009
2. Jiangsu Provincial Institute of Material Medica, Nanjing 210009, China
富马酸沃诺拉赞(vonoprazan,Takecab)是新型抗胃酸药物,属于钾离子(K+)竞争性酸阻滞剂(potassium-competitive acid blocker,P-CAB),能够抑制K+与H+、K+-ATP酶(质子泵)相结合,能强劲、持久地抑制胃酸分泌[1-3]。其适应症包括糜烂性食管炎、消化性溃疡和胃食管反流疾病,同时可辅助治疗胃溃疡、十二指肠溃疡、特发性血小板减少性紫癜、早期胃癌、幽门螺旋杆菌感染性胃炎等疾病[4-6]。体外、体内研究显示,相较于传统质子泵抑制剂兰索拉唑,沃诺拉赞有着更强的活性以及更好的耐受性[7-10]。
本文研究醋酸沃诺拉赞在比格犬体内的毒代动力学特征,通过观察重复给予受试物后比格犬体内药物代谢的改变、全身暴露量与给药剂量和时间关系,解释毒性研究结果,预测受试物在人体暴露时的潜在风险;为临床试验中解毒或解救措施提供参考。
1 仪器与试药美国Waters公司的Waters 2695液相色谱仪、Quattro Micro三重四极杆质谱仪、Masslynx数据分析系统;德国Eppendorf 5424型高速离心机;美国TALBOYS基本型旋涡混合器;梅特勒-托利仪器有限公司XS105DU型电子天平。Waters XTerra ODS色谱柱(填料:十八烷基硅烷键合硅胶;规格:2.1 mm×100 mm,5 μm;美国Waters公司)。
对照品:醋酸沃诺拉赞(批号H009-141101,纯度:99.5%,江苏柯菲平医药股份有限公司);供试品:注射用醋酸沃诺拉赞(批号20150311,规格:每瓶10 mg,江苏柯菲平医药股份有限公司);内标:兰索拉唑(批号100709-200304,纯度:99.8%,中国食品药品检定研究院);乙腈(批号15105065,TEDIA公司,HPLC级);甲酸(批号77Y1211RS,ACS公司,HPLC级);氯化钠注射液(批号F15051105,规格:100 mL:0.9 g,贵州天地药业有限责任公司);试验用水为实验室自制去离子水(Milli-Q制备)。
2 实验动物普通级比格犬40只,雌雄各半,8~12月龄,雄性和雌性体重范围为8.2~11.6 kg。试验犬购自南京亚东实验动物研究中心,动物合格证号:201506964,动物生产许可号为SCXK(苏)2013-0001。实验动物的使用遵循3R(Reduction,RepLacement,Refinement)原则,实验方案在实施前已经得到本机构实验动物管理与使用委员会伦理审查批准。
3 方法与结果 3.1 液相色谱—质谱条件 3.1.1 色谱条件色谱柱:Waters XTerra ODS(十八烷基硅烷键合硅胶)柱(2.1 mm×100 mm,5 μm);流动相:0.1%甲酸水溶液(氨水调pH至3.24)-乙腈(60:40,v/v);流速:0.2 mL·min-1;柱温:25 ℃;进样器温度:4 ℃;进样量:5 μL。
3.1.2 质谱条件检测方式:多反应监测(MRM);离子极性:正离子;离子化方式:电喷雾离子化(ESI);检测对象:醋酸沃诺拉赞,[M+H]+m/z 346.3>315.2;内标:兰索拉唑,[M+H]+m/z 370.3>252.3;毛细管电压:3.0 kV;锥孔电压:20 V;离子源温度:120 ℃;脱溶剂区温度:350 ℃;碰撞气(氩气)压力:3.2×10-4 kPa;碰撞能量:10 eV;脱溶剂气流速:400 L·h-1气帘气流速:50 L·h-1。
3.2 对照品储备液、内标溶液与标准血浆样品的配制 3.2.1 对照品储备液精密称取醋酸沃诺拉赞对照品11.77 mg(约相当于沃诺拉赞10.03 mg),置10 mL量瓶中,乙腈溶解并定容,得质量浓度约为1 003 μg·mL-1的沃诺拉赞对照品储备液。
3.2.2 内标溶液精密称取兰索拉唑对照品10.07 mg,以乙腈-水溶液(50:50)溶解并定容,制得质量浓度为1 μg·mL-1的内标溶液,置于4 ℃冰箱保存备用。
3.2.3 标准血浆样品量取沃诺拉赞对照品储备液,用乙腈稀释制得质量浓度为50、100、200、500、1 000、2 000、5 000、10 000、20 000和50 000ng·mL-1的系列标准工作液。分别吸取上述系列标准工作液5 μL,置Eppendorf管中,再加入空白血浆45 μL,涡旋混匀30 s,制得质量浓度为5、10、20、50、100、200、500、1 000、2 000和5 000 ng·mL-1的沃诺拉赞标准血浆样品。
3.2.4 血浆样品的处理方法待测犬血浆样品从-20 ℃室温自然解冻后,取50 μL置离心管中,加入内标溶液(1 μg·mL-1兰索拉唑乙腈溶液)100 μL,涡旋30 s,高速离心(24 085 g)5 min后,取上层有机相80 μL置离心管中,加入80 μL超净水,涡旋30 s,高速离心(24 085 g)5 min后,取上清100 μL,进样5 μL分析。
3.3 方法学考察 3.3.1 特异性研究取6份不同来源的空白血浆各50 μL,分别将空白血浆样本、向空白血浆中加入1 μg·mL-1醋酸沃诺拉赞的血浆样本和向空白血浆中加入1 μg·mL-1内标工作液的血浆样本,按“3.2.4”项下方法处理,进样分析,记录色谱图(图 1)。沃诺拉赞和内标兰索拉唑的保留时间分别在1.85 min和3.22 min,两者基线分离,峰形良好,无杂峰干扰。表明该方法专属性好。

|
图 1 空白血浆样品(A)、空白血浆中加入1 μg·mL-1醋酸沃诺拉赞样品(B)和空白血浆中加入1 μg·mL-1内标样品(C)色谱图 Figure 1 Chromatograms of blank plasma sample(A), blank plasma sample added with 1 μg·mL-1 vonoprazan acetic acid(B)and blank plasma sample added with 1 μg·mL-1 internal standard(C) |
按“3.2.3”项下方法制作10个质量浓度梯度的系列标准血浆样本,按“3.2.4”项下方法处理并进行色谱分析,记录沃诺拉赞色谱峰面积(Ar)与内标色谱峰面积(Ai)。以峰面积比值Y(Ar/Ai)的平均值对血药浓度X(ng·mL-1)进行回归分析,得标准曲线回归方程:
Y=0.002 4X+0.017 4 r=0.999 6
结果表明沃诺拉赞在5~5 000 ng·mL-1范围内线性关系良好。最低定量限为5 ng·mL-1。
3.3.3 精密度与准确度按照“3.2.3”项下方法配制沃诺拉赞低(10 ng·mL-1)、中(100 ng·mL-1)、高(2 000 ng·mL-1)3个质量浓度的质量控制样品,每个浓度5份,按“3.2.4”项下方法处理后进样分析,计算批内变异和准确度;连续测定3批计算批间变异。结果见表 1。结果显示低、中、高3个浓度样品中沃诺拉赞批内、批间RSD均小于7.7%。表明此方法的精密度和准确度较高,重复性良好。
|
|
表 1 沃诺拉赞3种浓度下批内、批间的精密度和准确度(X±SD,n=5) Table 1 Intra-day and inter-day assay for precision and accuracy of vonoprazan at three concentrations |
按照“3.2.3”项下方法配制沃诺拉赞低(10 ng·mL-1)、中(100 ng·mL-1)、高(2 000 ng·mL-1)3个质量浓度的质量控制样品,每个浓度平行制备5份,按照“3.2.4”项下方法处理后进样,记录样品峰面积和内标峰面积之比记为A1;空白血浆按“3.2.4”项下方法处理后,加入上述3种浓度对照品,记录样品峰面积和内标峰面积之比A2。提取回收率=A1/A2×100%。吸取上述3个质量浓度的含药标准系列溶液50 μL,按“3.2.4”项下方法处理后进样,计算样品峰面积内标峰面积的比值为A3。基质效应=A3/A2×100%。结果见表 2。同法计算得到内标兰索拉唑(在1 μg·mL-1浓度水平)的提取回收率为(97.3±0.76)%,基质效应为(100.6±0.90)%。结果表明沃诺拉赞和内标的提取回收率均 > 91%,基质效应均在105%~114%之间,符合生物样本检测要求。
|
|
表 2 沃诺拉赞3种浓度下的提取回收率和基质效应(X±SD,n=5) Table 2 Extraction recoveries and matrix effect of vonoprazan at three concentrations |
按照“3.2.3”项下方法配制低(10 ng·mL-1)、中(100 ng·mL-1)、高(2 000 ng·mL-1)3个质量浓度的标准血浆样品若干份。分别考察在血浆样品25 ℃下放置4 h、3次反复冻融循环、提取样本进样器放置(22 ℃)72 h及标准血浆样品-20 ℃冻存1周和2周的稳定性。结果见表 3和表 4。结果表明,在上述稳定性考察条件下,实测沃诺拉赞的浓度RSD均小于5%,稳定性符合生物样本检测要求。
|
|
表 3 沃诺拉赞3种浓度下稳定性试验结果(X±SD,n=5) Table 3 Stability test of vonoprazan at three concentrations |
|
|
表 4 沃诺拉赞3种浓度下长期稳定性试验结果(X±SD,n=5) Table 4 Long-term stability test of vonoprazan at three concentrations |
本实验建立了比格犬血浆中沃诺拉赞的HPLC-MS/MS测定法,血浆中生物物质对沃诺拉赞检测无干扰。本实验条件下,沃诺拉赞血浆样品线性范围为5~5 000 ng·mL-1,最低定量限为5 ng·mL-1,基质效应符合检测要求,方法平均回收率大于85%,批内、批间的变异系数小于10%;血浆中药物成分和内标在各种稳定性研究实验条件下均稳定;质量控制亦符合要求。综上,本方法符合比格犬血样的分析要求。
3.4 毒代动力学试验 3.4.1 动物分组和给药取检疫驯化合格的比格犬40只,按体重分为4组,每组10只,雌雄各半。参照本中心预实验结果,确定低、中、高剂量组分别为1、3、10 mg·kg-1·d-1,溶媒对照组给予0.9%的氯化钠注射液。静脉推注给药。给药容积均为5 mL·kg-1·d-1,连续4周每天上午给药1次。
3.4.2 采血点选取首次给药(Day 1)和末次给药(Day 29)在给药前(0 h)以及给药结束后1/12、0.5、1、2、4、7、10和24 h使用负压采血管(肝素锂抗凝)经犬前肢内侧皮下静脉采血,血液样品1 h内离心(847 g)10 min,分离血浆,于-20 ℃保存待测。每只动物每次采血1.0~1.5 mL。
3.4.3 数据分析首、末次给药后各组醋酸沃诺拉赞的平均药时曲线结果见图 2;各采血点血药浓度经DAS2.1软件采用非房室模型拟合毒代动力学参数,达峰时间Tmax和达峰浓度Cmax采用实测值,结果见表 5。采用置信区间法分析首、末次给药线性动力学特征,应用SPSS PASW Statistics 18.0软件分别计算ln AUC(0-24)、ln AUC(0-∞)和ln Cmax与ln Dose的线性相关性方程的斜率β值,同时得出β值的置信区间;根据文献所述方法计算判断区间[11-12]。通过比较置信区间与判断区间的相互关系,得出结论。结果见表 6。
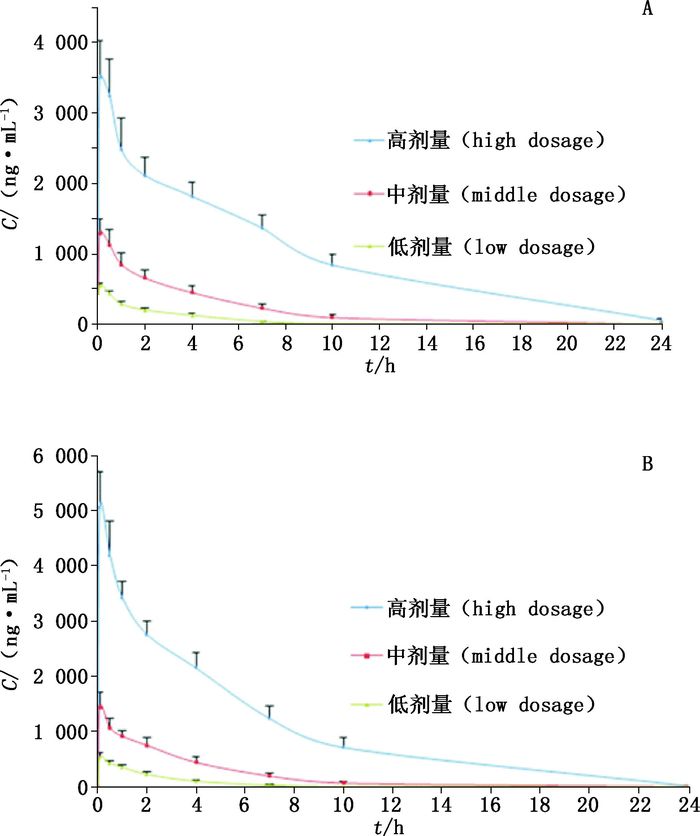
|
图 2 首次(A)、末次(B)给药后各组醋酸沃诺拉赞的平均血药浓度-时间曲线(X±SD,n=10) Figure 2 Mean plasma concentration-time curve of vonoprazan acetic acid administrated at the first time(A)and last time(B)(X±SD, n=10) |
|
|
表 5 比格犬静脉注射醋酸沃诺拉赞后醋酸沃诺拉赞的平均毒代动力学参数(n=5) Table 5 The mean toxicokinetics parameters of voriconazole acetic acid for Beagle dog administrated with vonoprazan acetic acid |
|
|
表 6 AUC(0-24)、AUC(0-∞)和Cmax的线性关系判定(n=10) Table 6 The linear relationships of AUC(0-24)、AUC(0-∞)and Cmax |
由图 2可看出比格犬静脉注射醋酸沃诺拉赞后,血药浓度随时间迅速降低。
通过对比同组内雌雄比格犬静脉注射醋酸沃诺拉赞后的各项毒代动力学参数,同组内雌雄犬的各项参数间差异均不存在统计学意义(p > 0.05),表明给药后沃诺拉赞在比格犬体内的暴露量(AUC(0-24)、Cmax)不存在明显的性别差异。
低、中、高3个剂量组首、末次给药的AUC(0-24)比分别为0.95、0.96、1.06;Cmax比分别为0.97、1.11、1.44。蓄积比都在0.5~2的范围内,暴露量无明显差异。
同次给药,随着给药剂量的增加,T1/2显著延长,CL显著降低(p < 0.05),MRT延长。
由表 6可看出,在给药剂量范围内,首、末次给药后AUC(0-24)、AUC(0-∞)、Cmax的置信区间与判断区间部分重叠。
4 结论与讨论 4.1 结论本实验选用的LC-MS/MS法简单、灵敏,重复性好,专属性好,适用于检测比格犬血浆中沃诺拉赞的浓度。
比格犬静脉注射醋酸沃诺拉赞后的各项毒代动力学参数显示,给药后沃诺拉赞在比格犬体内的暴露不存在明显的性别差异(p > 0.05)。通过对比低、中、高3个剂量组首、末次给药的毒代动力学参数发现,末次给药后AUC(0-24)及Cmax与首次给药相比并无明显变化,仅高剂量Cmax有所增加,但蓄积比都在0.5~2的范围内。说明在连续给药4周后,醋酸沃诺拉赞在比格犬体内的暴露量无明显改变,该药物在犬体内不存在蓄积作用[13]。给药剂量增加,T1/2显著延长,CL显著降低(p < 0.05),MRT延长,药物在犬体内存在轻微代谢/排泄饱和。毒代动力学线性研究表明,在1~10 mg·kg-1剂量范围内,首次或末次给药后醋酸沃诺拉赞在比格犬体内的暴露量与剂量是否呈线性动力学特征尚不能判定。
4.2 讨论当前国内外文献中关于沃诺拉赞的检测方法较少,因使用LC-MS/MS法检测比格犬血浆中的沃诺拉赞的浓度时特异性强、灵敏度高、检测限低且耗时短,所以本试验选用LC-MS/MS法作为生物样本分析检测方法[6, 14]。血浆样品处理方法考察了沉淀蛋白法与液液萃取法。蛋白沉淀选用试剂为乙腈;液液萃取选用试剂分别为乙酸乙酯、甲基叔丁基醚。结果证明乙腈沉淀效果好且提取效率高,最终确定以乙腈为沉淀剂的沉淀蛋白法作为样品处理方法。内标兰索拉唑在乙腈中稳定,所以乙腈既作为沉淀剂又作为内标溶剂。依此最终建立的LC-MS/MS法简单、方便、灵敏,可用于比格犬血浆中沃诺拉赞血药浓度检测。
预实验中比格犬静脉单次给予30 mg·kg-1的醋酸沃诺拉赞,在给药过程中部分犬出现流涎、剧烈挣扎、大小便失禁且舌呈紫黑色的毒性现象;给药结束后大部分比格犬四肢无力,无法站立,并伴随强直性痉挛、角弓反张。20 min后一雌性犬死亡。犬静脉单次给予15、20 mg·kg-1的供试品,给药过程中亦即出现流涎、剧烈挣扎等症状,并且呈现易激惹状态,但给药后并无死亡现象。最终选择单次给药最小致死量的1/3(10 mg·kg-1)作为研究试验的高剂量组给药剂量,并分别以该剂量的3/10和1/10作为中、低剂量组的给药剂量[15]。
| [1] |
GARNOCK-JONES KP. Vonoprazan:first global approval[J]. Drugs, 2015, 75(4): 1. |
| [2] |
蒙发明, 李敏英. HPLC法测定5-(2-氟苯基)-1H-吡咯-3-甲醛有关物质[J]. 化学中间体, 2015, 14(3): 41. MENG FM, LI MY. Determination of related substance of 5-(2-fluorophenly)-1H-pyrrole-3-carbaldehyde(TAK06)by HPLC[J]. Chem Intermediat, 2015, 14(3): 41. |
| [3] |
ARIKAWA Y, NISHIDA H, KURASAWA O, et al. Discovery of a novel pyrrole derivative 1-[5-(2-fluorophenyl)-1-(pyridin-3-ylsulfonyl)-1h-pyrrol-3-yl]-N-methylmethanamine Fumarate(TAK-438)as a potassium-competitive acid blocker(PCAB)[J]. J Med Chem, 2012, 55(9): 4446. DOI:10.1021/jm300318t |
| [4] |
YAMADA S, KAWAKAMI T, NAKATSUGAWA Y, et al. Usefulness of vonoprazan, a potassium ion-competitive acid blocker, for primary eradication of Helicobacter pylori[J]. World J Gastrointest Pharmacol Ther, 2016, 7(4): 550. DOI:10.4292/wjgpt.v7.i4.550 |
| [5] |
AKAZAWA Y, FUKUDA D, FUKUDA Y, et al. Vonoprazan-based therapy for helicobacter pylori eradication:experience and clinical evidence[J]. Therap Adv Gastroenterol, 2016, 9(6): 845. DOI:10.1177/1756283X16668093 |
| [6] |
FUKUDA D, AKAZAWA Y, TAKESHIMA F, et al. Safety and efficacy of Vonoprazan-based triple therapy against helicobacter pylori infection:A single-center experience with 1118 patients[J]. Therap Adv Gastroenterol, 2016, 9(5): 747. DOI:10.1177/1756283X16654499 |
| [7] |
SAVARINO E, MARTINUCCI I, FURNARI M, et al. Vonoprazan for treatment of gastroesophageal reflux:pharmacodynamic and pharmacokinetic considerations[J]. Expert Opin Drug Metab Toxicol, 2016, 12(11): 1333. DOI:10.1080/17425255.2016.1214714 |
| [8] |
JENKINS H, SAKURAI Y, NISHIMURA H, et al. Randomised clinical trial:safety, tolerability, pharmacokinetics and pharmacodynamics of repeated doses of TAK-438(vonoprazan), a novel potassiumcompetitive acid blocker, in healthy male subjects[J]. Aliment Pharm Therap, 2015, 41(7): 636. DOI:10.1111/apt.2015.41.issue-7 |
| [9] |
SHICHIJO S, HIRATA Y, NⅡKURA R, et al. Vonoprazan versus conventional proton pump inhibitor-based triple therapy as first-line treatment against helicobacter pylori:A multicenter retrospective study in clinical practice[J]. J Dig Dis, 2016, 17(10): 670. DOI:10.1111/cdd.2016.17.issue-10 |
| [10] |
TSUIJIMAE M, YAMASHITA H, HASHIMURA H, et al. A comparative study of a new class of gastric acid suppressant agent named vonoparazan versus esomeprazole for the eradication of helicobacter pylori[J]. Digestion, 2016, 94(4): 240. DOI:10.1159/000454762 |
| [11] |
赵明, 杨劲, 魏敏吉, 等. 置信区间法用于线性药代动力学特征评价[J]. 中国临床药理学杂志, 2015, 31(3): 238. ZHAO M, YANG J, WEI MJ, et al. Using confidence interval method to assess linear pharmacokinetics in dose escalation study[J]. Chin J Clin Pharm, 2015, 31(3): 238. |
| [12] |
SMITH BP, VANDENHENDE FR, DESANTE KA, et al. Confidence interval criteria for assessment of dose proportionality[J]. Pharm Res, 2000, 17(10): 1278. DOI:10.1023/A:1026451721686 |
| [13] |
胡海勋, 姚景春, 王现珍, 等. Beagle犬1个月经口给予盐酸伊伐布雷定毒代动力学研究[J]. 中国药学杂志, 2014, 49(19): 1729. HU HX, YAO JC, WANG XZ, et al. Toxicokinetics of ivabradine hydrochloride in Beagles dogs during one month oral administration[J]. Chin Pharm J, 2014, 49(19): 1729. |
| [14] |
OTAKE K, SAKURAI Y, NISHIDA H, et al. Characteristics of the novel potassium-competitive acid blocker vonoprazan fumarate(TAK-438)[J]. Adv Ther, 2016, 33(7): 1140. DOI:10.1007/s12325-016-0345-2 |
| [15] |
国家食品药品监督管理总局. 药物重复给药毒性研究技术指导原则[EB/OL]. [2014-05-13]. http://www.sda.gov.cn/WS01/CL1616/101017.html China Food and Drug Administration. Guidance for Repeated Dose Toxicity Test[EB/OL].[2014-05-13]. http://www.sda.gov.cn/WS01/CL1616/101017.html |
 2017, Vol. 37
2017, Vol. 37 
