2. 河北省中医院, 石家庄 050011
2. Hebei Provincial Hospital of Traditional Chinese Medicine, Shijiazhuang 050011, China
毛茛科植物乌头(Aconitum carmichaeli Debx.)的母根经干燥后即为生川乌,子根经加工制成附子。川乌辛、苦,热,有大毒,具有祛风除湿、温经止痛的功效;附子辛、甘,有毒,具有回阳救逆、补火助阳、逐风寒湿邪的功效[1]。现代药理研究表明,川乌、附子具有强心、杭炎、抗肿瘤等方面的作用,是临床常用的有毒中药之一[2-4]。生物碱类、糖类成分是其主要成分,而生物碱类成分是其既有毒又有效的成分。炮制能降低两者的毒性,剧毒成分双酯型生物碱经加热水解为毒性较小的单酯型生物碱,再进一步水解为几乎无毒的醇胺型生物碱或生成新的脂碱[5-7]。
药物的功效与内在的物质基础紧密相关。川乌和附子来源于同一植物,但功效明显不同,临床作为2种中药分别使用。目前,认为两者中的3种双酯型生物碱、3种单酯型生物碱的含量具有差异[8-12];乌头母根多糖含量约为子根多糖含量的2/3。母根、子根主要含有葡萄糖,还含有少量的半乳糖醛酸、半乳糖、阿拉伯糖,子根还含有甘露糖等[13];此外,研究发现川乌加热炮制后成分组成差异明显,且有新成分产生,但尚未有报道比较乌头母根与子根成分的差异[14-15]。由于中药的复杂性,生物碱类或糖类的含量研究不能全面表征川乌和附子功效差异的物质基础。超高效液相质谱联用技术分离能力强,灵敏度高及分析速度快,在中医药等领域已得到了广泛应用[16]。为探寻川乌和附子功效不同的物质基础,本文采用UPLC-MS技术研究对乌头母根(生川乌)、子根(生附片)化学成分进行比较研究。
1 仪器、试药与样品 1.1 仪器LTQ-Orbitrap XL静电场轨道阱组合式高分辨质谱仪(赛默飞世尔科技公司),配备Mass Frontier、MetWorks、SIEVE、Proteome Discoverer及ToxID等数据解析软件。BS210S型电子天平(Sartorius公司,Max 210 g,d= 0.1 mg);SB24-12DTDN型超声波清洗器(宁波新芝生物科技股份有限公司);SHB-3型循环多用真空泵(郑州长城科工贸有限公司);RE-52型旋转蒸发仪(上海振捷实验设备有限公司)。
1.2 试药与样品对照品乌头碱(批号110720-201111)、新乌头碱(批号110798-201106)、次乌头碱(批号110799-201106)、苯甲酰乌头原碱(批号111794-201102)、苯甲酰新乌头原碱(批号111794-201002)、苯甲酰次乌头原碱(批号111794-201002)均购自中国食品药品检定研究院;对照品乌头原碱(批号ZN1104BA13,纯度≥98%)购自上海源叶生物科技有限公司;新乌头原碱(批号MUST-15010610,纯度≥98%)、次乌头原碱(批号MUST-15053015,纯度≥98%)购自成都曼思特生物科技有限公司。
生川乌、生附片(鲜附子在产地直接切片干燥而成)均购于四川江油中坝附子科技发展有限公司,经中国食品药品检定研究院张继主任药师分别鉴定为毛茛科植物乌头(Aconitum carmichaeli Debx.)的母根及毛茛科植物乌头(Aconitum carmichaeli Debx.)的子根。
乙腈、甲醇为色谱纯,试验用水为纯净水(杭州娃哈哈集团有限公司),其他试剂均为分析纯。
2 方法与结果 2.1 色谱条件采用Waters ACQUITY UPLC BEH C18色谱柱(150 mm×2.1 mm,1.7 μm),以乙腈为流动相A,0.1%甲酸为流动相B,梯度洗脱(0~10 min,4%A→15%A;10~35 min,15%A→ 30%A;35~45 min,30%A→33%A;45~55 min,33%A→60%A;55~58 min,60%A),流速0.2 mL·min-1,进样量5 μL。
2.2 质谱条件离子源所用气体:氮气;电离方式:ESI正离子电离模式;离子源电压:4 kV;毛细管温度:350 ℃;鞘气流速:30单位;辅助气流速:10单位;毛细管电压:110 V;透镜电压:35 V;扫描范围:100~1 000 amu。
2.3 对照品溶液的制备精密称取对照品适量,置于10 mL量瓶中,用70%甲醇溶液溶解并定容,配制成含新乌头碱0.055 mg·mL-1、乌头碱0.061 mg·mL-1、次乌头碱0.101 mg·mL-1、苯甲酰新乌头原碱0.050 mg·mL-1、苯甲酰乌头原碱0.062 mg·mL-1、苯甲酰次乌头原碱0.064 mg·mL-1、新乌头原碱0.064 mg·mL-1、乌头原碱0.104 mg·mL-1、次乌头原碱0.048 mg·mL-1的混合对照品溶液,备用。
2.4 供试品溶液的制备分别精密称取各样品粉末(过三号筛)1 g,置具塞锥形瓶中,精密加入70%甲醇50 mL,称量,超声处理(功率300 W,频率40 kHz,水温在25 ℃以下)30 min,放冷,再称量,用70%甲醇补足减失的量,摇匀,滤过;精密量取续滤液25 mL,40 ℃以下减压回收溶剂至干,残渣精密加入70%甲醇5 mL溶解,过0.22 μm微孔滤膜,取续滤液,即得。
2.5 对照品LTQ-Orbitrap质谱裂解规律川乌、附子中含有的生物碱主要为二萜类生物碱,母环结构相对固定,主要变化在于生物碱母核C8和C14位取代基的种类和位置不同。新乌头碱、乌头碱、次乌头碱3种双酯型生物碱在全扫描质谱中均形成强烈的[M+H]+峰,在二级质谱中均脱去一分子相对分子质量为60的AcOH中性碎片分子,根据化合物的结构判断裂解发生在C8位的乙酰基重排,可通过此特征裂解将双酯型生物碱与其他类成分区分开来。三级质谱中继续脱去失去AcOH中性分子或失去相对分子质量为32的MeOH中性分子,并可在一定条件下脱去相对分子质量为122的苯甲酸中性分子,形成具有一定连续共轭双键的母核离子(如次乌头碱中m/z 338的碎片离子)。苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱3种单酯型生物碱及新乌头原碱、乌头原碱、次乌头原碱在全扫描质谱中均形成强烈的[M+H]+峰,在二、三级质谱中均脱去相对分子质量为32的MeOH、相对分子质量为18的H2O或相对分子质量为50的MeOH+H2O中性分子。
2.6 结果 2.6.1 乌头母根(生川乌)、子根(生附片)共有成分ESI正离子电离模式下,生川乌、生附片、9种生物碱对照品的总离子流图见图 1。通过查阅相关文献及MassBank数据库,对比碎片离子的m/z,指认生川乌中65个成分,生附片中60个成分,两者共鉴定出69个成分。
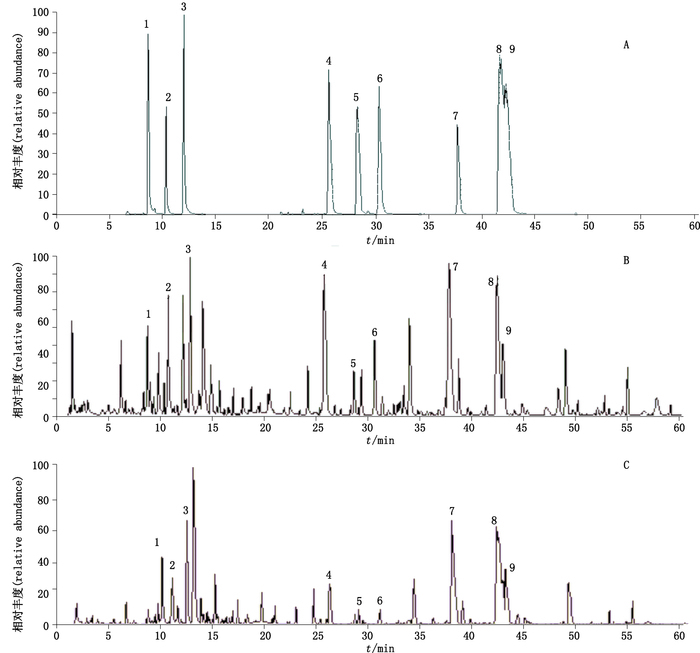
|
1.新乌头原碱(mesaconine)2.乌头原碱(aconine)3.次乌头原碱(hypaconine)4.苯甲酰新乌头原碱(benzoylmesaconine)5.苯甲酰乌头原碱(benzoylaconitine)6.苯甲酰次乌头原碱(benzoylhypacoitine)7.新乌头碱(mesaconitine)8.次乌头碱(hypaconitine)9.乌头碱(aconine) 图 1 对照品(A)、生川乌(B)、生附片(C)总离子流图 Figure 1 Total ion chromatograms of reference substances(A)、unprocessed Aconiti Radix(B)and unprocessed Aconiti Lateralis Radix(C) |
生川乌与生附片共有成分56个,其中已指认的有尼奥灵、10-羟在多根乌头碱、展花乌头宁等成分。按保留时间由前至后排列结果见表 1。
|
|
表 1 生川乌、生附片中碎片离子及鉴定结果 Table 1 Fragment ions and identification results of the common components in unprocessed Aconiti Radix and unprocessed Aconiti Lateralis Radix |
生川乌中已指认的特有成分有9个,分别为黄草乌碱丁、Delsoline、N-deethy-14-benzoylaconine、10-羟基焦乌头碱、印乌头碱、焦去氧乌头碱、异翠雀碱、dehydro-mesaconitine、Vilmorrianine。按保留时间由前至后排列结果见表 2。
|
|
表 2 生川乌特有成分碎片离子表 Table 2 Fragment ions of the specific components in unprocessed Aconiti Radix |
生附片中已指认的特有成分有4个,分别为10-羟基焦乌头原碱、14-苯甲酰尼奥灵、14-O-cinnamoylneoline、8-nonanedioic。按保留时间由前至后排列结果见表 3。
|
|
表 3 生附片特有成分碎片离子表 Table 3 Fragment ions of the specific components in unprocessed Aconiti Lateralis Radix |
有文献采用乙醚和水等作为溶剂提取乌头中的化学成分[14-15]。本研究在相同的梯度洗脱条件下比较了分别采用乙醚、甲醇作为溶剂提取生川乌的质谱结果,发现以甲醇为提取溶剂时总峰面积及成分个数明显高于乙醚,因此选择甲醇作为提取溶剂;分别用60%、70%、80%甲醇做提取溶剂,70%甲醇成分个数最多,故以70%甲醇作为提取溶剂。
乌头不同药用部位中各成分个体的含量及各组分间比例的差异均有可能是川乌与附子在临床分别应用的原因之一。本实验采用UPLC-MS法对乌头母根(生川乌)、子根(生附片)的化学成分进行了系统分析,该方法能全面地反映两者物质基础的差异。从离子流图及碎片离子中可以看出生川乌中各成分的总峰面积约为2.45×1010,生附片中各成分的总峰面积约为3.02×1010;生附片总峰面积较生川乌约高5.64×109,即两者的总峰面积的差值约为生川乌总峰面积的23.0%。生川乌与生附片已指认的共有成分56个,但共有成分中峰面积皆不同,如生川乌中9-hydroxysenbusine A峰面积约是生附片中的2倍,而卡拉可林(karakoline)峰面积约是生附片中的1/10。此外,生川乌中的双酯型生物碱、单酯型生物碱、醇胺型生物碱成分个数较多。其中3种双酯型生物碱(新乌头碱、次乌头碱、乌头碱)峰面积约为生附片的6.5倍;苯甲酰乌头原碱、苯甲酰新乌头原碱峰面积均高于生附片,分别是生附片的1.8倍和1倍;苯甲酰次乌头原碱峰面积略低于生附片,约为生附片的81.0%;3种醇胺型生物碱(新乌头原碱、次乌头原碱、乌头原碱)峰面积均低于生附片,约为生附片的46.6%。因此,推测川乌与附子毒性大小及功效差异可能与其成分的组成及含量差异有关。川乌、附子药效不同的物质基础尚需进一步研究确认。
| [1] |
中国药典2015年版. 一部[S]. 2015: 39, 191 ChP 2015. Vol Ⅰ[S]. 2015:39, 191 |
| [2] |
王璐, 丁家昱, 刘秀秀, 等. 附子中胺醇型二萜生物碱的鉴定及其强心活性研究[J]. 药学学报, 2014, 49(12): 1699. WANG L, DING JY, LIU XX, et al. Identification of aminoalcoholditerpenoid alkaloids in Aconiti Lateralis Radix Praeparata and study of their cardiac effects[J]. Acta Pharm Sin, 2014, 49(12): 1699. |
| [3] |
邵峰, 李赛雷, 刘荣华, 等. 附子不同炮制品镇痛抗炎作用研究[J]. 时珍国医国药, 2011, 22(10): 2329. SHAO F, LI SL, LIU RH, et al. Analgesic and anti-inflammatory effects of different processed products of Aconiti Lateralis Radix Praeparata[J]. Lishizhen Med Mater Med Res, 2011, 22(10): 2329. DOI:10.3969/j.issn.1008-0805.2011.10.006 |
| [4] |
董兰凤, 刘京生, 苗智慧, 等. 附子多糖对H22和S180荷瘤小鼠的抗肿瘤作用研究[J]. 中国中医基础医学杂志, 2003, 9(9): 14. DONG LF, LIU JS, MIAO ZH, et al. Antineoplastic effect of monkshood polysaccharide on mice transplanted with tumor lines of H22 and S180[J]. Chin J Basic Med Tradit Chin Med, 2003, 9(9): 14. |
| [5] |
王峰峰, 宋兆辉, 张兰兰, 等. 乌头碱、新乌头碱、次乌头碱水解和醇解产物的研究[J]. 中国中药杂志, 2012, 37(11): 1564. WANG FF, SONG ZH, ZHANG LL, et al. Identification of hydrolysates and alcoholysates of Aconitum alkaloids[J]. China J Chin Mater Med, 2012, 37(11): 1564. |
| [6] |
郑琴, 陆浩伟, 郝伟伟, 等. 乌头类双酯型生物碱水解转化规律及含量计算方法研究[J]. 中国药学杂志, 2011, 46(9): 652. ZHENG Q, LU HW, HAO WW, et al. Study on hydrolysis of Aconitum alkaloids and quantitative analysis method of their hydrolysates[J]. Chin Pharm J, 2011, 46(09): 652. |
| [7] |
谭鹏, 刘永刚, 关君, 等. 高效液相色谱-质谱联用结合量子化学计算发现乌头碱一新水解产物[J]. 中国中药杂志, 2011, 36(15): 2099. TAN P, LIU YG, GUAN J, et al. Studies on new hydrolysate of aconitine using HPLC-MSn and quantum chemistry calculation[J]. Chin Pharm J, 2011, 36(15): 2099. |
| [8] |
郭志勇, 吕永磊, 许晓嘉, 等. 炮制对乌头母根、子根中生物碱类成分的影响与其自身含量差异的比较研究[J]. 中医药学报, 2014, 42(3): 60. GUO ZY, L YL, XU XJ, et al. Comparing the influence of processing on the contents of alkaloids in parent root and daughter root of Aconitum carmichaeli with the contents in themselves[J]. Acta Chin Med Pharmacol, 2014, 42(3): 60. |
| [9] |
郭志勇, 吕永磊, 许晓嘉, 等. 炮制对乌头各部位水煎液中生物碱的影响[J]. 中华中医药学刊, 2014, 32(8): 1867. GUO ZY, LÜ YL, XU XJ, et al. Study on influence of processing on contents of alkaloids in water decoction of each part of Aconitum carmichaeli[J]. Chin Arch Tradit Chin Med, 2014, 32(8): 1867. |
| [10] |
李耿, 张敏敏, 赵亚, 等. HPLC法同时测定乌头属不同药材4种生物碱的含量[J]. 中药材, 2012, 35(6): 927. LI G, ZHANG MM, ZHAO Y, et al. Simultaneous determination of 4 alkaloids of Aconitum in different medicinal materials by HPLC[J]. J Chin Med Mater, 2012, 35(6): 927. |
| [11] |
黄志芳, 易进海, 陈东安, 等. 制川乌HPLC特征图谱研究和6种酯型生物碱的含量测定[J]. 药物分析杂志, 2011, 31(2): 217. HUANG ZF, YI JH, CHEN DA, et al. HPLC specific chromatogram of Radix Aconiti Praeparata and determination of six esteric alkaloids[J]. Chin J Pharm Anal, 2011, 31(2): 217. |
| [12] |
苏建树, 刘白宁, 田平芳, 等. 微生物发酵对川乌、附子中生物碱含量的影响[J]. 北京化工大学学报(自然科学版), 2014, 37(3): 1867. SU JS, LIU BN, TIAN PF, et al. Effect of microbial fermentation on the extraction of alkaloids from Radix Aconite and Aconite[J]. J Beijing Univ Chem Technol(Nat Sci), 2014, 37(3): 1867. |
| [13] |
吕永磊, 卜海博, 杨蕾, 等. 乌头母根、子根、须根多糖的比较[J]. 中国中药杂志, 2011, 36(9): 1154. L YL, BU HB, YANG L, et al. Comparasion of polysaccharides in parent root, daughter root and rootlet of Aconitum carmichaeli[J]. China J Chin Mater Med, 2011, 36(9): 1154. |
| [14] |
秦语欣, 张先灵, 王蕾, 等. HPLC-MS法研究川乌炮制前后化学成分的变化[J]. 北京中医药大学学报, 2016, 39(4): 298. QIN YX, ZHANG XL, WANG L, et al. Components in Radix Aconiti before and after processing by using HPLC-MS[J]. J Beijing Univ Tradit Chin Med, 2016, 39(4): 298. |
| [15] |
林宏英, 苏畅, 段天璇, 等. 基于HPLC/ESI-MS技术的川乌加热前后化学成分变化[J]. 中国现代中药, 2015, 17(3): 208. LIN HY, SU C, DUAN TX, et al. Changes of chemical constituents in Radix Aconiti Preparata before and after heating based on HPLC/ESI-MS[J]. Mod Chin Med, 2015, 17(3): 208. |
| [16] |
王文琼. 超高液相在药物分析领域中的应用[J]. 中国医药导报, 2012, 9(11): 13. WANG WQ. Application of ultra performance liquid chromatography in pharmaceutical analysis area[J]. China Med Her, 2012, 9(11): 13. DOI:10.3969/j.issn.1673-7210.2012.11.005 |
 2017, Vol. 37
2017, Vol. 37 
