活络效灵丹加减方以中医药理论为基础,在活络效灵丹原处方4味药的基础上调整而成[1]。活络效灵丹加减方由当归、丹参、羌活、独活、川芎、延胡索、赤芍、秦艽、甘草、桂枝、乳香11味药材组成,主要治疗类风湿性关节炎,并能够使局部组织恢复支持与抗炎因子的平衡等[2]。研究表明,处方中秦艽含有的龙胆苦苷具有保肝、抑菌、抗炎和抗病毒等多方面作用,马钱苷酸具有一定的抗炎作用;赤芍中的芍药苷对类风湿性关节炎有较好的疗效;延胡索块茎中的延胡索甲素和延胡索乙素均具有一定的镇痛作用[3-11]。目前对活络效灵丹加减方的研究主要集中在化学成分鉴定、作用机理等方面,而对其质量控制方面的报道较少,本课题组既往研究对活络效灵丹加减方中丹参和乳香中9个有效成分同时进行测定[1]。为完善活络效灵丹加减方中秦艽、赤芍和延胡索中糖苷和生物碱成分含量的同时测定,本实验采用反相高效液相色谱法对活络效灵丹加减方中龙胆苦苷、马钱苷酸、芍药苷、延胡索乙素、延胡索甲素进行同时多组分的含量测定,以期为其质量控制提供参考依据。5种化合物结构式见图 1。
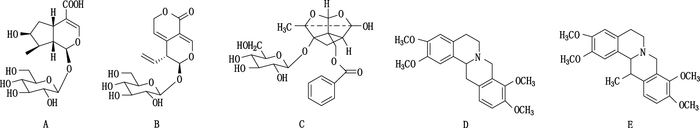
|
图 1 马钱苷酸(A)、龙胆苦苷(B)、芍药苷(C)、延胡索乙素(D)、延胡索甲素(E)的化学结构式 Figure 1 Structures of loganic acid(A), gentiopicroside(B), paeoniflorin(C), tetrahydropalmatine (D)and corydaline(E) |
Shimadzu LC-30AD UFLC色谱仪系统、SPD-20A型紫外检测器、Lab Solutions色谱工作站(日本岛津公司),AB135-S型十万分之一天平(METTLER TOLEDO仪器有限公司),BP210S型电子天平(德国Sartorius公司),VFD-2000真空冷冻干燥机(北京博医康实验仪器有限公司),KQ-250DB数控超声波清洗器(昆山市超声仪器有限公司),TGL-16高速台式冷冻离心机(沈阳杰龙仪器有限公司)。色谱柱为Waters xBridgeTm C18柱(十八烷基硅烷键合硅胶;4.6 mm×150 mm,3.5 μm;沃特斯仪器公司)。
对照品马钱苷酸(批号131220)购自上海融禾医药科技发展有限公司,龙胆苦苷(批号MUST-13082205)购自成都曼斯特生物科技有限公司,芍药苷(批号110736-201337)、延胡索乙素(批号110726-201213)购自中国食品药品检定研究院,延胡索甲素(批号MUST-12070501)购自成都曼斯特生物科技有限公司,纯度均>98%;乙腈、甲醇(色谱纯,美国Fisher公司),磷酸(色谱纯,天津市科密欧化学试剂有限公司),水为二次蒸馏水(杭州娃哈哈集团有限公司)。
当归、丹参、羌活、独活、川芎、延胡索、赤芍、秦艽、甘草、桂枝、乳香均购自辽宁省沈阳市医药同仁堂有限公司,经沈阳药科大学中药学院贾英教授鉴定为Root of Angelica sinensis(Oliv.)Diels,Root and rhizome of Salvia miltiorrhiza Bge.,Root and rhizome of Notopterygium incisum Ting ex H. T. Chang,Root of Angelica pubescens Maxim. f. biserrate,Rhizome of Ligusticum chuanxiong Hort.,Tuber of Corydalis yanhusuo W. T. Wang,Root of Paeonia veitchii Lynch.,Root of Gentiana macrophylla Pall.,Root and rhizome of Glycyrrhiza uralensis Fisch.,Twig of Cinnamomum cassia Presl,Boswellia carterii Birdw.。
2 方法与结果 2.1 混合对照品溶液的配制精密称取对照品马钱苷酸、龙胆苦苷、芍药苷、延胡索乙素、延胡索甲素适量,分别加甲醇溶解,制成质量浓度分别为1.500、5.110、4.992、1.084、1.200 g·L-1的对照品储备液。分别吸取上述对照品储备液1.00、1.45、1.00、0.25、0.15 mL,置同一5 mL量瓶中,加甲醇稀释至刻度,摇匀,即得马钱苷酸、龙胆苦苷、芍药苷、延胡索乙素、延胡索甲素质量浓度分别为300.0、150 2、998.3、54.20、36.00 mg·L-1的混合对照品溶液。
2.2 供试溶液的制备分别粉碎活络效灵丹中11味药材,过80目筛。按照处方配比,称取11味药材粉末适量,分别置于500 mL锥形瓶中,加入8倍量的70%丙酮水溶液,室温超声(800 W,40 kHz)45 min,4 000 r·min-1离心10 min,取上清液,50 ℃条件下旋蒸,混合,冻干。同法共制备3批活络效灵丹冻干粉样品,编号为S1~S3。取活络效灵丹冻干粉0.2 g(相当于总生药约1.26 g),精密称定,置50 mL具塞碘量瓶中,加75%甲醇溶液10 mL,称量,超声(800 W,40 kHz)提取30 min后,放冷,再次称量,并用75%甲醇溶液补足减失的量,提取液经13 000 r·min-1离心10 min,上清液用0.22 μm微孔滤膜滤过,取续滤液作为供试品溶液。同法分别制备缺赤芍、秦艽、延胡索的阴性对照品溶液和同时缺赤芍、秦艽和延胡索的阴性对照品溶液。
2.3 色谱条件色谱柱为Waters xBridgeTm十八烷基硅烷键合硅胶(C18)柱(4.6 mm×150 mm,3.5 μm);流动相A为乙腈,流动相B为0.02%磷酸水溶液,梯度洗脱程序见表 1;流速为1.2 mL·min-1;检测波长为230 nm;柱温为30 ℃;进样量为3 μL。
|
|
表 1 流动相梯度洗脱的时间程序 Table 1 Program of gradient elution |
分别取对照品溶液和供试品溶液,按照“2.3”项下色谱条件进行分析,结果马钱苷酸、龙胆苦苷、芍药苷、延胡索乙素、延胡索甲素的保留时间分别为6.655、13.156、17.37、25.055、29.691 min。5个成分与其他组分的色谱峰分离度良好,均大于1.5,理论塔板数均不低于7 000。拖尾因子为0.95~1.05,典型色谱图见图 2。
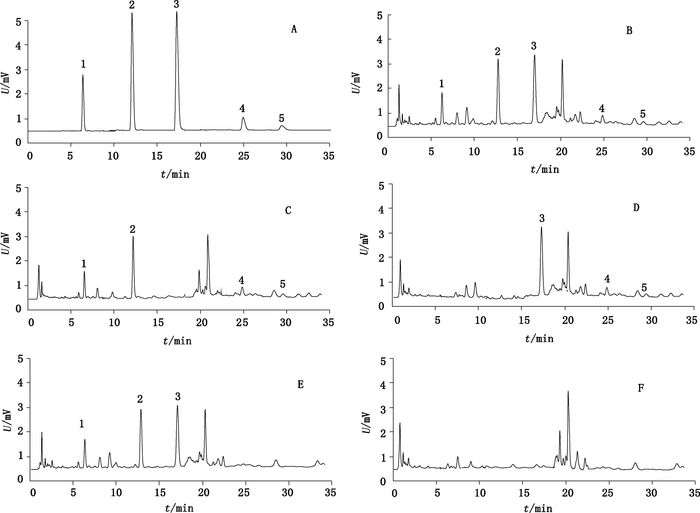
|
1.马钱苷酸(loganic acid)2.龙胆苦苷(gentiopicroside)3.芍药苷(paeoniflorin)4.延胡索乙素(tetrahydropalmatine)5.延胡索甲素(corydaline) 图 2 对照品(A)、活络效灵丹样品(B)、缺赤芍阴性样品(C)、缺秦艽阴性样品(D)、缺延胡索阴性样品(E)和同时缺赤芍、秦艽、延胡索阴性样品(F)在230 nm时的高效液相色谱图 Figure 2 HPLC chromatograms of reference substances(A), sample(B), negative sample without Root of Paeonia lactiflora (C), negative sample without Root of Gentiana macrophylla(D), negative sample without Tuber of Corydalis yanhusuo (E)and negative sample without Root of Paeonia lactiflora, Root of Gentiana macrophylla and Tuber of Corydalis yanhusuo (F), all detected at 230 nm |
分别精密移取混合对照品储备液适量,置同一2 mL量瓶中,加甲醇稀释并定容至刻度,摇匀,即得系列混合对照品溶液,其中马钱苷酸的质量浓度分别为9.375、18.75、37.50、75.00、150.0、300.0 mg·L-1,龙胆苦苷的质量浓度分别为45.99、91.98、83.96、367.9、735.8、150 2.4 mg·L-1,芍药苷的质量浓度分别为31.20、62.40、124.8、249.6、499.2、998.3 mg·L-1,延胡索乙素的质量浓度分别为1.693、3.387、6.775、13.55、27.10、54.20 mg·L-1,延胡索甲素的质量浓度分别为1.125、2.250、4.500、9.000、18.00、36.00 mg·L-1。按“2.3”项下色谱条件进样分析,以对照品质量浓度(X,mg·L-1)为横坐标,色谱峰面积(Y)为纵坐标,绘制标准曲线并进行回归计算,得5个成分的标准曲线、回归方程、相关系数和线性范围。见表 2。
|
|
表 2 5个成分的回归方程和线性范围 Table 2 The regression equations and linear ranges of five components |
取同一混合对照品溶液(马钱苷酸、龙胆苦苷、芍药苷、延胡索乙素、延胡索甲素质量浓度分别为75.00、367.9、249.6、13.55、9.000 µg·mL-1),按“2.3”项下色谱条件连续进样6次,测定峰面积,计算5个成分的RSD分别为1.1%、1.1%、0.9%、0.8%、1.4%,表明仪器精密度良好。
2.7 重复性试验取活络效灵丹加减方冻干粉S1,按“2.2”项下方法平行制备供试品溶液6份,按“2.3”项下色谱条件测定色谱峰面积,用外标法计算,马钱苷酸、龙胆苦苷、芍药苷、延胡索乙素、延胡索甲素含量的RSD分别为0.9%、1.2%、2.1%、2.3%、1.7%,表明该方法重复性良好。
2.8 稳定性试验取活络效灵丹加减方冻干粉S1,按“2.2”项下方法制备供试溶液1份,按“2.3”项下色谱条件,分别在0、1、2、4、8、12 h进样分析,测定峰面积,计算马钱苷酸、龙胆苦苷、芍药苷、延胡索乙素、延胡索甲素的RSD分别为0.5%、0.5%、0.6%、1.5%、2.1%,表明供试溶液在12 h内稳定性良好。
2.9 加样回收率试验取已知含量的活络效灵丹加减方冻干粉约0.1 g,精密称定,共6份,分别精密加入马钱苷酸、龙胆苦苷、芍药苷、延胡索乙素、延胡索甲素的对照品储备液各适量。按“2.2”项下方法操作,按“2.3”项下色谱条件进样分析,计算加样回收率。结果见表 3。
|
|
表 3 活络效灵丹5个成分的加样回收率(n=6) Table 3 Recoveries of the five constituents in Huoluo Xiaoling Dan |
取编号为S1、S2、S3的冻干粉,按照“2.2”项下方法制备供试品溶液,按照“2.3”项下色谱条件进样,测定峰面积,以外标法计算含量,结果见表 4。
|
|
表 4 活络效灵丹中5个成分含量测定结果[mg·g(冻干粉)-1,n=3] Table 4 Contents of five constituents in Huoluo Xiaoling Dan[mg·g(freeze-dried powder)-1, n=3] |
在选定的HPLC色谱条件下,对对照品单标溶液的紫外扫描发现,在230 nm检测波长下,马钱苷酸、芍药苷和延胡索乙素有最大吸收,龙胆苦苷和延胡索甲素的吸收也非常强,且无其他杂峰干扰,所以最终选择230 nm为检测波长。
3.2 色谱柱的选择试验中考察了2种不同型号的色谱柱,分别为Shimadzu Shim-pack XR-ODS II(75 mm×3.0 mm,2.2 μm)和Waters xBridgeTm C18(4.6 mm×150 mm,3.5 μm)。结果表明,采用Waters xBridgeTm C18色谱柱,各色谱峰的分离度良好,因此选择该色谱柱。
3.3 流动相的选择分别考察了甲醇-水、乙腈-水、乙腈-甲酸水和乙腈-磷酸水不同梯度洗脱系统,甲醇-水系统和乙腈-甲酸水系统在梯度洗脱时基线漂移严重,而乙腈-磷酸水系统基线良好,且各待测色谱峰都能与干扰峰基线分离,故实验选取乙腈-磷酸水系统为流动相。
3.4 冻干粉提取条件的选择采用三因素三水平的正交试验方法考察了提取溶剂(100%甲醇、75%甲醇溶液、50%甲醇溶液)、溶剂体积(40、50、60倍)、提取时间(20、30、40 min)对该中药复方中糖苷和生物碱的提取结果的影响,取活络效灵丹冻干粉0.2 g,精密称定,置50 mL具塞碘量瓶中,按照正交试验设计提取,超声,离心,0.22 μm微孔滤膜滤过,取续滤液进样分析,通过测定样品含量,结果表明,最佳提取条件为50倍量的75%甲醇溶液,超声30 min。
3.5 小结本文建立了同时测定活络效灵丹加减方中3个糖苷和2个生物碱类成分的含量测定方法,包括秦艽中的马钱苷酸、龙胆苦苷,赤芍中的芍药苷,延胡索中的延胡索乙素、延胡索甲素。方法简便可靠,具有很强的操作性,可为其质量控制提供参考依据。
| [1] |
王粉绒, 吴云, 艾玉, 等. RP-HPLC双波长法同时测定活络效灵丹加减方中9种有效成分的含量[J]. 沈阳药科大学学报, 2015, 32(10): 772. WANG FR, WU Y, AI Y, et al. Simultaneous determination of nine effetive constituents in Huoluo Xiaoling Dan by HPLC under double wavelength[J]. J Shenyang Pharm Univ, 2015, 32(10): 772. |
| [2] |
WANG FR, WU Y, AI Y, et al. Systematic chemical profiling of a multicomponent Chinese herbal formula Huoluo Xiaoling Dan by ultra high performance liquid chromatography coupled with electrospray ionization quadrupole time-of-flight mass spectrometry[J]. J Sep Sci, 2015, 38(6): 917. DOI:10.1002/jssc.201401245 |
| [3] |
陈长勋, 刘占文, 孙峥嵘, 等. 龙胆苦苷抗炎药理作用研究[J]. 中草药, 2003, 34(9): 814. CHEN CX, LIU ZW, SUN ZR, et al. Studies on anti-inflammatory effect of gentiopicroside[J]. Chin Tradit Herb Drugs, 2003, 34(9): 814. |
| [4] |
RECIO MC, GINER RM, MANEZ S, et al. Structural considerations on the iridoids as anti-inflammatory agents[J]. Planta Med, 1994, 60(3): 232. DOI:10.1055/s-2006-959465 |
| [5] |
ZHANG M, DAI SM. Mechanisms involved in the therapeutic effects of Paeonia lactiflora Pall as in rheumatoid arthritis[J]. Int Immunopharmacol, 2012, 14(1): 27. DOI:10.1016/j.intimp.2012.06.001 |
| [6] |
周婷. 芍药苷治疗类风湿关节炎及其他疾病的研究进展[J]. 医学综述, 2013, 19(13): 2382. ZHOU T. Research progress of paeoniflorin treating rheumatold arthritis and other diseases[J]. Med Recapitulate, 2013, 19(13): 2382. DOI:10.3969/j.issn.1006-2084.2013.13.026 |
| [7] |
TSUBOI H, HOSSAIN K, AKHAND AA, et al. Paeoniflorin induces apoptosis of lymphocytes through a redox-linked mechanism[J]. J Cell Biochem, 2004, 93(1): 162. DOI:10.1002/(ISSN)1097-4644 |
| [8] |
徐婷, 金昔陆, 曹惠明, 等. 延胡索乙素药理作用的研究进展[J]. 中国临床药学杂志, 2001, 10(1): 58. XU T, JIN XL, CAO HM, et al. Progress in pharmacological of dltetrahydropalmatine[J]. Chin J Clin Pharm, 2001, 10(1): 58. |
| [9] |
黄欢, 张哓喻, 张宏, 等. HPLC同步测定秦艽中龙胆苦苷和元胡中延胡索乙素的含量[J]. 药物分析杂志, 2007, 27(7): 1029. HUANG H, ZHANG XY, ZHANG H, et al. RP-HPLC-PDA determination of Getiana macrophylla Pall and corydails yanhusuo W. T. Wan in gentiopicrin and dl-tetrahydroplmatine[J]. Chin J Pharm Anal, 2007, 27(7): 1029. |
| [10] |
WU Y, WANG FR, AI Y, et al. Simultaneous determination of seven coumarins by UPLC-MS/MS:Application to a comparative pharmacokinetic study in normal and arthritic rats after oral administration of Huoluo Xiaoling Dan or single-herb extract[J]. J Chromatogr B, 2015, 991: 108. DOI:10.1016/j.jchromb.2015.04.017 |
| [11] |
ZHANG RX, ARTHUR YF, ZHOU AN, et al. Extract of the Chinese herbal formula Huoluo Xiaoling Dan inhibited adjuvant arthritis in rats[J]. J Ethnopharm, 2009, 121: 366. DOI:10.1016/j.jep.2008.11.018 |
| [12] |
吴立宏, 叶燕, 李兴尚, 等. 反相高效液相色谱法测定道地产区秦艽药材中龙胆苦苷的含量[J]. 药物分析杂志, 2009, 29(2): 184. WU LH, YE Y, LI XS, et al. RP-HPLC determination of gentiopcroside in Radix Gentianae Macrophyllae in traditional areas[J]. Chin J Pharm Anal, 2009, 29(2): 184. |
 2017, Vol. 37
2017, Vol. 37 
