血脑屏障可以阻止许多化合物进入大脑,但这其中也包括发挥治疗作用的药物小分子,从而阻碍了它们发挥应有的药效,是导致脑部疾病治疗失败的主要原因。因此,为了提高药物在脑内的累积量,达到有效的治疗浓度,人们对血脑屏障上发挥屏障作用的主要转运蛋白从不同角度进行了研究。本文根据近年来国内外发表的相关文献,对血脑屏障上的P-糖蛋白和乳腺癌耐药蛋白的研究概况进行了综述,主要包括2种转运蛋白的基本功能特点、体内外研究方法和蛋白定量分析方法等。
1 血脑屏障上的P-糖蛋白和乳腺癌耐药蛋白血脑屏障是由无窗孔的毛细血管内皮细胞(脑微血管内皮细胞)及其细胞间紧密连接、基膜(毛细血管基底膜)及嵌入其中的周细胞、星形胶质细胞足突和极狭小的细胞外隙共同组成的一个细胞复合体,是存在于脑和脊髓内的毛细血管与神经组织之间的一个调节中枢神经系统内环境的细胞屏障,能够维持脑内离子、激素和递质等的动态平衡,其中脑的毛细血管内皮细胞及其紧密连接是血脑屏障的主要形态学基础[1]。血脑屏障可以阻止100%大分子和超过98%的小分子药物进入脑中,使其远离循环系统中的毒素和有害化学物质,从而起到保护大脑的作用[2]。血脑屏障中主要发挥屏障作用的是ATP结合盒(adenosine triphosphate-binding cassette,ABC)转运蛋白,例如P-糖蛋白(P-glycoprotein,P-gp,ABCB1,MDR1)和乳腺癌耐药蛋白(breast cancer resistance protein,BCRP,ABCG2)[3]。
1.1 P-gp的基本特点P-gp是与多药耐药密切相关的糖蛋白。编码P-gp的基因在人体中为MDR 1,P-gp基因定位于染色体7q21-1[4],蛋白质分子量为170 KD,由1 280个氨基酸组成。P-gp以单体形式发挥功能,由2个胞浆核苷酸结合域(也称为ATP结合区)(cytosolic nucleotide binding domains,NBDS)和2个跨膜结构域(transmembrane domains,TMDS)构成。NBDS可以结合并水解ATP,该区域为亲水区,与能量供应有关;TMDS为疏水区,作为药物转运的通道,每个区域又由6个跨膜α-螺旋构成,从而形成基底膜交叉通路,在这里用由ATP水解产生的能量来对底物进行跨膜转运[5]。ATP结合区是P-gp外排功能所必须的,它是ATP依赖性的药物外排泵[6],能将细胞内的药物泵出细胞膜外,从而使细胞内的药物浓度降低。
1.2 BCRP的基本特点BCRP是一个ABC半转运蛋白,BCRP的基因位于染色体4q22上[7]。其mRNA大小为2.4 kb,编码655个氨基酸,72.6 KD的蛋白质[8]。BCRP是一种半转运体,只有一个NBD和一个TMD,同时以二聚体形式发挥功能。也有人提出BCRP是以同源四聚体的形式发挥它的功能的[9]。ABC转运蛋白家族中的半转运子一般定位于胞内,全转运子定位于胞膜,但与其他半转运子不同的是BCRP虽属半转运子却定位于细胞膜[7]。
1.3 P-gp和BCRP在血脑屏障上的定位和功能P-gp和BCRP在血脑屏障上呈现高表达的状态[10],其中P-gp主要表达于脑毛细血管内皮的管腔侧,脑实质、神经元和神经胶质细胞中表达较少[11],同样地,BCRP也主要存在于脑毛细血管内皮管腔侧,位置和P-gp相近[12]。这2个转运蛋白可以阻止底物分子渗透入大脑,并且向外定向转运,主要负责外排许多亲脂性、两亲性的有毒物质或药物,且它们之间结构没有相关性,包括抗炎药、免疫抑制剂、抗感染药、抗肿瘤药、抗癫痫药、抗抑郁药和精神药等[10]。P-gp和BCRP的底物有一定的重叠性,在药物入脑的过程中起到协同屏障作用。有研究显示,P-gp和BCRP可以限制吉非替尼、达沙替尼和索拉菲尼等抗癌药物进入大脑,且存在协同限制现象[13-16]。相应的也有对P-gp和BCRP 2个蛋白同时产生抑制作用的双抑制剂,例如:依克立达。血脑屏障上的P-gp还具有多种生理功能,包括外排、分泌、脂质转运和Cl-通道功能[17]。
1.4 P-gp和BCRP的区别与联系综上所述,P-gp和BCRP同属于ABC转运蛋白,是ATP依赖性转运蛋白,基本结构都是由NBD和TMD组成,P-gp是全转运子,而BCRP是半转运子。它们发挥功能的形式不同,P-gp是单体,而BCRP是二聚体或四聚体。它们在血脑屏障上表达位置相近,都在脑毛细血管内皮的管腔侧。这2个转运蛋白在血脑屏障上一起发挥着阻止外来物质进入大脑的功能,且转运底物有重叠性。表 1中列举了常见P-gp和BCRP的底物、抑制剂及双底物和双抑制剂。
|
|
表 1 常见P-gp和BCRP的底物、抑制剂及双底物和双抑制剂 Table 1 Common P-gp and BCRP substrates, inhibitors, and dual substrates, dual inhibitors |
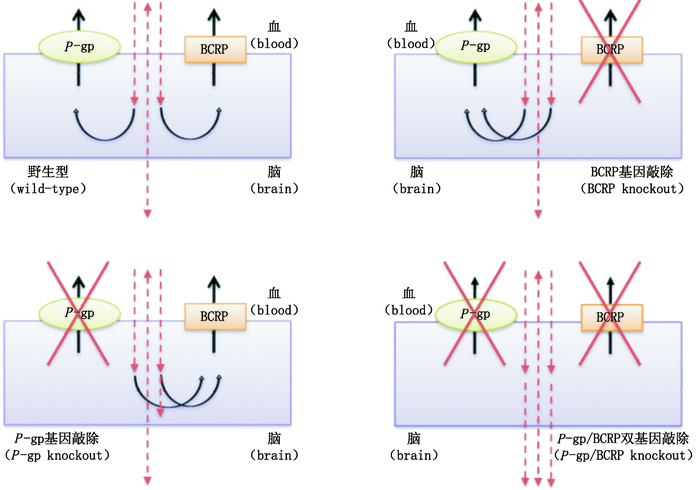
目前,许多小分子药物都是P-gp和BCRP的底物,不能有效地穿过血脑屏障,因此,人们提出这2个转运蛋白的双抑制可能是一种提高底物药物大脑渗透率的有效方法[18]。对于P-gp和BCRP的双底物来说,在缺失一个转运蛋白的情况下,药物进入大脑的转运并没有显著增加,但是当血脑屏障上2个转运蛋白同时缺失或被抑制时,药物的脑内渗透率达到最高水平;无论是单独抑制P-gp还是BCRP,它们都可以由另一个转运蛋白进行补偿性转运,由此可见,这2个转运蛋白以“合作”的形式阻止化疗药物进入大脑,详见图 1[15],从图 1中可看出,血脑屏障上P-gp和BCRP以合作的形式阻止双底物进入大脑。无论是单独抑制或敲除P-gp和BCRP两者之一,都不会使双底物的大脑渗透率显著增加。在BCRP基因敲除小鼠(P-gp存在),P-gp足以阻止药物进入大脑。同样,在P-gp基因敲除小鼠(BCRP存在),BCRP也足以阻止药物进入大脑。双底物的大脑渗透增强最显著的效果总是出现在P-gp/BCRP双基因敲除的小鼠身上,即P-gp和BCRP都缺失的条件下。
|
图 1 血脑屏障上P-gp和BCRP的合作 Figure 1 Cooperation of P-gp and BCRP at the blood-brain barrier |
目前血脑屏障上的P-gp和BCRP的体外研究方法主要是采用细胞模型。体外模拟血脑屏障功能的单细胞系有:脑微血管内皮细胞(Brain microvascular endothelial cells,BMECs)、C6胶质瘤细胞系(C6 glioma cell lines)和人脐静脉内皮细胞(the umbilical vein endothelial,ECV-304),可进行细胞摄取/外排实验、转运实验和ATP酶检测、评价药物与P-gp和BCRP相互作用等。血脑屏障是由BMECs构成的,所以紧凑的BMECs单细胞层是一种常见的细胞模型[19]。Ji等[20]研究一种洛美利嗪衍生物CJZ3对P-gp功能的影响,结果表明CJZ3和大鼠脑微血管内皮细胞(rat brain microvessel endothelial cells,RBMEC)孵育后细胞内罗丹明123(Rh123)的累积呈现浓度依赖性,但是在人脐静脉内皮细胞则没有该现象。Decleves等[21]用大鼠C6胶质瘤细胞(rat C6 glioma cells)研究ABC转运蛋白对伊马替尼及其活性代谢产物的药代动力学影响,结果表明,随着细胞外的伊马替尼浓度从0.5 μmol·L-1上升到50 μmol·L-1,大鼠C6胶质瘤细胞中该药物的浓度呈线性增加,但是并没有因为加入Zosuquidar(选择性P-gp抑制剂)或依克立达(Elacridar,P-gp和BCRP双抑制剂)而增加。
早期的细胞模型多为单细胞培养,近年来逐渐出现2种细胞共培养和3种细胞共培养模型。脑微血管内皮细胞单独培养可导致P-gp的表达减弱、细胞间紧密联结丧失,无法适应药物转运的研究;将脑微血管内皮细胞或内皮细胞株与神经胶质细胞共培养建立起的离体血脑屏障模型能较好地模拟的血脑屏障生理状态,为研究血脑屏障上P-gp药物外排功能提供了较理想的工具[22]。Wang等[23]用人脐静脉内皮细胞和星形胶质细胞共培养研究麝香酮在体外血脑屏障模型上对P-gp的作用,结果表明,当给予细胞模型不同浓度(4、8、16 μmol·L-1)麝香酮刺激24 h后,P-gp的表达量显著下降。Nakagawa等[24]又研究出一种新的自体血脑屏障模型,采用脑血管内皮细胞、周细胞和星形胶质细胞,进行原代共培养,用以模拟体内的血脑屏障生理状态,在新模型中的脑血管内皮细胞表达葡萄糖转运蛋白、P-gp和多药耐药蛋白-1,同时表现出对P-gp底物罗丹明123外排作用。共培养的细胞可以形成紧密连接,表达细胞表面的受体,且具有细胞转运功能,因此比永生的内皮细胞系能更好的模拟血脑屏障在体内的实际状态[25]。
采用细胞模型对血脑屏障上的转运蛋白进行体外研究,具有实验材料容易获得[26],给药剂量小,药物分析方法简单、快速,实验条件易控制,可模拟体内复杂的生理条件,从分子水平研究药物相互作用发生的机制等优点,可以预测药物在体内血脑屏障处的渗透性,并在一定程度上可以取代实验动物。但是细胞模型作为一种体外研究模型存在一定局限性,如细胞的培养条件、传代次数不同,P-gp表达水平不同;体外细胞模型P-gp表达水平与人体内血脑屏障实际的P-gp表达水平可能具有差异,并不能完全还原体内血脑屏障[27];且生物体是一个复杂的系统,有很多因素会影响药物的渗透过程,所以想明确药物与P-gp相互作用还要借助体内研究方法[17]。
2.2 体内研究方法 2.2.1 基因敲除动物模型目前已发现的人类P-gp基因家族有2个成员:MDR1和MDR3基因;啮齿类P-gp基因家族包括3种:mdr1a、mdr1b和mdr2。MDR1与mdr1a/mdr1b编码的P-gp可作为药物载体将药物排出细胞;而MDR3与mdr2编码的P-gp则为磷脂的转运载体[28]。人们用转基因技术建立了mdr1a(类似于人MDR1)基因缺失小鼠,这种小鼠没有明显的生理缺陷,并可以繁殖,称为mdr1a(-/-)基因敲除(KO)小鼠;目前一共有3种可获得的目标小鼠:mdr 1a(abcb1a)(-/-)KO小鼠、mdr1b(abcb1b)(-/-)KO小鼠和mdr1a/mdr1b(-/-)双基因敲除小鼠。在血脑屏障上只有mdr1a P-gp基因表达,而mdr1b P-gp基因并不表达;因此mdr1a(-/-)和mdr1a/1b(-/-)KO小鼠都是研究血脑屏障上P-gp的合适模型;P-gp的基因敲除的小鼠表型正常,但对P-gp底物的毒性更敏感[29]。而BCRP在鼠类中命名为Bcrp1,已有Bcrp1(-/-)KO的小鼠以及P-gp和Bcrp1双基因敲除小鼠[30]。基因敲除小鼠是研究P-gp和BCRP转运蛋白的重要工具,但目前由于模型较少、供货渠道单一和价格较高等问题,限制了其广泛的使用[28]。
Agarwal等[18]用雄性FVB小鼠的野生型,Mdr1a/b(-/-),Bcrp1(-/-)和Mdr1a/b(-/-)Bcrp1(-/-)基因敲除型进行试验,研究厄洛替尼的稳态脑内分布;结果表明在血脑屏障上,P-gp和BCRP可以将厄洛替尼排出大脑,当这2个基因敲除即转运蛋白不存在时,厄洛替尼在脑内的分布显著增加。Li等[31]用Bcrp1(-/-)敲除的小鼠对培美曲塞和甲氨蝶呤在血脑屏障上的转运状况进行研究;结果显示,BCRP对培美曲塞转运的影响很小,但是对甲氨蝶呤外排作用很显著。
体外研究表明,曲美替尼是P-gp和BCRP底物,在血脑屏障处发现其对曲美替尼有外排转运作用。Vaidhyanathan等[32]在基因敲除小鼠模型上证实,P-gp对限制曲美替尼的脑内分布起着重要的作用;与野生型和Brcp1(-/-)小鼠相比,Mdr1a/b(-/-)和Mdr1a/b(-/-)Bcrp1(-/-)小鼠的脑血分配系数(AUCbrain/AUCplasma)约为前者的5倍;曲美替尼在野生型和BCRP基因敲除小鼠大脑中分布相似;这些结果表明,P-gp是限制曲美替尼在脑中分布的重要因素;在曲美替尼单药或联合用药治疗黑色素瘤脑转移时,P-gp也发挥着重要作用。
有研究用基因敲除小鼠证明,Abcb1a和Abcg2共同作用于限制双ABCB1/ABCG2蛋白底物的脑内分布;当只有一个Abcb1a或Abcg2基因被敲除时,另一个转运蛋白仍然会抑制该双蛋白底物向脑内转运,所以只有当2个基因同时被敲除时,双蛋白底物才能顺利地进入大脑,该类底物包括:米托蒽醌、厄洛替尼、拉帕替尼和拓扑替康[33-35]。
2.2.2 原位脑灌注技术原位脑灌注技术(in situ brain perfusion)主要应用于研究药物在血脑屏障上的转运,它可用于测量几个转运参数,包括分布体积和在摄取初期(15~120 s)内脑对目标分子的摄取清除率(brain uptake clearance,Clup),其中Clup是综合了血脑屏障上的转运蛋白的增强或者限制因素的结果。该技术可以让我们用转运的抑制剂或者转运蛋白基因敲除小鼠来判断某一个转运蛋白的作用。如果当加入一个转运蛋白抑制剂或者该蛋白的基因被敲除,而目标分子的Clup升高,那么我们得出该转运蛋白是目标分子在血脑屏障上的外排转运蛋白;如果目标分子的Clup降低,则证明该转运蛋白是目标分子的内排转运蛋白[36]。Mdr1a(-/-)小鼠在体原位脑灌流技术目前已用于研究P-gp对药物脑内分布的影响,此方法可排除药物体内蛋白结合、代谢等因素的影响,单独研究P-gp对药物脑通透性的作用[37]。Seleman等[38]用原位脑灌注技术研究小鼠的血脑屏障对海洛因及其代谢产物6-单乙酰吗啡的转运过程,结果显示P-gp的抑制剂显著增加大脑对吗啡的摄取,但是并没有增加大脑对海洛因及6-单乙酰吗啡的摄取。Chapy等[39]以P-gp/Bcrp基因敲除小鼠或者抑制剂为条件,用原位脑灌注的方法检测ABC转运蛋白底物的脑内分布,结果表明,P-gp的缺失或者是化学抑制剂的加入,可以提高[3H]-维拉帕米在脑内的分布10倍左右。
2.2.3 正电子发射断层扫描术正电子发射断层扫描术(positron emission tomography,PET)是一种非侵入性的核成像技术,可以评估标记正电子发射放射性核素的药物在人体内脑的分布情况[40]。当PET的观测重点从人转向临床前各个种属动物,如大鼠、小鼠、犬、猴等时则被称为Micro-PET。Micro-PET显像原理和人体PET相同,将放射性核素标记到能够参与组织血流、蛋白合成或代谢过程的化合物或者底物或药物上,然后将其注射到动物体内。该方法通常采用具有超短半衰期的发射正电子的核素(如[11C]、[13N]、[15O]、[18F])作为标记物,在药动学研究中又以[11C]标记底物/药物最为常见。然后让整体动物或者其靶器官在Micro-PET的有效视野范围内进行动态定量显像,之后在获得Micro-PET示踪剂在体内的空间、数量分布后通过影像定量分析软件(如PMOD等)获取各组织器官(横断面、冠状断面和矢状断面)动态变化图像以及相关定性定量数据(如浓度经时曲线或动力学参数等)。Micro-PET作为一种非伤害性的活体生化显像技术,可以通过显像从体内无创伤、定量、动态地观察机体的生理、生化变化,观察标记药物体内的动力学过程,揭示药物转运、分布以及药物相互作用、药效靶点甚至产生毒性的分子机制,进而从分子和整体水平上为药物研发提供有力理论支撑[41]。
Toth等[42]应用PET分别检测给予[11C] AZ10419369的小鼠、大鼠和豚鼠在基态条件下的吸收,并与动物提前给ABC转运蛋白抑制剂环孢菌素A后脑内[11C] AZ10419369的吸收进行比较,结果表明,[11C] AZ10419369是小鼠、大鼠和豚鼠的ABC转运蛋白底物,该实验同时可以证明同一种药物的脑内浓度存在种间差异。Bauer等[43]以[11C]Elacridar和[11C]Tariquidar为2个模型药物,用PET检测健康志愿者血脑屏障上ABCB1和ABCG2的功能之间的相互关系,结果表明需要同时抑制ABCB1和ABCG2,才能大幅增加双蛋白底物的脑内分布。
3 转运蛋白的定量测定 3.1 蛋白质印迹法(Western Blot)目前有几种不同的方法可以用来对生物样品中的蛋白质进行定量。最常用的半定量分析蛋白表达仍然是标准的SDS-PAGE/Western blot法,先用变性聚丙烯酰胺凝胶电泳(denaturing SDS-PAGE)根据分子量不同对蛋白质进行一维分离,用特异性的一抗标记目标蛋白,然后用二抗可视化相应的条带,最后测其光密度值(optical density,OD值)表示蛋白的量,该法被用于研究目标蛋白在对照状态和实验条件下的表达变化[44]。
Hu等[45]给MDCK-MDR1细胞不同浓度的川芎内酯(ligustilide,LIG)、芎草穷交脂I(Senkyunolide I,SENI)和洋川芎内酯A(Senkyunolide A,SENA),然后用Western blot法测细胞内的P-gp表达含量,结果表明,MDCK-MDR1细胞中的P-gp表达含量都显著下降,从而证明了LIG、SENI和SENA是通过下调MDCK-MDR1细胞中P-gp表达,从而增加芍药苷(Paeoniflorin,PF)在血脑屏障上的转运。Darby等[46]用Western Blot方法分析Pim1激酶抑制剂对MCF7FLV1000细胞系中ABCG2的表达影响;MCF7FLV1000细胞在有或无Pim1抑制剂K00486(4 μmol·L-1)的条件下,培养8 d后,Western Blot法检测细胞中ABCG2的表达;结果显示,对照组MCF7FLV1000细胞中ABCG2的表达增加了5倍;相反,在Pim1激酶抑制剂存在下,ABCG2的表达没有显著变化,第8天的表达含量和第0天的相似。
原则上来说,任何生物样品都可以采用Western blot检测,细胞、组织提取物和体液,例如血浆、血清或尿液。该法操作简单,价格相对便宜,得到的数据相对容易解释,从理论上说结果的重现性较好。但是它也有固有的缺点,此法的特异性受到抗体选择性的影响,常常难以区别相同家族不同亚型的蛋白;且此法仅仅是相对定量,而非绝对定量;由于药物代谢酶和转运体具有高度的序列同源性,因此现有免疫印迹法缺乏专属性,伴有一定的抗原-抗体交叉反应,导致定量准确性差[44]。
3.2 定量蛋白质组学近年来基于生物质谱的蛋白定量研究能够精确测定在不同状态下生物体内的蛋白表达及其翻译后的修饰水平,实现蛋白质的相对或绝对定量,已逐渐应用于药物代谢酶、转运体以及多肽生物药物的定量分析[47]。绝对目标定量蛋白质组学(quantitative targeted absolute proteomics,QTAP)是用多反应监测(multiple reaction monitoring,MRM)模式下的液相色谱-串联质谱(liquid chromatography-linked tandem mass spectrometry,LC-MS/MS)分离和定量消化后的目标蛋白,从而得出目标蛋白的绝对含量[48]。
基于生物质谱的蛋白质组学定量方法主要步骤如下:①将来自于生物样本(组织、细胞培养液、体液)中的目标蛋白进行提取溶解;②通过电泳、液相色谱或等电聚焦方法对目标蛋白进行分离纯化;③在蛋白酶的作用下,将目标蛋白进行消化酶解,得到相应的特征肽段;④通过质谱对目标蛋白的特征肽段的分析,实现对蛋白的相对或绝对定量[49]。LC-MS/MS方法已经用于药物等小分子化合物的定量分析,但是由于蛋白质的分子量太大,质量超出了常规质谱定量分析的范围,因此蛋白质必须先用蛋白酶(例如,胰蛋白酶)消化,然后目标蛋白的特征肽段才能用LC-MS/MS法进行定量分析;胰蛋白酶消化对于膜蛋白定量十分重要,因为膜蛋白由于有疏水区而表现出低溶解度和高聚集性;膜蛋白被胰蛋白酶消化后,可以产生来源于不同区域的肽段,从而我们可以选择一个具有适当的疏水性的肽段进行LC-MS/MS定量分析;为了实现高选择性的定量分析,目标肽段用三重四极杆串联质谱多反应监测模式进行定量分析;此外,内标对于准确定量是十分重要的,对于肽段定量,选择和目标肽段氨基酸序列相同的稳定同位素标记肽段(stable isotope-labeled peptide)作为内标;内标肽段和目标肽段可以同时被洗脱,但是在MS中可以根据分子量不同而被区分;最后,可以根据色谱图中目标肽段和内标肽段之间的峰比值(peak ratio)得出目标肽段的绝对量[50]。
Agarwal等[26]用该法定量地检测P-gp和Bcrp及其他相关蛋白在基因敲除小鼠模型脑毛细血管内皮细胞的表达情况;在野生型和Bcrp1(-/-)小鼠之间,P-gp表达量的差异没有统计学意义;同样的,在野生型和Mdr1a/b(-/-)小鼠之间,Bcrp表达量差异也不显著;除了缺失P-gp和Bcrp基因的小鼠不表达相应的蛋白外,不同基因型的小鼠脑内毛细血管内皮细胞中的蛋白质的表达量都无显著性差异;使用定量蛋白质组学的方法表明,从单、双基因敲除小鼠中分离的脑毛细血管内皮细胞中几个相关转运蛋白的表达量没有变化;这些数据表明,P-gp和BCRP在血脑屏障上的相互作用机制并不是蛋白表达量代偿性变化。
Ramzi等[51]用定量RT-PCR和LC-MS/MS法检测从12位病人大脑皮质灰质分离出来的脑微血管样品,这些病人患癫痫或者有神经胶质瘤,对ABC转运体中的BCRP、P-gp、ABCA2和ABCA8进行了定量,结果显示,BCRP是表达量最高的ABC转运蛋白,且表达量是P-gp的1.6倍。Ohtsuki等[52]基于LC-MS/MS靶向定量蛋白组学的技术检测hCME C/D3细胞系表达的蛋白,以评价该细胞系作为模拟血脑屏障功能模型的可行性和局限性;结果显示,在hCMEC/D3细胞表达91个目标分子、12个转运体、2个受体、1连接蛋白和1膜标记物;hCMEC/D3细胞系上P-gp的表达量最高,BCRP的表达量是它的56.3%;用Na+-K+-ATP酶表达量标准化后,hCMEC/D3细胞系和人脑微血管细胞相比,P-gp和BCRP的表达量都相差4倍以内。
和传统的免疫印迹定量法相比,基于LC-MS/MS在多反应监测模式下的靶向蛋白质组学具有选择性好、精度好、准确度高、分析速度快等优点;此外,LC-MS/MS蛋白质组学具有更广泛的适用性,它不需要对个别蛋白质的选择性抗体,表 2中列举了传统的半定量免疫定量法和LC-MS/MS蛋白质组学的区别和差异[53]。
|
|
表 2 免疫印迹法定量与基于LC-MS/MS定量分析的比较 Table 2 Comparison of antibody and LC-MS/MS-Based quantitative analysis |
血脑屏障上的转运蛋白P-gp和BCRP对阻止外源性和有害物质入脑起着重要的作用。目前对血脑屏障上的转运蛋白研究主要包括体外的细胞实验和体内的动物实验,其中体外的研究方法主要有细胞模型,从单细胞培养、2种细胞共培养到3种细胞共培养;而体内的研究方法主要有应用基因敲除小鼠、脑原位灌注技术、正电子扫描断层技术等。体外细胞模型实验条件易控制,可模拟体内复杂的生理条件,但是并不能完全还原体内血脑屏障,所以仍需要做体内的实验来验证细胞模型的实验结果。对P-gp和BCRP的定量有蛋白质印迹法的相对定量法,也有绝对目标定量蛋白质组学的绝对定量法,尽管基于生物质谱的蛋白定量技术目前还处于初步阶段,但随着该技术的日趋完善,有望成为蛋白质定量的主要方法。
| [1] |
董小平, 喻斌, 金路, 等. 血脑屏障细胞组成研究进展[J]. 中国实验方剂学杂志, 2012, 18(8): 281. DONG XP, YU B, JIN L, et al. Advance in study of cells of bloodbrain barrier[J]. Chin J Exp Tradit Med Form, 2012, 18(8): 281. |
| [2] |
PARDRIDGE WM. The blood-brain barrier:bottleneck in brain drug development[J]. NeuroRx, 2005, 2(1): 3. DOI:10.1602/neurorx.2.1.3 |
| [3] |
SCHINKEL AH, JONKER JW. Mammalian drug efflux transporters of the ATP binding cassette(ABC)family:an overview[J]. Adv Drug Deliv Rev, 2003, 55(1): 3. DOI:10.1016/S0169-409X(02)00169-2 |
| [4] |
MOLNAR J, KARS MD, GUNDUZ U, et al. Interaction of tomato lectin with ABC transporter in cancer cells:glycosylation confers functional conformation of P-gp[J]. Acta Histochem, 2009, 111(4): 329. |
| [5] |
LI C, SUN BQ, GAI XD. Compounds from Chinese herbal medicines as reversal agents for P-glycoprotein-mediated multidrug resistance in tumours[J]. Clin Transl Oncol, 2014, 16(7): 593. DOI:10.1007/s12094-014-1169-7 |
| [6] |
HOOSAIN FG, CHOONARA YE, TOMAR LK, et al. Bypassing P-glycoprotein drug efflux mechanisms:possible applications in pharmacoresistant schizophrenia therapy[J]. Biomed Res Int, 2015, 2015: 484963. DOI:10.1155/2015/484963.Epub2015Sep27 |
| [7] |
赵亚超, 张志培, 陈鹏, 等. 乳腺癌耐药蛋白的研究进展[J]. 现代生物医学进展, 2010, 10(2): 369. ZHAO YC, ZHANG ZP, CHEN P, et al. Research advance of breast cancer resistance protein[J]. Prog Mod Biomed, 2010, 10(2): 369. |
| [8] |
ROCCHI E, KHODJAKOV A, VOLK EL, et al. The product of the ABC half-transporter gene ABCG2(BCRP/MXR/ABCP)is expressed in the plasma membrane[J]. Biochem Biophys Res Commun, 2000, 271(1): 42. DOI:10.1006/bbrc.2000.2590 |
| [9] |
XU Y, EGIDO E, LI-BLATTER X, et al. Allocrite sensing and binding by the breast cancer resistance protein(ABCG2)and P-glycoprotein(ABCB1)[J]. Biochemistry, 2015, 54(40): 6195. DOI:10.1021/acs.biochem.5b00649 |
| [10] |
STRAZIELLE N, GHERSI-EGEA JF. Efflux transporters in bloodbrain interfaces of the developing brain[J]. Front Neurosci, 2015, 9(21): 1. |
| [11] |
QOSA H, MILLER DS, PASINELLI P, et al. Regulation of ABC efflux transporters at blood-brain barrier in health and neurological disorders[J]. Brain Res, 2015, 1628(Pt B): 298. |
| [12] |
陆榕, 孙进, 赵春顺, 等. 转运蛋白在药物血脑屏障转运中的重要作用[J]. 中国新药与临床杂志, 2007, 26(1): 64. LU R, SUN J, ZHAO CS, et al. Transporters:significant role in drug blood-brain barrier transport[J]. Chin J New Drugs Clin Rem, 2007, 26(1): 64. |
| [13] |
CHEN Y, AGARWAL S, SHAIK NM, et al. P-glycoprotein and breast cancer resistance protein influence brain distribution of dasatinib[J]. J Pharmacol Exp Ther, 2009, 330(3): 956. DOI:10.1124/jpet.109.154781 |
| [14] |
AGARWAL S, SANE R, GALLARDO JL, et al. Distribution of gefitinib to the brain is limited by P-glycoprotein(ABCB1)and breast cancer resistance protein(ABCG2)-mediated active efflux[J]. J Pharmacol Exp Ther, 2010, 334(1): 147. DOI:10.1124/jpet.110.167601 |
| [15] |
AGARWAL S, HARTZ AM, ELMQUIST WF, et al. Breast cancer resistance protein and P-glycoprotein in brain cancer:two gatekeepers team up[J]. Curr Pharm Des, 2011, 17(26): 2793. DOI:10.2174/138161211797440186 |
| [16] |
AGARWAL S, SANE R, OHLFEST J R, et al. The role of the breast cancer resistance protein(ABCG2)in the distribution of sorafenib to the brain[J]. J Pharmacol Exp Ther, 2011, 336(1): 223. DOI:10.1124/jpet.110.175034 |
| [17] |
吴云娟, 方晓玲. P-糖蛋白在药物脑部转运中作用的研究进展[J]. 中国临床药学杂志, 2004, 13(6): 382. WU YJ, FANG XL. Research advancement of P-glycoprotein in drug brain transport[J]. Chin J Clin Pharm, 2004, 13(6): 382. |
| [18] |
AGARWAL S, MANCHANDA P, VOGELBAUM MA, et al. Function of the blood-brain barrier and restriction of drug delivery to invasive glioma cells:findings in an orthotopic rat xenograft model of glioma[J]. Drug Metab Dispos, 2013, 41(1): 33. DOI:10.1124/dmd.112.048322 |
| [19] |
WANG Y, WANG N. In vitro model of the blood-brain barrier established by co-culture of primary cerebral microvascular endothelial and astrocyte cells[J]. Neural Regen Res, 2015, 10(12): 2011. DOI:10.4103/1673-5374.172320 |
| [20] |
JI BS, HE L, LI XQ, et al. CJZ3, a lomerizine derivative, modulates P-glycoprotein function in rat brain microvessel endothelial cells[J]. Acta Pharmacol Sin, 2006, 27(4): 414. DOI:10.1111/aphs.2006.27.issue-4 |
| [21] |
DECLEVES X, BIHOREL S, DEBRAY M, et al. ABC transporters and the accumulation of imatinib and its active metabolite CGP74588 in rat C6 glioma cells[J]. Pharmacol Res, 2008, 57(3): 214. DOI:10.1016/j.phrs.2008.01.006 |
| [22] |
GAILLARD PJ, VOORWINDEN LH, NIELSEN JL, et al. Establishment and functional characterization of an in vitro model of the blood-brain barrier, comprising a co-culture of brain capillary endothelial cells and astrocytes[J]. Eur J Pharm Sci, 2001, 12(3): 215. DOI:10.1016/S0928-0987(00)00123-8 |
| [23] |
WANG GY, WANG N, LIAO HN. Effects of muscone on the expression of P-gp, MMP-9 on blood-brain barrier model in vitro[J]. Cell Mol Neurobiol, 2015, 35(8): 1105. DOI:10.1007/s10571-015-0204-8 |
| [24] |
NAKAGAWA S, DELI MA, KAWAGUCHI H, et al. A new bloodbrain barrier model using primary rat brain endothelial cells, pericytes and astrocytes[J]. Neurochem Int, 2009, 54(3-4): 253. DOI:10.1016/j.neuint.2008.12.002 |
| [25] |
KAFA H, WANG JT, RUBIO N, et al. The interaction of carbon nanotubes with an in vitro blood-brain barrier model and mouse brain in vivo[J]. Biomaterials, 2015, 53: 437. DOI:10.1016/j.biomaterials.2015.02.083 |
| [26] |
AGARWAL S, UCHIDA Y, MITTAPALLI RK, et al. Quantitative proteomics of transporter expression in brain capillary endothelial cells isolated from P-glycoprotein(P-gp), breast cancer resistance protein(Bcrp), and P-gp/Bcrp knockout mice[J]. Drug Metab Dispos, 2012, 40(6): 1164. DOI:10.1124/dmd.112.044719 |
| [27] |
宋娟, 刘晓磊, 彭文兴. P-糖蛋白介导药物相互作用的细胞模型研究概况[J]. 中国药房, 2006, 17(15): 1183. SONG J, LIU XL, PENG WX. Research advancement of the cell model of P-glycoprotein mediated drug interactions[J]. J China Pharm, 2006, 17(15): 1183. DOI:10.3969/j.issn.1001-0408.2006.15.029 |
| [28] |
何卉, 陈西敬, 王广基. 基因敲除与基因突变动物模型在药物跨膜转运研究中的应用[J]. 中国药科大学学报, 2005, 36(6): 483. HE H, CHEN XJ, WANG GJ. Application of gene knockout and gene mutation animal model in the study of transmembrane transport of drugs[J]. J China Pharm Univ, 2005, 36(6): 483. DOI:10.11665/j.issn.1000-5048.20050601 |
| [29] |
LINNET K, EJSING TB. A review on the impact of P-glycoprotein on the penetration of drugs into the brain. Focus on psychotropic drugs[J]. Eur Neuropsychopharmacol, 2008, 18(3): 157. DOI:10.1016/j.euroneuro.2007.06.003 |
| [30] |
SANE R, AGARWAL S, MITTAPALLI RK, et al. Saturable active efflux by P-glycoprotein and breast cancer resistance protein at the blood-brain barrier leads to nonlinear distribution of elacridar to the central nervous system[J]. J Pharmacol Exp Ther, 2013, 345(1): 111. DOI:10.1124/jpet.112.199786 |
| [31] |
LI L, AGARWAL S, ELMQUIST WF. Brain efflux index to investigate the influence of active efflux on brain distribution of pemetrexed and methotrexate[J]. Drug Metab Dispos, 2013, 41(3): 659. DOI:10.1124/dmd.112.049254 |
| [32] |
VAIDHYANATHAN S, MITTAPALLI RK, SARKARIA JN, et al. Factors influencing the CNS distribution of a novel MEK-1/2 inhibitor:implications for combination therapy for melanoma brain metastases[J]. Drug Metab Dispos, 2014, 42(8): 1292. DOI:10.1124/dmd.114.058339 |
| [33] |
KODAIRA H, KUSUHARA H, USHIKI J, et al. Kinetic analysis of the cooperation of P-glycoprotein(P-gp/Abcb1)and breast cancer resistance protein(Bcrp/Abcg2)in limiting the brain and testis penetration of erlotinib, flavopiridol, and mitoxantrone[J]. J Pharmacol Exp Ther, 2010, 333(3): 788. DOI:10.1124/jpet.109.162321 |
| [34] |
POLLI JW, OLSON KL, CHISM JP, et al. An unexpected synergist role of P-glycoprotein and breast cancer resistance protein on the central nervous system penetration of the tyrosine kinase inhibitor lapatinib(N-{3-chloro-4-[(3-fluorobenzyl)oxy]phenyl}-6-[5-({[2-(methylsulfonyl)ethyl]amino}methyl)-2-furyl]-4-quinazolinamine; GW572016)[J]. Drug Metab Dispos, 2009, 37(2): 439. DOI:10.1124/dmd.108.024646 |
| [35] |
de VRIES NA, ZHAO J, KROON E, et al. P-glycoprotein and breast cancer resistance protein:two dominant transporters working together in limiting the brain penetration of topotecan[J]. Clin Cancer Res, 2007, 13(21): 6440. DOI:10.1158/1078-0432.CCR-07-1335 |
| [36] |
DO TM, NOEL-HUDSON MS, RIBES S, et al. ABCG2-and ABCG4-mediated efflux of amyloid-beta peptide 1-40 at the mouse blood-brain barrier[J]. J Alzheimers Dis, 2012, 30(1): 155. |
| [37] |
姬汴生. 血脑屏障上P-糖蛋白及其转运功能研究进展[J]. 河南大学学报(医学版), 2008, 27(1): 8. JI BS. Current views of transporting role of P-glycoprotein in the blood-brain barrier[J]. J Henan Univ(Med Sci), 2008, 27(1): 8. |
| [38] |
SELEMAN M, CHAPY H, CISTERNINO S, et al. Impact of P-glycoprotein at the blood-brain barrier on the uptake of heroin and its main metabolites:behavioral effects and consequences on the transcriptional responses and reinforcing properties[J]. Psychopharmacology(Berl), 2014, 231(16): 3139. DOI:10.1007/s00213-014-3490-9 |
| [39] |
CHAPY H, SAUBAMEA B, TOURNIER N, et al. Blood-brain and retinal barriers show dissimilar ABC transporter impacts and concealed effect of P-glycoprotein on a novel verapamil influx carrier[J]. Br J Pharmacol, 2016, 173(3): 497. DOI:10.1111/bph.13376 |
| [40] |
WULKERSDORFER B, WANEK T, BAUER M, et al. Using positron emission tomography to study transporter-mediated drug-drug interactions in tissues[J]. Clin Pharmacol Ther, 2014, 96(2): 206. DOI:10.1038/clpt.2014.70 |
| [41] |
于洋, 何佳珂, 熊爱珍, 等. 小动物正电子发射计算机断层扫描技术在药动学研究中的应用[J]. 中国新药杂志, 2015, 24(11): 1242. YU Y, HE JK, XIONG AZ, et al. Micro-PET imaging used in pharmacokinetic study[J]. Chin New Drugs J, 2015, 24(11): 1242. |
| [42] |
TOTH M, HAGGKVIST J, VARRONE A, et al. ABC transporterdependent brain uptake of the 5-HT1B receptor radioligand[(11) C]AZ10419369:a comparative PET study in mouse, rat, and guinea pig[J]. EJNMMI Res, 2014, 4(1): 64. DOI:10.1186/s13550-014-0064-0 |
| [43] |
BAUER M, ROMERMANN K, KARCH R, et al. A pilot PET study to assess the functional interplay between ABCB1 and ABCG2 at the human blood-brain barrier[J]. Clin Pharmacol Ther, 2016, 100(2): 131. DOI:10.1002/cpt.v100.2 |
| [44] |
GORR TA, VOGEL J. Western blotting revisited:critical perusal of underappreciated technical issues[J]. Proteomics Clin Appl, 2015, 9(3-4): 396. DOI:10.1002/prca.201400118 |
| [45] |
HU PY, LIU D, ZHENG Q, et al. Elucidation of transport mechanism of paeoniflorin and the influence of ligustilide, senkyunolide I and senkyunolide A on paeoniflorin transport through Mdck-Mdr1 cells as blood-brain barrier in vitro model[J]. Molecules, 2016, 21(3): 300. DOI:10.3390/molecules21030300 |
| [46] |
DARBY RA, UNSWORTH A, KNAPP S, et al. Overcoming ABCG2-mediated drug resistance with imidazo-[1, 2-b]-pyridazine-based Pim1 kinase inhibitors[J]. Cancer Chemother Pharmacol, 2015, 76(4): 853. DOI:10.1007/s00280-015-2858-9 |
| [47] |
吴梦秋, 陆高远, 邵畅, 等. 基于生物质谱的蛋白质定量技术及其在药代动力学研究中的应用[J]. 中国药科大学学报, 2015, 46(2): 129. WU MQ, LU GY, SHAO C. Mass spectrometry-based protein quantification and its application in pharmacokinetic research[J]. J China Pharm Univ, 2015, 46(2): 129. DOI:10.11665/j.issn.1000-5048.20150201 |
| [48] |
UCHIDA Y, TACHIKAWA M, OBUCHI W, et al. A study protocol for quantitative targeted absolute proteomics(QTAP)by LC-MS/MS:application to inter-strain differences in protein expression levels of transporters, receptors, claudin-5, and marker proteins at the blood-brain barrier in ddY, FVB, and C57BL/6J mice[J]. Fluids Barriers CNS, 2013, 10(1): 21. DOI:10.1186/2045-8118-10-21 |
| [49] |
LANGENFELD E, MEYER H E, MARCUS K. Quantitative analysis of highly homologous proteins:the challenge of assaying the "CYPome" by mass spectrometry[J]. Anal Bioanal Chem, 2008, 392(6): 1123. DOI:10.1007/s00216-008-2407-z |
| [50] |
OHTSUKI S, UCHIDA Y, KUBO Y, et al. Quantitative targeted absolute proteomics-based ADME research as a new path to drug discovery and development:methodology, advantages, strategy, and prospects[J]. J Pharm Sci, 2011, 100(9): 3547. DOI:10.1002/jps.22612 |
| [51] |
SHAWAHNA R, UCHIDA Y, DECLEVES X, et al. Transcriptomic and quantitative proteomic analysis of transporters and drug metabolizing enzymes in freshly isolated human brain microvessels[J]. Mol Pharm, 2011, 8(4): 1332. DOI:10.1021/mp200129p |
| [52] |
OHTSUKI S, IKEDA C, UCHIDA Y, et al. Quantitative targeted absolute proteomic analysis of transporters, receptors and junction proteins for validation of human cerebral microvascular endothelial cell line hCMEC/D3 as a human blood-brain barrier model[J]. Mol Pharm, 2013, 10(1): 289. DOI:10.1021/mp3004308 |
| [53] |
PRASAD B, UNADKAT JD. Optimized approaches for quantification of drug transporters in tissues and cells by MRM proteomics[J]. AAPS J, 2014, 16(4): 634. DOI:10.1208/s12248-014-9602-y |
 2017, Vol. 37
2017, Vol. 37 
