2. 湖州市中心医院, 湖州 313003
2. Huzhou Central Hospital, Huzhou 313003, China
西红花(Crocus sativus L.)又称藏红花,仅以雌蕊上部3根红色柱头入药,人工采摘10~15万朵花才能获得1 kg西红花干品,因此价格昂贵,为名贵中药材[1-2],具有活血化瘀、凉血解毒、解郁安神之功效[3]。其主要有效成分为西红花苷(crocins)[4-6],是一种红色的水溶性类胡萝卜素类化合物,是西红花酸与葡萄糖或龙胆二糖结合而成的一系列酯苷类,目前已分离得到苷元均为西红花酸的16种不同顺反异构体的西红花苷[7-8]。世界各地不同来源西红花中均以西红花苷-Ⅰ含量最高,其次为西红花苷-Ⅱ。中国药典2015年版以西红花苷中的西红花苷-Ⅰ和苷-Ⅱ为指标对西红花质量控制,要求两者总含量不低于10%,但西红花苷-Ⅰ和苷-Ⅱ在某些样品中只占总西红花苷的70%左右,并且西红花苷口服给药后,西红花苷会水解为苷元而被吸收入血[9-10],因此总西红花苷含量的高低对药效的影响可能更大。因此需建立适合生产加工和质量控制的总西红花苷含量测定方法。
采用高效液相色谱法测定西红花药材中的西红花苷,可分离大部分西红花苷类成分,但西红花苷对照品价格昂贵,精确定量所有西红花苷类成分含量,检测成本昂贵。一般认为分光光度法特征性不强,但西红花是一味很特殊的药材,药效成分均集中于柱头,含量高且相对简单,课题组前期利用HPLC-DAD-ESI-MSn对西红花中的化学成分进行分析,在可见光区440 nm处只有西红花苷类有吸收,其他成分无干扰[11]。因此本文建立了以西红花苷-Ⅰ为对照,用可见分光光度法(440 nm)测定总西红花苷含量的方法,但该方法适合生产加工者使用,若有掺假等行为,则不适合使用。
王智民等[12]提出的“一测多评”法可较好地解决高效液相色谱测定法中对照品不易获得的问题,其中黄连药材的一测多评方法已被2015年版中国药典采用。本文拟利用“一测多评”法,以西红花苷-Ⅰ为内参物,同时检测中国药典规定的2种西红花苷的含量,与中国药典方法进行比较,以减少价格昂贵的西红花苷-Ⅱ对照品的使用。本文同时以西红花苷-Ⅰ为对照,采用面积归一化法计算总西红花苷的含量,并与课题组前期已建立的440 nm下分光光度法检测总西红花苷的含量进行比较分析,建立能与西红花苷-Ⅰ和苷-Ⅱ同步检测总西红花苷含量的方法。相较于中国药典方法,将一测多评测定的2种西红花苷含量和面积归一化法测定的总西红花苷含量相结合,实现了1个对照品完成西红花苷的含量测定,降低了检测成本,并能更好地评价西红花的质量,为西红花药材质量评价方法的完善提供了更好的技术参考。
1 材料Agilent公司Agilent 1200高效液相色谱仪,DAD检测器;Welch materials,公司Ultimate XB C18色谱柱(250 mm×4.6 mm,5 μm;填料:超纯全多孔球形硅胶);Perkin Elmer公司Lambda 45紫外-可见分光光度仪;Mettle Toledo公司AG135电子天平;Millipore公司Milli-Q超纯水仪;昆山市超声仪器有限公司KQ-500DB型数控超声波清洗器。
对照品西红花苷-Ⅰ(批号111588-201202)和西红花苷-Ⅱ(批号111589-201304),供HPLC含量测定用,均购于中国食品药品检定研究院;甲醇和甲酸均为色谱纯,其余化学试剂均为分析纯。
西红花药材由浙江省建德市三都西红花专业合作社、西红花不同种植基地提供,其中进口西红花直接从伊朗、西班牙等国家购买;药材研磨后,过60目筛,避光干燥保存。
2 方法与结果 2.1 西红花苷-Ⅰ和西红花苷-Ⅱ含量测定 2.1.1 混合对照品溶液制备精密称取西红花苷-Ⅰ对照品5.96 mg,西红花苷-Ⅱ对照品2.96 mg,置100 mL棕色量瓶中,用稀乙醇溶解并定容至刻度,摇匀,即得质量浓度分别为59.6 μg·mL-1和29.6 μg·mL-1的混合对照品溶液。
2.1.2 供试品溶液制备参照中国药典2015年版西红花项下,称取西红花样品粉末约10 mg,精密称定,置50 mL棕色量瓶中,加稀乙醇40 mL,冰浴超声(250 W,40 kHz)处理20 min,放置室温,加乙醇定容至刻度,摇匀,0.22 μm微孔滤膜滤过,取续滤液,即得。
2.1.3 色谱条件色谱柱:Ultimate XB C18(250 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:水(A)-甲醇(B),梯度洗脱(0~60 min,20%B→100%B);检测波长:440 nm;流速:1.0 mL·min-1;进样量:10 μL。分别精密吸取上述混合对照品溶液与供试品溶液各10 μL,注入液相色谱仪,测定,代表性图谱见图 1;表明在上述色谱条件下,各色谱峰有较好的基线分离。
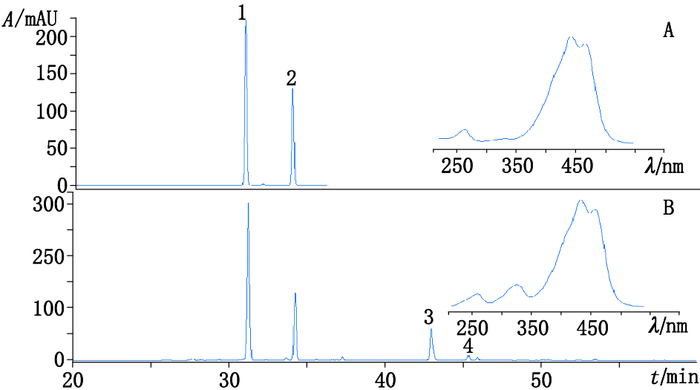
|
1.西红花苷-Ⅰ(crocin-Ⅰ)2.西红花苷-Ⅱ(crocin-Ⅱ) 图 1 混合对照品(A)及3号西红花样品(B)HPLC图 Figure 1 HPLC chromatograms of mixed standard(A)and sample No.3(B) |
取“2.1.1”项中混合对照品溶液1、2、4、8、10、20 μL,按上述色谱条件进样分析,测定峰面积;分别以西红花苷-Ⅰ和西红花苷-Ⅱ质量浓度(X,μg)对其相应峰面积(Y)进行线性回归,分别得西红花苷-Ⅰ和西红花苷-Ⅱ的回归方程:
Y=7 314X+3.622 9 r=0.999 9
Y=8 496X+1.948 1 r=0.999 9
结果表明西红花苷-Ⅰ和西红花苷-Ⅱ质量浓度分别在0.059 6~1.192 μg和0.029 6~0.592 μg范围内与其各自峰面积呈良好线性关系。
2.1.5 相对校正因子(fk/s)计算——多点校正法参照文献方法[13-15],以多个质量浓度点计算所得的fk/s,取平均值作为定量用fk/s。fk/s计算公式:fk/s=(Cs×Ak)/(Ck×As);待测成分(西红花苷-Ⅱ)质量浓度计算公式:Ck′=(Cs×Ak′)/(fk/s×As)。两式中,Cs为内参物(西红花苷-Ⅰ)质量浓度,As为内参物色谱峰峰面积,Ck为西红花苷-Ⅱ对照品质量浓度,Ak为西红花苷-Ⅱ对照品色谱峰峰面积,Ck′为西红花样品中西红花苷-Ⅱ质量浓度,Ak′为西红花样品中西红花苷-Ⅱ色谱峰峰面积。具体操作过程:取“2.1.1”项下混合对照品溶液,分别进样1、2、4、8、10、15、20 μL,记录峰面积,应用多点校正法,以西红花苷-Ⅰ为内参物,计算西红花苷-Ⅰ对西红花苷-Ⅱ的相对校正因子fk/s,结果在上述1~20 μL进样量下的fk/s依次为1.182、1.181、1.181、1.181、1.181、1.180和1.180,平均值为1.181,RSD为0.054%。
2.1.6 仪器和色谱柱对fk/s的影响本实验考察了3套高效液相色谱系统(Agilent 1260、Agilent 1200和Agilent 1100)及3种不同品牌的色谱柱(Agilent Zorbax SB-C18、Ultimate XB C18、Kromasil C18,规格均为250 mm×4.6 mm,5 μm)对fk/s的影响。以西红花苷-Ⅰ为内参物,计算得西红花苷-Ⅱ相应的fk/s及RSD,结果见表 1。RSD在1%以内,表明不同仪器及色谱柱对fk/s影响较小。
|
|
表 1 不同仪器、不同色谱柱对fk/s及对待测组分西红花苷-Ⅱ色谱峰相对保留时间的影响 Table 1 The fk/s and relative retention time determined on different instruments and columns |
考察不同仪器、不同色谱柱对相对保留时间的影响,以西红花苷-Ⅰ保留时间为参照,计算得西红花苷-Ⅱ的平均相对保留时间为1.097,RSD为0.14%。表明相对保留时间随不同仪器、不同色谱柱的波动较小,因此可采用相对保留时间结合西红花苷类成分特征紫外吸收(见图 1),进行待测成分西红花苷-Ⅱ色谱峰的定位,结果见表 1。此外,从32批西红花样品440 nm下的HPLC色谱图可看出,西红花苷-Ⅰ和西红花苷-Ⅱ色谱峰之间并无其他明显的色谱峰,很容易识别。
2.1.8 一测多评法与外标法测定结果比较为了评估和验证一测多评法测定西红花中西红花苷-Ⅰ和西红花苷-Ⅱ的可行性,首先采用外标法(中国药典2015年版西红花项下方法)测定了32批西红花样品中西红花苷-Ⅰ和苷-Ⅱ的含量;并运用西红花苷-Ⅰ对苷-Ⅱ的相对校正因子,一测多评法计算西红花苷-Ⅱ的含量,每个样品测定3次,取均值。将一测多评计算值与外标法测定的含量值进行比较。结果表明,一测多评法和外标法测定结果基本一致,无显著性差异。说明一测多评法用于西红花中西红花苷-Ⅰ和西红花苷-Ⅱ 2个同类型成分的含量测定是可行的,结果见表 2。
|
|
表 2 ESM与QAMS测定的西红花中两种西红花苷类成分含量及ANM与UV测定总西红花苷含量结果(n=3) Table 2 Contents of two crocins in saffron determined by ESM and QAMS, and total crocins determined by ANM and UV |
参照课题组已经建立了以西红花苷-Ⅰ为对照,UV法(440 nm)测定总西红花苷含量的方法。精密吸取“2.1.2”项下的供试品溶液5 mL,置50 mL棕色量瓶中,用稀乙醇稀释至刻度,于440 nm波长处测定吸光度,按标准曲线分别计算总西红花苷含量。32批西红花药材总西红花苷含量测定结果见表 2。
2.2.2 面积归一化法测定参照“2.1”项下方法,以西红花苷-Ⅰ为对照,按C总苷=(C苷-Ⅰ×A总苷)/A苷-Ⅰ计算总西红花苷的含量。式中A苷-Ⅰ为样品中西红花苷-Ⅰ色谱峰峰面积;A总苷为西红花样品440 nm下所有西红花苷色谱峰峰面积之和;C苷-Ⅰ为外标法测定的西红花样品中西红花苷-Ⅰ的质量浓度;C总苷为西红花样品中总西红花苷质量浓度,结果见表 2。
2.2.3 面积归一化法与UV法测定结果比较为验证面积归一化法测定总西红花苷含量的可行性,首先采用“2.2.1”下方法(UV法)测定了32批西红花样品中总西红花苷的含量;并运用“2.2.2”项下面积归一化法计算总西红花苷的含量。将面积归一化法与UV法得到的含量值进行比较,结果面积归一化法和UV法测定结果基本一致,无显著性差异。说明面积归一化法用于西红花中总西红花苷的含量测定可行,结果见表 2。
3 讨论 3.1 检测方法可行性分析西红花苷-Ⅰ和苷-Ⅱ的苷元均是西红花酸,为类胡萝卜类化合物,产生紫外吸收的官能团相同,均在440 nm有最大吸收,为一测多评法的建立提供了最有利内源基础。本实验中不同仪器、不同色谱柱测得的西红花苷-Ⅱ的相对校正因子、相对保留时间的RSD均小于5%,符合一测多评法要求。采用外标法测定的西红花苷-Ⅱ含量与通过一测多评法计算得到的含量基本一致,说明一测多评法测定西红花苷-Ⅱ可行且适用性强。以西红花苷-Ⅰ为内参物,西红花苷-Ⅱ的相对校正因子为1.18,有较好的重现性和稳定性,可作为已知常数,应用于西红花药材的质量控制。以西红花苷-Ⅰ为对照,面积归一化法计算的总西红花苷含量与UV法测定的含量无显著性差异。因此,一测多评法结合面积归一化法测定西红花苷含量,该方法简便可行,可用于西红花中西红花苷类成分的质量控制。
3.2 研究意义从表 2可看出,国产西红花样品中西红花苷-Ⅰ和苷-Ⅱ的含量比值基本介于2~2.5,但进口西红花两者含量比值基本在2.5以上,来源于希腊的30号样品比值竟达到了4.82。并且国产西红花样品中西红花苷-Ⅰ和苷-Ⅱ总含量基本占总西红花苷含量的80%以上,而进口西红花中西红花苷-Ⅰ和苷-Ⅱ总含量占总西红花苷含量的比例较低,来源于克什米尔的29号样品只有60%。中国药典仅测定西红花苷-Ⅰ和苷-Ⅱ含量,无法体现其他苷的含量;而面积归一化法测定的总西红花苷含量也无法反映西红花苷-Ⅰ和苷-Ⅱ的贡献和西红花苷组成的变化,因此一测多评测定西红花苷-Ⅰ和苷-Ⅱ与面积归一化法测定总西红花苷2种方法结合,既能给出总西红花苷含量,又能体现主要西红花苷的贡献。一测多评法与面积归一化法相结合,相较于中国药典的外标法,实现了1个对照品完成西红花苷的含量测定,降低了检测成本,并能更好地评价西红花的质量,为西红花药材质量评价方法的完善提供了更好的技术参考。
| [1] |
MELNYK JP, WANG S, MARCONE MF. Chemical and biological properties of the world's most expensive spice:saffron[J]. Food Res Int, 2010, 43(8): 1981. DOI:10.1016/j.foodres.2010.07.033 |
| [2] |
SOFFRITTI G, BUSCONI M, SANCHEZ R A, et al. Genetic and epigenetic approaches for the possible detection of adulteration and auto-adulteration in saffron(Crocus sativus L.)spice[J]. Molecules, 2016, 21(3): 343. DOI:10.3390/molecules21030343 |
| [3] |
中国药典2015年版. 一部[S]. 2015: 129. ChP 2015. Vol Ⅰ[S]. 2015:129 |
| [4] |
LU P, LIN H, GU Y, et al. Antitumor effects of crocin on human breast cancer cells[J]. Int J Clin Exp Med, 2016, 8(11): 20316. |
| [5] |
KHAZDAIR MR, BOSKABADY MH, HOSSEINI M, et al. The effects of Crocus sativus (saffron) and its constituents on nervous system:a review[J]. Avicenna J Phytomed, 2015, 5(5): 376. |
| [6] |
CHRISTODOULOU E, KADOGLOU NP, KOSTOMITSOPOULOS M, et al. Saffron:a natural product with potential pharmaceutical applications[J]. J Pharm Pharmacol, 2015, 67(12): 1634. DOI:10.1111/jphp.12456 |
| [7] |
MADI E, TAITI C, HEIMLER D, et al. PTR-TOF-MS and HPLC analysis in the characterization of saffron (Crocus sativus L.)from Italy and Iran[J]. Food Chem, 2015, 192: 75. |
| [8] |
KOULAKIOTIS NS, GIKAS E, IATROU G, et al. Quantitation of crocins and picrocrocin in Saffron by HPLC:Application to quality control and phytochemical differentiation from other crocus taxa[J]. Planta Med, 2015, 81(7): 606. DOI:10.1055/s-00000058 |
| [9] |
ASAI A, NAKANO T, TAKAHASHI AM, et al. Orally administered crocetin and crocins are absorbed into blood plasma as crocetin and its glucuronide conjugates in mice[J]. J Agric Food Chem, 2005, 53(18): 7302. DOI:10.1021/jf0509355 |
| [10] |
张颖, 刘建勋, 林力, 等. 大鼠口服西红花苷-1后吸收入血成分及药动学[J]. 中国药学杂志, 2012, 47(2): 136. ZHANG Y, LIU JX, LIN L, et al. Pharmacokinetics of crocin-1 after oral administration in rats[J]. Chin Pharm J, 2012, 47(2): 136. |
| [11] |
周桂芬, 留永咏, 钱晓东, 等. 基于中国药典与国际标准对西红花生产流通中质量评价方法的改良[J]. 药物分析杂志, 2016, 36(5): 835. ZHOU GF, LIU YY, QIAN XD, et al. Improvement of quality evaluation of Croci Stigma in the process of producing and distributing based on Chinese pharmacopoeia and ISO[J]. Chin J Pharm Anal, 2016, 36(5): 835. |
| [12] |
王智民, 高慧敏, 付雪涛, 等. "一测多评"法中药质量评价模式方法学研究[J]. 中国中药杂志, 2006, 31(23): 1925. WANG ZM, GAO HM, FU XT, et al. Multi-components quantitation by one marker new method for quality evaluation of Chinese herbal medicine[J]. China J Chin Mater Med, 2006, 31(23): 1925. DOI:10.3321/j.issn:1001-5302.2006.23.001 |
| [13] |
梅国荣, 刘飞, 王福, 等. 一测多评法测定决明子中橙黄决明素、大黄素、大黄酚和大黄素甲醚[J]. 中草药, 2016, 47(8): 1392. MEI GR, LIU F, WANG F, et al. Determination of constituents of aurantio-obtusin, emodin, rhubarb, and physcion in Cassiae Semen by multi-components by single mark[J]. Chin Tradit Herb Drugs, 2016, 47(8): 1392. |
| [14] |
徐文芬, 杨雯, 何顺志, 等. 一测多评法测定淫羊藿中淫羊藿苷和朝藿定A、B、C[J]. 中草药, 2016, 47(1): 130. XU WF, YANG W, HE SZ, et al. Determination of icariin, epimendin A, epimendin B, and epimendin C in Epimedii Herba by QAMS[J]. Chin Tradit Herb Drugs, 2016, 47(1): 130. |
| [15] |
WANG L, ZHANG Y, SUN X, et al. Simultaneous quantitative analysis of main components in Linderae Reflexae Radix with one single marker[J]. J Liq Chromatogr Relat Technol, 2016, 39(8): 422. DOI:10.1080/10826076.2016.1169429 |
 2017, Vol. 37
2017, Vol. 37 
