山药(Dioscoreae Rhizoma)是一种药食两用的中药,具有补脾养胃,生津益肺,补肾涩精的功能;用于脾虚食少,久泻不止,肺虚喘咳,肾虚遗精,带下,尿频,虚热消渴[1],在各类保健品中较为多见。山药中所含有的尿囊素成分,具有促进细胞生长,加快伤口愈合软化角质蛋白等生理功能[2],通过测定尿囊素的含量可作为控制的保健品质量的有效手段。本文采用高效液相色谱法对保健品纯怀山药粉中的尿囊素进行定量测定,通过方法学验证,其操作简便,稳定性好,定量准确。
1 仪器与试药 1.1 仪器沃特世公司Waters 2695型高效液相色谱仪、Waters 2489紫外检测器、Empower工作站、Waters Atlantis HILIC silica色谱柱(250 mm×4.6 mm,5 μm;填料:超纯硅胶表面键合亲水基团)。梅特勒-托利多公司AB135S型电子天平(精度:0.000 1 g),昆山市超声仪器有限公司KQ250E超声仪。
1.2 试药纯怀山药粉(河南某药业有限公司,批号20130519、20140420、20140513);尿囊素对照品(中国食品药品检定研究院,批号110861-201310);乙腈为色谱纯,水为超纯水,其他试剂为分析纯。
2 方法与结果 2.1 色谱条件色谱柱[3]:Waters Atlantis HILIC silica(250 mm×4.6 mm,5 μm);流动相:乙腈:水(90:10);流速:1.0 mL·min-1;柱温:30 ℃;检测波长:224 nm;进样量:10 μL。
2.2 溶液制备 2.2.1 对照品溶液取尿囊素对照品13.12 mg,精密称定,置100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得对照品储备液;精密量取储备液1 mL,置10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得对照品溶液。
2.2.2 供试品溶液取样品适量,混合均匀,精密称取约0.1 g,精密称定,置25 mL量瓶中,加入甲醇10 mL,超声处理(功率300 W,频率30 kHz)10 min,放冷至室温,加甲醇至刻度,摇匀,用0.45 μm微孔滤膜滤过,取续滤液即得。
2.3 系统适用性试验分别取上述对照品溶液、供试品溶液及溶剂各10 μL注入液相色谱仪,结果见图 1,尿囊素出峰时间约为13 min,样品主峰与相邻杂质峰的分离度符合要求,理论板数按尿囊素峰计算不低于3 000。
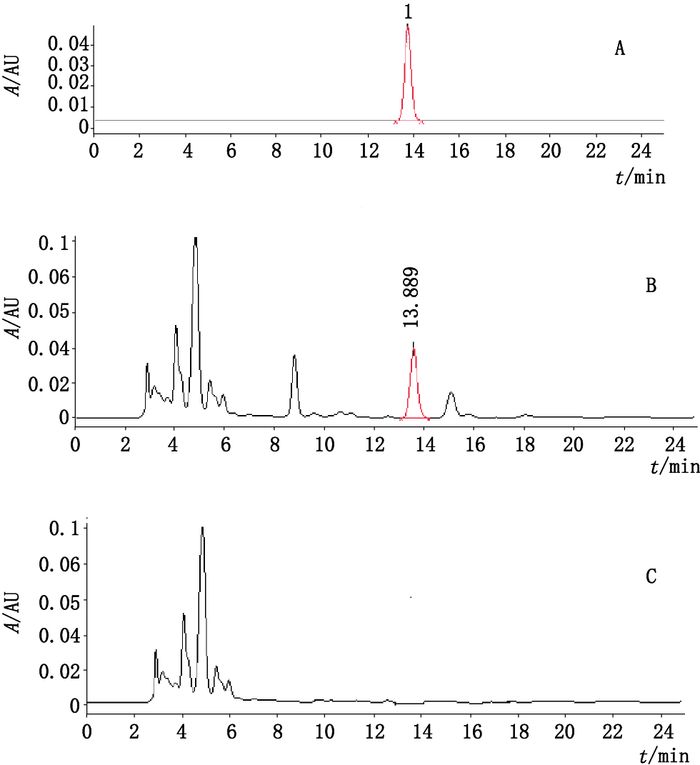
|
1.尿囊素(allantoin) 图 1 尿囊素对照品(A)、样品(B)及溶剂(C)色谱图 Figure 1 Chromatograms of reference substance(A), sample(B)and solvent(C) |
精密吸取尿囊素对照品储备液0.1、0.5、1.0、1.5、2.0 mL,分别置10 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得系列对照品溶液;分别精密吸取上述系列溶液各10 μL注入液相色谱仪,以进样浓度X及峰面积Y进行线性回归,得标准曲线,线性回归方程:
Y=23.27X+29.40 r=0.999 0
线性范围为1.312~26.24 μg·mL-1。
2.5 精密度试验精密吸取“2.2.1”项下对照品溶液10 μL,按上述色谱条件连续进样6次,测定尿囊素峰面积,计算其RSD为0.6%,表明仪器精密度良好;将同一溶液放置24、48 h后重复进样,其RSD小于2.0%,表明日间精密度良好。
2.6 稳定性试验精密吸取同一供试品溶液10 μL,分别于溶液制备后0、1、2、5、8、12、24 h,按上述色谱条件进样测定尿囊素峰面积,计算其RSD为1.1%,表明供试品溶液在室温下放置24 h内稳定。
2.7 重复性试验精密称取同一批样品(批号为20130519)6份,分别按“2.2.2”项下方法制备供试品溶液,按上述色谱条件进行测定,结果样品中尿囊素含量平均值为2.17 mg·g-1,RSD为1.7%,表明该方法的重复性好,方法可行。
2.8 加样回收试验精密称取已知含量的样品约0.05 g(批号20130519,含量2.168 mg·g-1)6份,分别置25 mL量瓶中,分别精密加入尿囊素对照品溶液(13.12 μg·mL-1)7、8、10 mL,按“2.2.2”项下方法制备供试溶液,进样测定,结果见表 1。
|
|
表 1 回收率试验结果(n=6) Table 1 Recovery test results |
取3批样品各2份,按“2.2.2”项下的方法制备供试品溶液,在上述色谱条件下每份溶液进样2次,通过回归方法进行计算,结果见批号为20130519、20140420、20140513的样品中尿囊素含量分别为2.168、2.342、2.430 mg·g-1。
3 讨论 3.1 流动相的选择流动相体系考察不同比例的甲醇-水[4]、甲醇-磷酸溶液以及乙腈-磷酸溶液,结果以乙腈-水(90:10)得到的色谱图分离度最好,理论塔板数高,且基线平整,仪器噪音低,适合于样品的测定。
3.2 色谱柱的选择尿囊素的极性很大,在普通的反相色谱柱上保留时间很短,很难与杂质峰或溶剂峰分开,笔者参考相关文献[3, 5],先后使用氨基柱、HILIC色谱柱对样品进行分离,结果氨基柱分离效果并不理想。后采用HILIC色谱柱,能得到很好的保留。HILIC是以超纯硅胶为基质,表面键合有中性亲水基团的新型固定相,为亲水性色谱柱,主要用于分离水溶性强的化合物。笔者同时比较了几种不同品牌的HILIC色谱柱后发现,Agilent ZORBAX HILIC及Thermo Scientific Syncronis HILIC[6]色谱柱对样品各组分分离效果欠佳,色谱峰拖尾严重,更换Waters HILIC色谱柱后尿囊素色谱峰与相邻杂质峰能够得到良好的分离。
3.3 检测波长的选择分别取供试品溶液及尿囊素对照品溶液用紫外分光光度计进行扫描测定,结果显示均在193 nm处有最大吸收,但比较了几种不同品牌色谱柱的分离图谱后发现,Waters HILIC及Thermo Scientific Syncronis HILIC色谱柱在此波长条件下,基线波动不稳,杂质峰较多,主峰峰形欠佳,可能与接近溶剂的末端吸收而产生干扰有关,故参考有关文献[2],将波长设置于224 nm,在该波长处峰形较好,与杂质峰能得到良好分离。
3.4 提取方法的选择曾有报道[7],以不同溶剂和不同方法对山药中尿囊素进行提取后发现,超声优于回流,从溶剂来看,本次实验中选择使用甲醇作为提取溶剂,提取效果优于20%的乙醇[8-10],且40%的乙醇次之,水提取效果最差。尿囊素的热稳定性差,可能样品处理时,甲醇的沸点低,受热影响少而破坏少,故提取效果最好。
3.5 检测方法的选择目前测定山药中尿囊素的方法不一,药品中尿囊素的测定也比较常见,但关于保健品山药的含量研究不多见。保健品中成分复杂,添加剂对样品中山药含量测定可能存在干扰,本次实验通过对不同批号保健品纯怀山药粉中山药含量测定方法验证,可以看出其方法简便可行,准确性好。尿囊素的检测方法有分光光度法[11]、薄层扫描法[12]、HPLC-UV[3]法、HPLC-ELSD法[13]等,考虑到分光光度法专属性较差,薄层扫描法影响因素多,重复性不好,故选择应用广泛的HPLC法,通过本次方法验证表明,操作简便,精密度高,可为该类产品的质量控制提供参考依据。
3.6 检测方法的不确定度本次实验对方法的不确定度进行了评估[14]。以HPLC法外标法计算公式为数学模型,对不同来源的不确定度因素进行分析,其引入的不确定度主要包括对照品及样品的溶液制备,平行样的重复性,液相色谱进样的重复性,温湿度及量具器皿等。其中,在影响此法检测结果和各个分量中,温度对结果的影响很小,仪器、量具造成的不确定度相对较大。因此在结果判定时应考虑到不确定度因素,将检测误差加入判定结果,以保证结果真实可靠。
| [1] |
中国药典2015年版. 一部[S]. 2015: 28. ChP 2015. Vol Ⅰ[S]. 2015:28 |
| [2] |
王玲, 王东. 不同产地山药中尿囊素含量的HPLC测定[J]. 河南中医学院学报, 2006, 21(5): 20. WANG L, WANG D. Determination of allantion in Rhizoma Dioscoreae from different producing areas by HPLC[J]. J Henan Univ Chin Med, 2006, 21(5): 20. |
| [3] |
龙凌云, 李成立, 文庆, 等. HPLC法测定缩泉胶囊中尿囊素的含量[J]. 中国药师, 2013, 16(4): 544. LONG LY, LI CL, WEN Q, et al. Determination of allantion in Suoquan capsules by HPLC[J]. China Pharm, 2013, 16(4): 544. |
| [4] |
凌育赵. 高效液相色谱法检测淮山米粉尿囊素的研究[J]. 粮油食品科技, 2006, 14(1): 52. LING YZ. Study on determination of allantoin in Rhizoma Dioscoreae rice-flour by reverse-phase HPLC[J]. Sci Technol Cereals, Oils Foods, 2006, 14(1): 52. |
| [5] |
周心如, 曹京宜. 山药中尿囊素的高效液相色谱分析方法研究[J]. 色谱, 1996, 14(2): 129. ZHOU XR, CAO JY. Determination of allantoin in yam by HPLC[J]. Chin J Chromatogr, 1996, 14(2): 129. |
| [6] |
文庆, 聂平, 丁野, 等. HILIC-HPLC法测定山药中尿囊素的含量[J]. 中南药学, 2014, 12(2): 169. WEN Q, NIE P, DING Y, et al. Determination of allantoin in Dioscoreae Rhizoma by HILIC-HPLC[J]. Cent South Pharm, 2014, 12(2): 169. DOI:10.7539/j.issn.1672-2981.2014.02.019 |
| [7] |
易刚强, 蒋孟良, 鲁耀邦, 等. 山药中尿囊素最佳提取方法的优选[J]. 中国现代中药, 2013, 15(9): 786. YI GQ, JIANG ML, LU YB, et al. Optimization of extraction method of allantoin in yam[J]. Mod Chin Med, 2013, 15(9): 786. |
| [8] |
王海波, 蔡宝昌. 反相高效液相色谱法测定不同产地山药中尿囊素的含量[J]. 中药新药与临床药理, 2004, 15(3): 190. WANG HB, CAI BC. Determination of allantoin in Rhizoma Dioscoreae from different producing areas by reverse-phase HPLC[J]. Tradit Chin Drug Res Clin Pharm, 2004, 15(3): 190. |
| [9] |
李明静, 宋爱新, 史会齐, 等. 高效液相色谱法测定山药样品中尿囊素的含量[J]. 化学研究, 2003, 14(1): 66. LI MJ, SONG AX, SHI HQ, et al. Determination of allantoin in some species of yam by HPLC[J]. Chem Res, 2003, 14(1): 66. |
| [10] |
王海波, 蔡宝昌, 程琳. 反相高效液相色谱法测定山药中尿囊素的含量[J]. 上海中医药大学学报, 2004, 18(2): 44. WANG HB, CAI BC, CHENG L. Determination of allantoin in yam by RP-HPLC[J]. Acta Univ Tradit Med Sin Pharmacol Shanghai, 2004, 18(2): 44. |
| [11] |
宋洪杰, 尤本明, 刘少明, 等. 零交一阶导数分光光度法测定尿囊素维E乳膏中尿囊素含量[J]. 药学服务与研究, 2007, 7(2): 114. SONG HJ, YOU BM, LIU SM, et al. Determination of the content of allantion in allantoin-vitamin E cream by zero-crossing first-derivative spectrophotometry[J]. Pharm Care Res, 2007, 7(2): 114. |
| [12] |
周本宏, 刘环香, 罗顺德, 等. 薄层扫描法测定山药中尿囊素的含量[J]. 中国中药杂志, 1994, 19(6): 358. ZHOU BH, LIU HX, LUO SD, et al. Determination of allantoin in Chinese yam by TLC scanning[J]. China J Chin Mater Med, 1994, 19(6): 358. |
| [13] |
张军, 秦雪梅, 薛黎明, 等. HPLC-ELSD法测定山药中尿囊素含量的研究[J]. 药物分析杂志, 2008, 28(10): 1648. ZHANG J, QIN XM, XUE LM, et al. HPLC-ELSD study on determination of allantoin in Rhizoma Dioscoreae[J]. Chin J Pharm Anal, 2008, 28(10): 1648. |
| [14] |
唐海霞, 杨美成. 高效液相色谱法外标法测定药品含量的不确定度评定[J]. 现代测量与实验室管理, 2006(4): 41. TANG HX, YANG MC. Evaluation of uncertainty in determination of drug content by HPLC with external standard method[J]. Adv Meas Lab Manage, 2006(4): 41. |
 2017, Vol. 37
2017, Vol. 37 