1,4-二氢吡啶类钙拮抗剂(1,4-DHPs)是一类应用广泛的心血管药物,通过减少血管和心脏肌肉细胞内的钙离子浓度,能有效治疗高血压和心绞痛[1]。1,4-DHPs有1个碳手性中心,在其二氢吡啶环上3,5位连结不同的羧酸酯基,会形成2个对映异构体。手性是自然界中最重要的属性之一,同一化合物的2个对映体之间不仅具有不同的光学性质和物理化学性质,而且具有不同的甚至截然相反的生物活性。临床上大多数手性1,4-DHPs以外消旋体的形式供药,不同对映体对钙离子通道所产生的不同甚至相反的作用(一种是阻滞作用,一种是激活作用)[2-3]严重阻碍了病情的治疗,也大大增加了用药成本。如今一些1,4-DHPs已经开始以单一对映体形式销售,并获得了很好的市场效益,但仍有很多手性1,4-DHPs类药物以外消旋体的形式出售,因此获取1,4-DHPs的单一对映体具有重大的科学价值和经济效益。
手性拆分法作为一种高效、快速获取单一对映体的方法是手性识别领域的研究热点。而超分子作用是手性识别的基本作用机制。主/客体组分通过分子间缔合和分子识别原理组成的超分子,其特殊的结构和高选择性,成为手性拆分的重要识别原理[4]。
目前,已有多篇文献报道1,4-DHPs对映体的拆分,主要是利用高效液相色谱法(HPLC法),但存在分离度不佳及用时长等问题[5-6]。超临界流体色谱(supercritical fluid chromatography,SFC)是手性物质对映体拆分的重要手段之一,与传统的HPLC相比,其分离速度快,物质分离度高,用作流动相的二氧化碳价格便宜且易得,对环境造成的影响小。本课题组曾采用SFC进行手性物质的拆分研究,取得了较好的成果[7-9]。目前SFC法在医用药物及代谢产物的分离分析上应用居多[10-11],但有关DHPs类钙拮抗剂的手性拆分鲜有报道。
基于超分子作用原理,本实验在SFC上采用Sino-Chiral OJ手性固定相,对5种典型的1,4-DHPs进行对映体分离研究,考察了流动相中醇类改性剂的种类、比例和系统背压的改变对手性分离的影响,筛选出5种1,4-DHPs的最佳拆分条件,并对其手性识别机理进行了初步探讨。
1 实验部分 1.1 仪器与试剂超临界流体色谱仪:Thar SD-ASFC-2色谱系统(Thar Technologies,Pittsburgh,PA,USA),配有Gilson UV/VIS-151紫外检测器和Rheodyne 7410手动进样阀。Sino-Chiral OJ手性色谱柱(250 mm×4.6 mm,5 μm;硅胶表面涂敷有纤维素-三-(4-甲基苯甲酸酯),分水(北京)科技有限公司)。
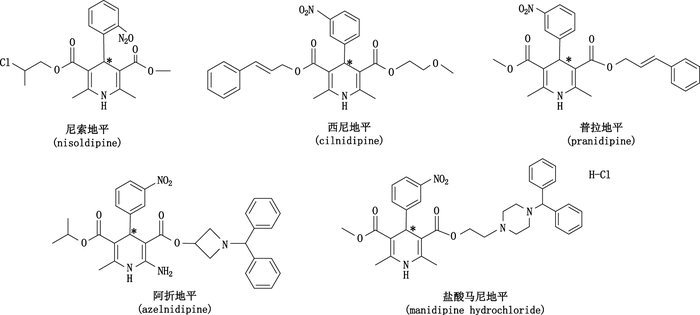
甲醇、乙醇、异丙醇均为色谱纯。干冰级二氧化碳(纯度为99.9%),由杭州今工特种气体有限公司提供。尼索地平(nisoldipine)、西尼地平(cilnidipine)购自中国食品药品检定研究院,普拉地平(pranidipine)、阿折地平(azelnidipine)、盐酸马尼地平(manidipine hydrochloride)购自将来试剂(上海)有限公司,纯度均大于99%,均可溶于色谱纯甲醇溶液中,化学结构式见图 1。
|
图 1 5种1,4-DHPs化学结构式(带*为手性中心) Figure 1 Chemical structures of five 1, 4-DHPs(*denoted chiral center) |
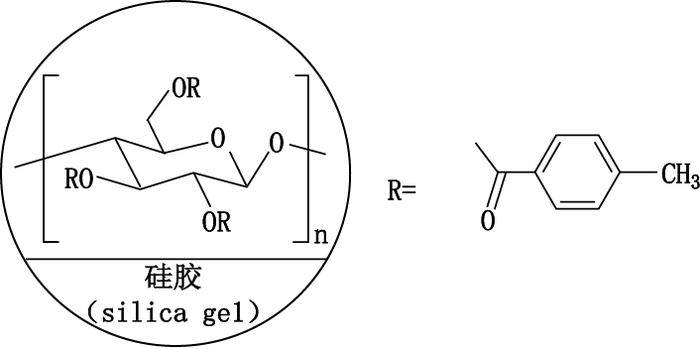
纤维素-三-(4-甲基苯甲酸酯)是一种应用广泛的手性固定相(chiral stationary phase,CSP),具有较高的手性识别能力,可与许多对映体发生多种作用来实现拆分,因此本研究选择硅胶表面涂覆有这种CSP的手性色谱柱:Sino-Chiral OJ柱[250 mm×4.6 mm,5μm,分水(北京)科技有限公司],分子化学结构式见图 2。流动相为超临界二氧化碳,并添加不同比例甲醇、乙醇和异丙醇作为改性剂。根据课题组前期大量实验和预试验,确定本研究流动相流速为2 mL·min-1,手性柱温度为35 ℃,检测波长为237 nm,进样量为10 μL。
|
图 2 Sino-Chiral手性柱的结构式 Figure 2 The structural formula of Sino-Chiral |
利用SFC,通过在流动相二氧化碳中添加不同种类的改性剂(甲醇、乙醇、异丙醇)和比例(99:1-73:27)及改变系统背压(13~17 MPa),对尼索地平、西尼地平、普拉地平、阿折地平、盐酸马尼地平5种1,4-DHPs进行手性分离。该过程会受到CSP、改性剂种类及比例、系统背压等因素的影响。通过探究这些影响因素,可确定1,4-DHPs的最佳拆分条件,也有利于探究SFC手性拆分1,4-DHPs的识别机理,从而为SFC法拆分其他对映体提供理论参考。
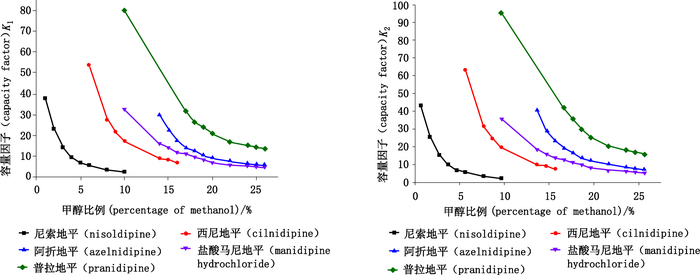
2.1.1 改性剂对手性分离的影响由于二氧化碳为非极性物质,而1,4-DHPs的分子极性较强,在不添加改性剂仅以二氧化碳为流动相时1,4-DHPs均较难洗脱。本研究所用改性剂甲醇、乙醇、异丙醇均属于质子型溶剂,能与固定相发生氢键相互作用,从而与1,4-DHPs竞争氢键形成部位。在同一种改性剂条件下,随着其比例增加,1,4-DHPs的容量因子k逐渐减小,即对映体在CSP上的洗脱时间变短,且改性剂比例越小,容量因子减小得越明显,见图 3(为方便作图,用改性剂所占比例的百分数替代比例)。另外,改性剂比例增加,分离度逐渐变小;增加改性剂的比例,加强了这种竞争作用,从而使物质的保留时间减短,容量因子减小。
|
色谱条件:Sino-Chiral OJ柱,流速2 mL·min-1,柱温35 ℃,系统背压15 MPa,甲醇改性剂 (chromatographic condition:Sino-Chiral OJ withthe flow rateof 2 mL·min-1 at a column temperature of 35 ℃ and 15 MPa back pressure, the modifier is methanol) 图 3 改性剂比例对尼索地平容量因子(k)的影响 Figure 3 Effect of percentage of modifiers on capacity factor (k) of nisoldipine |
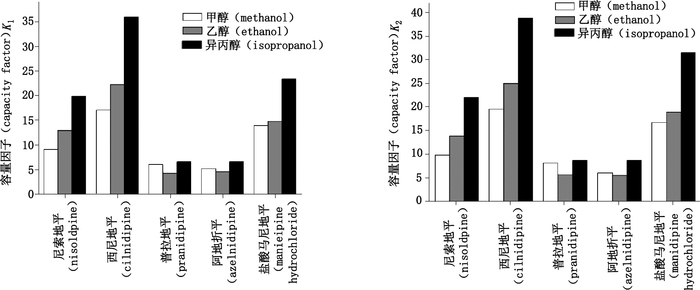
本研究所用手性色谱柱为Sino-Chiral OJ柱,其固定相为纤维素-三-(4-甲基苯甲酸酯)。醇类改性剂会与CSP中的甲酸酯基形成氢键,改变CSP中手性空穴的立体环境,影响对映体的分离。对一种化合物而言,当添加的改性剂比例相同时,不同种类呈现不同规律。从图 4看出,尼索地平、西尼地平和盐酸马尼地平的容量因子是随着异丙醇-乙醇-甲醇的顺序逐渐降低;阿折地平、普拉地平的容量因子随着异丙醇-甲醇-乙醇的顺序逐渐降低。该结果与3种醇类改性剂在分子结构和极性方面的差异有关。三者含碳数由多到少的顺序为异丙醇、乙醇、甲醇,又由于异丙醇比甲醇和乙醇多了1条支链,可知3种改性剂的极性由小到大顺序为异丙醇、乙醇、甲醇,因此三者与CSP的氢键作用由弱到强的顺序为异丙醇、乙醇、甲醇,且异丙醇的氢键作用弱得多,对1,4-DHPs的洗脱速度大大变慢。另外改性剂的分子体积由大到小的顺序为异丙醇、乙醇、甲醇,分子体积大的改性剂其空间位阻变大,溶剂与手性柱的作用力减小,流动相对药品的洗脱能力降低,导致药品在CSP上的保留时间增加。甲醇和乙醇对1,4-DHPs的洗脱能力始终大于异丙醇,容量因子变化基本符合改性剂极性变化规律和空间位阻变化规律。而容量因子随乙醇、甲醇改性剂种类的变化没有明显规律,这可能由于甲醇、乙醇对所选1,4-DHPs的手性识别作用较为复杂,不只受极性、分子体积因素的影响。
|
色谱条件:Sino-Chiral OJ柱,流速2 mL·min-1,柱温35 ℃,系统背压15 MPa,尼索地平、西尼地平、普拉地平、阿折地平、盐酸马尼地平的改性剂比例范围依次为1%~4%、2%~10%、3%~24%、4%~24%、5%~25% (Chromatographic condition:Sino-Chiral OJ with the flow rate of 2 mL·min-1 at the column temperature of 35 ℃ and 15 MPa back pressure, the percentage of modifiers for nisoldipine, cilnidipine, pranidipine, azelnidipine, manidipine hydrochloride: 1%-4%, 2%-10%, 3%-24%, 4%-24%, 5%-25%, respectively) 图 4 改性剂种类对容量因子的影响 Figure 4 Effect of the type of modifiers on the capacity factor |
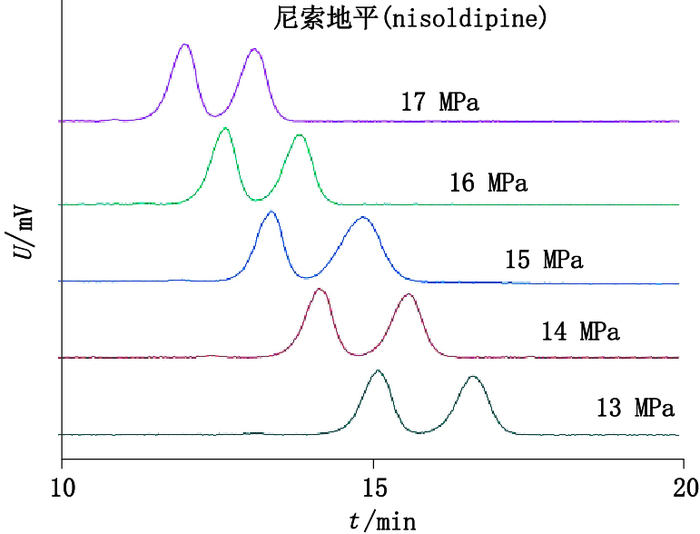
本实验考察了5种1,4-DHPs在不同的系统背压条件下其对映体的分离情况,考察范围为13~17 MPa。当系统背压不断升高时,1,4-DHPs对映体的容量因子k基本呈逐渐减小的趋势,即对映体的洗脱时间不断减少;分离度与压力之间也没有呈现出较为规律的变化。以尼索地平为例,图 5为在不同压力条件下的色谱拆分图,从图中可以直观看出随着压力的升高,出峰速度越来越快。
|
色谱条件:Sino-Chiral OJ柱,流速2 mL·min-1,柱温35 ℃,改性剂8%甲醇 (chromatographic condition:Sino-Chiral OJ with the flow rate of 2 mL·min-1 and the modifies of 8% methanol at the column temperature of 35 ℃) 图 5 尼索地平在不同压力下的色谱图 Figure 5 Chromatograms of nisoldipine under different pressures |
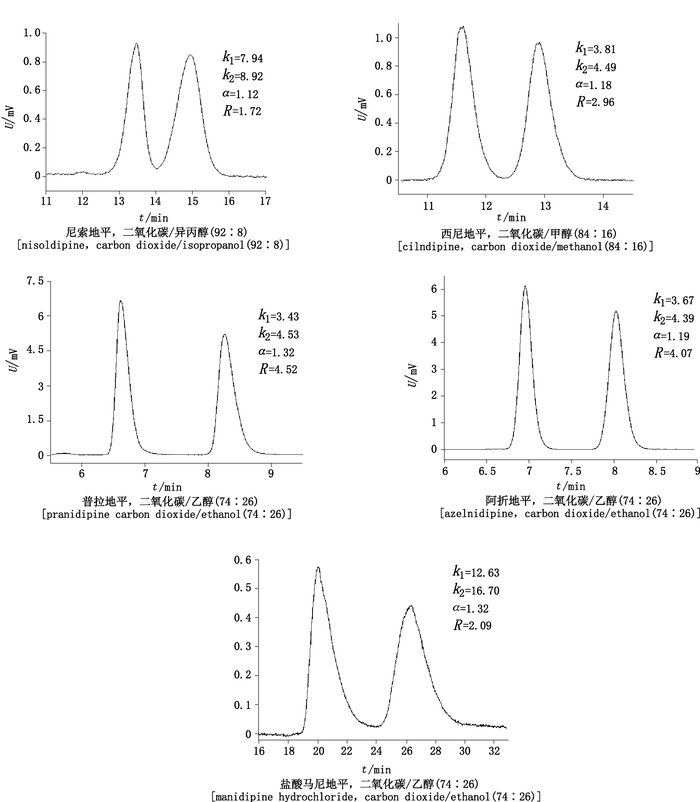
不同条件下1,4-DHPs拆分结果表明,5种1,4-DHPs均能在较短时间内实现基线分离(分离度≥1.5)。基于在较快的时间内实现对映体基线分离的原则,同时考虑仪器和CSPs色谱柱的耐受范围,筛选出1,4-DHPs最佳SFC拆分方法,其色谱图和条件见图 6。
|
色谱条件:Sino-Chiral OJ柱,流速2 mL·min-1,柱温35 ℃,系统背压15 MPa (Chromatographic condition:Sino-Chiral OJ with theflow rate of 2 mL·min-1 at the column temperature of 35 ℃ and 15 MPa back pressure) 图 6 5种1,4-DHPs最佳拆分条件下的色谱图 Figure 6 SFC chromatograms of five1, 4-DHPs under the optimal separation condition |
手性拆分的机理主要源于被分析物和手性选择剂之间的三点相互作用,如氢键作用、疏水作用、偶极-偶极作用和π-π键作用[12-13]。实验所用手性柱为Sino-Chiral OJ,其CSP为涂覆型纤维素-三(4-甲基苯基甲酸酯)[coated cellulose tries(4-methylbenzoate),coated-CTMB],具有螺旋型空穴结构和手性空腔。天然和化学修饰的纤维素具有相当的刚性和良好的疏水空腔,可以作为分子受体识别各种有机和无机以及生物分子形成主-客体或超分子配合物,因此CTMB的超分子结构对手性识别具有重要作用[14]。在手性空腔中,靠近纤维素主链的外侧是芳基,内侧是甲酸酯残基。当手性分子中有1个构型进入到空穴时,通过三点作用形成不稳定的非对映体化合物,其吸附能力较强,而另一构型进入时只能通过两点相互作用来实现,使得吸附能力较小。只要化合物的2个对映异构体与CSP形成的瞬间络合物的稳定性有差异,就能得到手性分离。在对映体分离过程中,主要的手性作用点是其中的极性羰基,它可与外消旋体发生氢键作用和偶极-偶极作用,从而引发手性识别。苯环上的给电子甲基的引入使得酯基上羰基中氧的电子密度增大从而增加手性识别能力。
5种DHPs都包含苯环、-NH和羰基。其中,-NH更有利于和羰基形成氢键作用。而含有多于1个的苯环的结构能通过π-π键与CSP之间形成强烈的吸引力[15]。因此,西尼地平、阿折地平、普拉地平和盐酸马尼地平的拆分较容易,优化条件后的分离度均大于2。而尼索地平与其余4种1,4-DHPs化学结构上的区别在于1,4-二氢吡啶环上3,5位取代酯基中不含有苯环等大分子基团,这对其插入纤维素手性空腔中是较为不利,因此优化条件后的分离度只有1.72。另外由上文已知,尼索地平的出峰时间较短,容易被流动相洗脱,而阿折地平、盐酸马尼地平、普拉地平对映体被洗脱所需要的时间很长。化合物分子的空间结构可能是重要的影响因素,尼索地平分子体积较小,空间位阻降低,导致与CSP的相互作用减弱,从而对映体易被洗脱。
3 小结分子受体(主体)选择性键合底物(客体)形成超分子种类的研究在化学和生物化学等领域是一个研究热点。基于超分子作用的手性拆分在获取单一对映体方面具有诸多优势。目前许多关于拆分1,4-DHPs的研究采用的是HPLC法,但该法相较SFC法存在明显缺陷。本研究建立了快速、有效分离5种手性1,4-DHPs对映体(尼索地平、西尼地平、普拉地平、阿折地平、盐酸马尼地平)的SFC方法。在Sino-Chiral OJ柱上,当柱温为35 ℃,系统背压为15 MPa,流动相流速为2 mL·min-1时,各1,4-DHPs可得到基线分离,其优化改性剂为二氧化碳-异丙醇(92:8)、二氧化碳-甲醇(84:16)、二氧化碳-乙醇(74:26)、二氧化碳-乙醇(74:26)、二氧化碳-乙醇(74:26)。实验还通过拆分参数:容量因子(k1、k2)、分离度(R)随条件变化而产生的变化规律,对拆分机理进行了探究。该研究可为手性1,4-DHPs及其类似物的单一对映体的制备提供参考。
| [1] |
INOTSUME N, NAKANO M. Stereoselective determination and pharmacokinetics of dihydropyridines:an updated review[J]. J Biochem Biophys Methods, 2002, 54(1-3): 255. DOI:10.1016/S0165-022X(02)00120-3 |
| [2] |
ZHANG XP, LOKE KE, MITAL S, et al. Paradoxical release of nitric oxide by an L-type calcium channel antagonist, the R+ enantiomer of amlodipine[J]. J Cardiovasc Pharmacol, 2002, 39(2): 208. DOI:10.1097/00005344-200202000-00007 |
| [3] |
FURUKAWA T, MIURA R, HONDA M, et al. Identification of R(-)-isomer of efonidipine as a selective blocker of T-type Ca2+ channels[J]. J Pharmacol, 2004, 143(8): 1050. |
| [4] |
王伽伯, 肖小河, 赵艳玲, 等. 超分子化学及其在手性药物识别中的应用[J]. 中国新药杂志, 2005, 14(1): 27. WANG JB, XIAO XH, ZHAO YL, et al. Supermolecular chemistry and its use in recognition of chiral drugs[J]. Chin J New Drugs, 2005, 14(1): 27. |
| [5] |
李成平, 曾怀超, 鲁琳, 等. 二氢吡啶钙拮抗剂马尼地平和西尼地平对映体的手性拆分研究[J]. 药物分析杂志, 2010, 30(4): 611. LI CP, ZENG HC, LU L, et al. Study on the chiral resolution of dihydropyridine caldiumantagonistsm anidipine and cilnidiine enantiomers[J]. Chin J Pharm Anal, 2010, 30(4): 611. |
| [6] |
张恺, 薛娜, 李林, 等. 高效液相色谱手性固定柱法拆分阿折地平对映体[J]. 色谱, 2010, 28(2): 215. ZHANG K, XUE N, LI L, et al. Enantiomeric separation of azeldipine by high performance chromatography with chiral stationary phase[J]. Chin J Chromatogr, 2010, 28(2): 215. |
| [7] |
ZHANG AP, GAO WL, MA BB, et al. Enantiomeric separations of chiral polychlorinated biphenyls on three polysaccharide-type chiral stationary phases by supercritical fluid chromatography[J]. Anal Bioanal Chem, 2012, 403(9): 2665. DOI:10.1007/s00216-012-6063-y |
| [8] |
YANG X, MA BB, ZHENG XQ, et al. Chiral separation of ten arylphenoxypropionate herbicides on four chiral columns by supercritical fluid chromatography[J]. Anal Methods, 2014, 6(13): 4769. DOI:10.1039/C4AY00364K |
| [9] |
LIN CM, MIAO YL, QIAN MR, et al. Enantioselective metabolism of flufiprole in rat and human liver microsomes[J]. J Agric Food Chem, 2016, 64(11): 2371. DOI:10.1021/acs.jafc.5b05853 |
| [10] |
CHEN WD, RAJENDRAN A. Enantioseparation of flurbiprofen on amylose-derived chiral stationary phase by supercritical fluid chromatography[J]. J Chromatogr A, 2009, 1216(50): 8750. DOI:10.1016/j.chroma.2009.02.047 |
| [11] |
金薇, 杨新磊, 陆丹, 等. 超临界流体色谱法手性拆分左乙拉西坦及其右旋异构体[J]. 药物分析杂志, 2013, 33(5): 822. JIN W, YANG XL, LU D, et al. Chiral separation of levetiracetam and R-enantiomer by supercritical fluid chromatography[J]. Chin J Pharm Anal, 2013, 33(5): 822. |
| [12] |
王琰, 陈文静, 周颖, 等. 纤维素衍生物手性固定相拆分肾上腺素、盐酸去氧肾上腺素[J]. 药物分析杂志, 2012, 32(11): 1985. WANG Y, CHEN WJ, ZHOU Y, et al. Chiral separations of adrenaline and phenylephrine hydrochloride bycelluloserami fcation chiral stationary phases[J]. Chin J Pharm Anal, 2012, 32(11): 1985. |
| [13] |
WANG P, JIANG SR, LIU DH, et al. Direct enantiomeric resolutions of chiral triazole pesticides by high-performance liquid chromatography[J]. J Biochem Biophys Methods, 2005, 62(3): 219. DOI:10.1016/j.jbbm.2004.11.007 |
| [14] |
FRANCOTTE E, ZHANG T. Supramolecular effects in the chiral discrimination of meta-methylbenzoyl cellulose in high-performance liquid chromatography[J]. J Chromatogr A, 1995, 718(2): 257. DOI:10.1016/0021-9673(95)00686-9 |
| [15] |
ZHANG LS, SONG ZR, DONG YQ, et al. Enantiomeric separation of 1, 4-dihydropyridines by liquid-phase microextraction with supercritical fluid chromatography[J]. J Supercrit Fluids, 2016, 107: 129. DOI:10.1016/j.supflu.2015.08.021 |
 2017, Vol. 37
2017, Vol. 37 
