2. 河北医科大学第二医院, 石家庄 050000;
3. 河北省石家庄市第一医院, 石家庄 050011
2. The second hospital of Hebei Medical University, Shijiazhuang 050000, China;
3. The first hospital of Shijiazhuang, Shijiazhuang 050011, China
荆防败毒散出自《摄生众妙方》,主要由荆芥、防风、羌活、独活、前胡、柴胡、积壳、桔梗、茯苓、川芎、甘草、薄荷共12味药材组成[1],应用灵活,可随症加减;具有发汗解表,散风祛湿,消疮止痛,调整疏通气血,活血祛瘀之功效;主要用于感冒、发热、上呼吸道感染和湿疹等疾病的治疗,疗效显著[2-5]。荆防败毒散本为人畜共用药,本研究中的荆防败毒口服液是为了改善荆防败毒散原有剂型不方便给药,不易吸收,不易储存等缺点而改良的一种新剂型中兽药,在兽禽治疗中广泛应用,效果较好。
中药成分复杂,其药效是多种成分共同作用的结果,荆防败毒口服液中含有黄酮、香豆素、色原酮、萜、挥发油、多糖、有机酸、皂苷、甾醇等类多种活性成分,但具体成分以及成分的含量尚不明确,这便极大地限制了荆防败毒口服液在国内外的广泛应用。荆防败毒散验方虽在国内应用已久,但药理学和质量控制方面的研究甚少。在荆防败毒口服液的配方中,荆芥、防风、独活、羌活为主药,川芎、柴胡为辅药,枳壳、桔梗、前胡、茯苓为佐药,甘草和薄荷为使药。经高效液相色谱方法鉴定,荆防败毒口服液中含有防风中的升麻素苷,羌活中的紫花前胡苷,独活中的二氢欧山芹醇当归酸酯和川芎中的欧当归内酯A等有效成分。为建立荆防败毒口服液的质量标准,本实验欲测定主药中独有的有效成分的含量,但经液相色谱-质谱联用方法测定之后,未检测到荆芥中的有效成分木犀草素,因此本实验中只测定了荆防败毒口服液中的升麻素苷、紫花前胡苷、二氢欧山芹醇当归酸酯和欧当归内酯A4个有效成分的含量。
目前,对基质复杂成分定量的方法主要有紫外光谱法[6]、薄层扫描法[7]、高效液相色谱法[8-9]、液相色谱-质谱联用法[10-12]、气相色谱法[13]、气相色谱-质谱联用法[14-15]、毛细管电泳法[16-17]以及电化学法[18]等。对于中草药中有效成分测定应用比较广泛的是高效液相色谱法、液相色谱-质谱联用法、气相色谱法以及气相色谱-质谱联用法。荆防败毒口服液成分复杂,某些成分又含量较低,采用高效液相色谱法很难同时测定多种微量化学成分。液相色谱-质谱联用技术,既包含高效液相色谱高效的分离能力,又拥有质谱高灵敏度、高特异性的优点,能够在短时间内同时测定多种微量化学成分,高效、快速、灵敏度高、特异性强,已经广泛应用到中药化学成分的测定中[19]。本文主要是为了建立一种灵敏度高、选择性强的分析方法,同时测定荆防败毒口服液中升麻素苷、紫花前胡苷、二氢欧山芹醇当归酸酯和欧当归内酯A4个有效成分的含量,为荆防败毒口服液的质量控制提供参考。
1 仪器与试药 1.1 仪器ACQUITY超高效液相色谱仪(Waters公司),Xevo TQ-S三重四极杆质谱仪(Waters公司),ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm;填料:十八烷基硅烷键合硅胶;Waters公司),AB265S/FACT型电子分析天平(梅特勒公司),KQ-250B型超声波清洗器(昆山市超声仪器有限公司)。Masslynx V4.1软件(Waters公司)。
1.2 试药对照品升麻素苷(批号Y24S6H3805)、紫花前胡苷(批号ZN1122BB13)、二氢欧山芹醇当归酸酯(批号Y19D5J2)和欧当归内酯A(批号R23A3F1)均购于上海源叶生物科技有限公司,纯度均大于98%。荆防败毒口服液由石家庄锦绣大地动物药业有限公司生产。各待测物结构见图 1。乙腈、甲酸、甲醇为色谱纯,乙酸乙酯为分析纯,超纯水由本实验室MILLIPORE纯水仪制备。
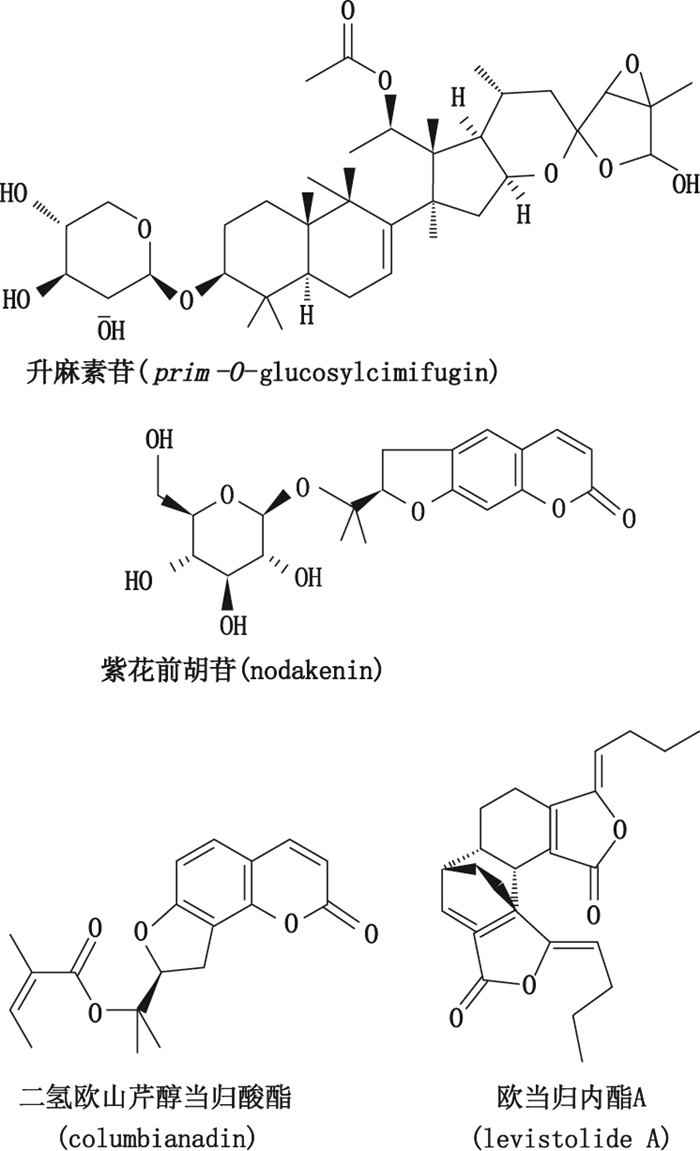
|
图 1 4个化合物的化学结构 Figure 1 Chemical structures of the 4 compounds |
液相色谱条件:采用ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm)色谱柱,柱温30 ℃,流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~10 min,90%A→0%A;10~11 min,0%A→90%A;11~13 min,90%A),流速0.2 mL·min-1,进样量1 μL,分析时间为13 min。质谱条件:采用ESI正负离子模式,毛细管电压2 000 V,椎体电压30 V,离子源温度350 ℃,溶剂温度350 ℃,雾化气压700 kPa,脱溶剂气体温度250 ℃,脱溶剂气体流速为800 L·h-1,孔气体流速为150 L·h-1,采用多反应监测(MRM)。以Masslynx V4.1软件进行数据分析。
3 溶液制备 3.1 对照品溶液精密称取升麻素苷、二氢欧山芹当归酸酯、紫花前胡苷和欧当归内酯A的对照品适量,用甲醇制成升麻素苷、二氢欧山芹醇当归酸酯、紫花前胡苷和欧当归内酯A的质量浓度分别为19.76、30.40、17.29和24.51 g·mL-1的对照品储备液;分别精密量取各对照品储备液适量,混合,以甲醇稀释成混合对照品溶液(含升麻素苷4.94 μg·mL-1,二氢欧山芹醇当归酸酯7.6 μg·mL-1,紫花前胡苷4.323μg·mL-1,欧当归内酯A 6.128 μg·mL-1)。另称取升麻素苷1.975 mg,二氢欧山芹醇当归酸酯4.951 mg,紫花前胡苷111.693 mg,欧当归内酯A 0.061 3 mg,以甲醇定容于25 mL量瓶中,制备成高浓度的混合对照品溶液;再取高浓度的混合对照品溶液8 mL,以甲醇定容于10 mL的量瓶中,制备成中浓度的混合对照品溶液;再取高浓度的混合对照品溶液6 mL,以甲醇制备成低浓度的混合对照品溶液。
3.2 供试品溶液准确量取荆防败毒口服液50 mL,用乙酸乙酯萃取3次,每次150 mL,合并萃取液,用水洗涤2次,每次20 mL,加少量无水硫酸钠,过滤,滤液蒸干,残渣加甲醇溶解稀释,过0.22 μm滤膜,用甲醇定容于1 000 mL量瓶中,即得。
4 方法学验证 4.1 线性关系考察及、检测限和定量限测定精密量取混合对照品溶液适量,用甲醇逐级稀释2.5、5、25、50、250和500倍,制成系列浓度的混合对照品溶液。按“2”项下条件依次进样测定,记录色谱图及峰面积。以对照品质量浓度X为横坐标,峰面积Y为纵坐标,绘制标准曲线,进行线性回归。分别按信噪比S/N=3和S/N=10测定检测限和定量限。4个待测成分的回归方程、线性范围、LOD和LOQ见表 1。
|
|
表 1 4个成分的回归方程、相关系数和线性范围、定量限和检测限 Table 1 Regression equation, correlation coefficient and linearity range, LOQs and LODs of the 4 compounds |
取同一混合对照品溶液,按“2”项下条件连续进样测定6次,记录4个待测成分峰面积并计算RSD即得日内精密度,连续测定3 d求得日间精密度;结果见4个待测组分的日内精密度RSD小于0.68%,日间精密度RSD小于1.9%,说明该方法的精密度良好。
|
|
表 2 4个待测成分的精密度、重复性和稳定性试验结果 Table 2 The results of precision, accuracy, repeatability and stability |
取同一批待测样品6份,分别按“3.2”项下方法制备供试品溶液,按“2”项下条件进样测定,记录色谱图及峰面积,计算RSD;结果见表 2,各成分含量的RSD小于1.9%,说明该方法重复性好。
4.4 稳定性试验取同一批待测样品的供试品溶液,按“2”项下条件,分别在0、2、4、8、12和24 h进行测定,记录色谱图及峰面积,计算RSD,考察供试品溶液在常温条件下的稳定性;结果见表 2,RSD小于8.6%,说明供试品溶液保存在常温条件下,在24 h之内具有良好的稳定性。
4.5 加样回收率试验精密量取荆防败毒口服液(第1批次)9份,每份25 mL,加入“3.1”项下低、中、高3种浓度的混合对照品溶液1 mL,每个水平3份,按“.3.2”项下方法制备供试品溶液,按“2”项下方法依次进样测定,记录色谱图及峰面积,计算回收率;结果见表 3,9份样品中4个待测成分的加样回收率均在97.7%~102.3%之间,RSD为0.50%~2.7%,说明该方法准确度高。
|
|
表 3 4个待测成分的平均加样回收率 Table 3 The recoveries of the four tested compounds |
取分4次生产的荆防败毒口服液,每一生产批次6份,按“3.2”项下方法制备供试品溶液。按“2”项下条件进样测定,记录色谱峰面积,外标法计算含量;结果4个待测成分的色谱图和质谱图分别见图 2和图 3,图 3中,4个有效成分多反应监测模式质谱图显示升麻素苷、紫花前胡苷和二氢欧山芹醇当归酸酯在当前质谱条件下均可产生2种稳定的子离子,具有2个母子离子对,而欧当归内酯A只产生1种稳定的子离子,只有1个母子离子对。样品溶液色谱图见图 4,各待测成分的含量测量结果见表 4。
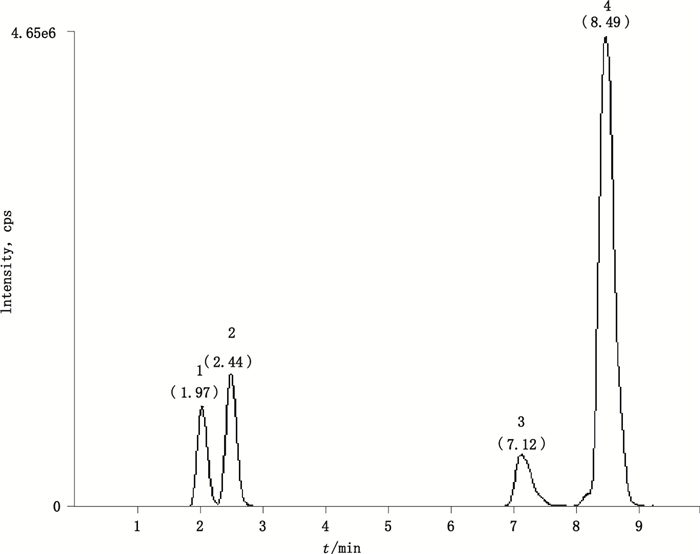
|
1.升麻素苷(prim-O-glucosylcimifugin)2.紫花前胡苷(nodakenin)3.二氢欧山芹醇当归酸酯(columbianadin)4.欧当归内酯A(levistolide A) 图 2 混合对照品的色谱图 Figure 2 Chromatograms of mixed reference substances |
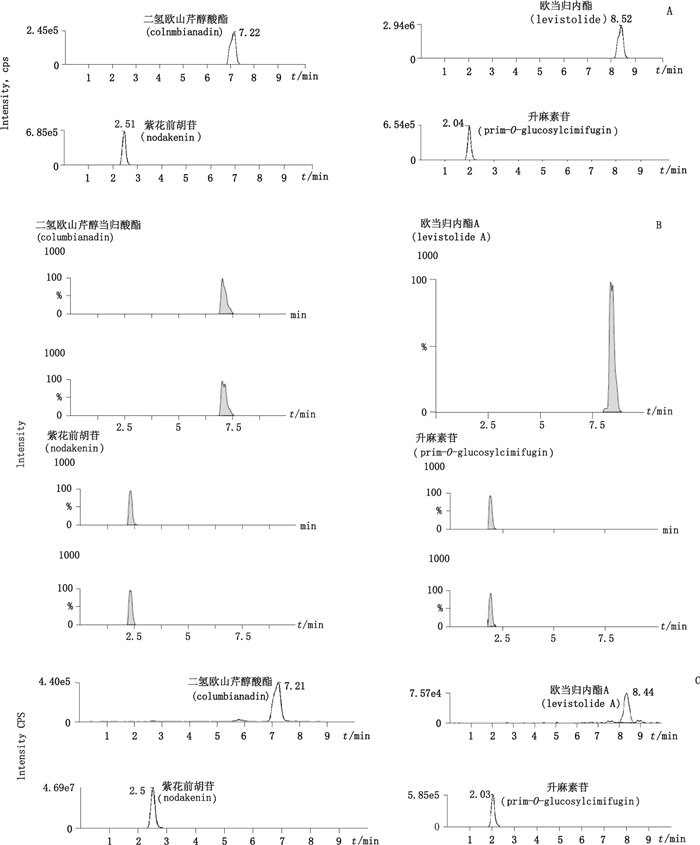
|
A. 4个有效成分对照品色谱图(chromatograms of the 4 standards)B. 4个有效成分多反应监测模式质谱图(multiple-reaction monitoring(MRM)chromatograms of the 4 standards)C.荆防败毒口服液样品色谱图(chromatogram of Jingfangbaidusan oral solution samples) 图 3 4个有效成分色谱图 Figure 3 The chromatograms of the 4 bioactive ingredients |
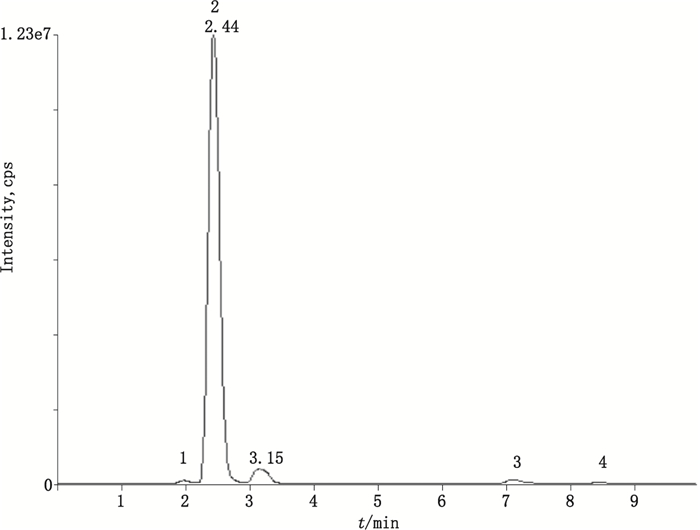
|
升麻素苷(prim-O-glucosylcimifugin)2.紫花前胡苷(nodakenin)3.二氢欧山芹醇当归酸酯(columbianadin)4.欧当归内酯A(levistolide A) 图 4 样品色谱图 Figure 4 Chromatograms of samples |
|
|
表 4 荆防败毒口服液中4个成分的含量(μg·mL-1,n=6) Table 4 The contents of the 4 components in Jingfangbaidu oral liquid |
荆防败毒口服液成分复杂,即使萃取之后,成分也相当之多,本实验首选乙酸乙酯萃取,为提高待测成分萃取率,比较了不同比例用量乙酸乙酯对口服液的萃取效果(1:5,1:1,3:1和5:1),结果发现当乙酸乙酯与口服液比例为1:5和1:1时,检测到待测成分浓度较低,萃取不完全,当比例为3:1和5:1时,测得待测成分浓度基本相同,干扰成分较少,说明待测成分基本萃取完全,本着节约试剂的原则,选择3:1的比例萃取样品。
本实验中还比较了不同流动相的分离效果,包括水-乙腈、0.1%甲酸水溶液-乙腈、水-甲醇和0.1%甲酸水溶液-甲醇。对于有机相,乙腈和甲醇相比,使用乙腈,色谱峰较尖锐,峰与峰之间分离效果较好,而对于无机相,发现仅仅使用纯水,待测化合物色谱峰有拖尾,加入0.1%的甲酸之后,拖尾现象明显改善。故采用0.1%甲酸水溶液-乙腈作为流动相,结果各化合物响应值较高,色谱峰分离效果及峰形均较好。
复方制剂成分复杂,成分分析时干扰成分较多,仅仅采用LC方法,分析时间一般在40~90 min[20-22],分析时间较长,耗时耗溶剂,而采用UPLC-MS方法,分析时间大大缩短,待测化合物一般能够在十几分钟得到很好的分离,测定结果准确可靠[23-24]。本实验首次采用UPLC-ESI/MS法同时测定了荆防败毒口服液中的升麻素苷、紫花前胡苷、二氢欧山芹醇当归酸酯和欧当归内酯A4个有效成分,该方法专属性强,灵敏度高,快速,简单,结果准确可靠,可为中兽药荆防败毒口服液的质量控制提供参考。
| [1] |
中华人民共和国兽药典2010年版. 二部[S]. 2010: 645 ChVP 2010.Vol Ⅱ [S].2010:645 |
| [2] |
郭瑞明, 王荃. 浅谈中医内科治疗感冒[J]. 中国中医药现代远程教育, 2013, 11(5): 16. GUO RM, WANG Q. Discussion of the treatment of colds in Chinese internal medicine[J]. Chin Med Mod Dis Educ China, 2013, 11(5): 16. |
| [3] |
季旭荣, 刘小秋, 周玲玲. 荆防败毒散治疗急性病毒性上呼吸道感染[J]. 中国社区医师, 2012, 14(14): 235. JI XR, LIU XQ, ZHOU LL. The treatment of acute viral upper respiratory tract infection using Jingfangbaidu powder[J]. Chin Commun Doct, 2012, 14(14): 235. DOI:10.3969/j.issn.1007-614x.2012.14.221 |
| [4] |
梅光桥. 荆防败毒散化裁治疗痄腮的体会[J]. 求医问药, 2012, 10(12): 81. MEI GQ. Experience in the treatment of mumps using Jingfangbaidu powder[J]. Seek Med Ask Med, 2012, 10(12): 81. |
| [5] |
王新明, 王晔. 运用汗法治疗湿疮23例体会[J]. 中医药导报, 2011, 17(9): 108. WANG XM, WANG Y. Experience of 23 eczema cases treated by sweating[J]. Guiding J Tradit Chin Med Pharm, 2011, 17(9): 108. |
| [6] |
LI Y, ZHANG J, JIN H. Ultraviolet spectroscopy combined with ultra-fast liquid chromatography and multivariate statistical analysis for quality assessment of wild Wolfiporia extensa from different geographical origins[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2016, 165: 61. DOI:10.1016/j.saa.2016.04.012 |
| [7] |
杨云乔, 汤里平, 姚秋霞, 等. 薄层扫描法测定苦参中苦参碱和氧化苦参碱含量研究[J]. 中兽医医药杂志, 2016(1): 30. YANG YQ, TANG LP, YAO QX, et al. Determination of matrine and oxymatrine in Radix Sophorae Flavescentis by TLC scanning[J]. J Tradit Chin Vet Med, 2016(1): 30. |
| [8] |
YANG KS, ZHAO HY, GU CZ, et al. Quantitative determination of mangiferin in Mangifera indica from different species in Yunnan province by HPLC[J]. Sci Tech Food Ind, 2014, 35(16): 61. |
| [9] |
HEFNI M, MCENTYRE C, LEVER M. A simple HPLC method with fluorescence detection for choline quantification in foods[J]. Food Anal Methods, 2015, 8(9): 2401. DOI:10.1007/s12161-015-0131-9 |
| [10] |
SANDÍN-ESPAÑA P, MATEO-MIRANDA M, LÓPEZ-GOTI C, et al. Development of a rapid and direct method for the determination of organic acids in peach fruit using LC-ESI-MS[J]. Food Chem, 2016, 192: 268. DOI:10.1016/j.foodchem.2015.07.012 |
| [11] |
LAI CJ, TAN T, ZENG SL. Relative quantification of multi-components in Panax notoginseng(Sanqi)by high-performance liquid chromatography with mass spectrometry using mobile phase compensation[J]. J Pharm Biomed Anal, 2015, 102: 150. DOI:10.1016/j.jpba.2014.09.004 |
| [12] |
JIN MM, SONG GS, DU YF, et al. Simultaneous determination of triterpenoidal saponins in rat urine after oral administration of Pulsatilla chinensis extract using HPLC-MS[J]. Chromatographia, 2015, 20(3): 231. |
| [13] |
CAI JN, XU GJ, JIN RL, et al. Analysis of coumarin constituents in Fructus Cnidii by capillary gas chromatography[J]. J Chin Pharm Univ, 1991, 22: 345. |
| [14] |
HAMELIN G, CHAREST-TARDIF C, KRISHNAN K, et al. Determination of p-tert-octylphenol in blood and tissues by gas chromatography coupled with mass spectrometry[J]. J Anal Toxicol, 2008, 32(4): 303. DOI:10.1093/jat/32.4.303 |
| [15] |
SAITOA AY, SUSSMANNA RAC, KIMURAA EA, et al. Quantification of nerolidol in mouse plasma using gas chromatography-mass spectrometry[J]. J Pharm Biomed Anal, 2015, 111: 100. DOI:10.1016/j.jpba.2015.03.030 |
| [16] |
AVULA B, BEGUM S, AHMED S, et al. Quantitative determination of vasicine and vasicinone in Adhatoda vasica by high performance capillary electrophoresis[J]. Pharmazie, 2008, 63(1): 20. |
| [17] |
WANG J, CHEN D, CHEN Z, et al. Fast separation and determination of coumarins in Fructus Cnidii extracts by CEC using poly[butyl Methacrylae-CO-ethylene dimethacrylate-CO-2-(methacryloyloxy)ethyl]trimethylammonium chloride)monolithic columns[J]. J Sep Sci, 2010, 33(8): 1099. |
| [18] |
CAO XD, XU HC, DING S. Electrochemical determination of sulfide in fruits using alizarin-reduced graphene oxide nanosheets modified electrode[J]. Food Chem, 2016, 194: 1224. DOI:10.1016/j.foodchem.2015.08.134 |
| [19] |
WEN XX, LUO KD, XIAO S, et al. Qualitative analysis of chemical constituents in traditional Chinese medicine analogous formula cheng-qi decoctions by liquid chromatography-mass spectrometry[J]. Biomed Chromatogr, 2016, 30(3): 301. DOI:10.1002/bmc.v30.3 |
| [20] |
石燕红, 赵森淼, 王瑞, 等. RP-HPLC同时测定独活中蛇床子素和二氢欧山芹醇当归酸酯的含量[J]. 中国药学杂志, 2010, 45(16): 1270. SHI YH, ZHAO SM, WANG R, et al. Simultaneous determination of osthole and columbianadin of radix angelicae pubescentis by reversed phase high performance liquid chromatography[J]. Chin Pharm J, 2010, 45(16): 1270. |
| [21] |
董自波, 李超, 邵建国. HPLC同时测定蒲地蓝消炎口服液中7个成分的含量[J]. 中国中药杂志, 2015, 40(9): 1747. DONG ZB, LI C, SHAO JG. Simultaneous determination of seven components in Pudilan Xiaoyan oral liquid by HPLC[J]. China J Chin Mater Med, 2015, 40(9): 1747. |
| [22] |
李巧玲, 王冬梅, 苗秋艳, 等. RP-HPLC法同时测定九味羌活丸中升麻素苷等5种有效成分的含量[J]. 沈阳药科大学学报, 2016, 33(2): 114. LI QL, WANG DM, MIAO YQ, et al. Simultaneous determination of five constituents' content in Jiuweiqianghuo pills by RP-HPLC[J]. J Shenyang Pharm Univ, 2016, 33(2): 114. |
| [23] |
SONG GS, ZHOU L, SHENG N, et al. Simultaneous quantification of 16 bioactive constituents in Common cnidium fruit by liquid chromatography-electrospray ionization-mass spectrometry[J]. J Pharm Biomed Anal, 2015, 107: 304. DOI:10.1016/j.jpba.2015.01.007 |
| [24] |
徐冉驰, 刘力, 徐德生. LC-MS/MS法同时测定复方鹿角颗粒中13种成分的含量[J]. 药物分析杂志, 2015, 35(4): 612. XU RC, LIU L, XU DS. Simultaneous determination of thirteen components in compound Lujiao granules by LC-MS/MS[J]. Chin J Pharm Anal, 2015, 35(4): 612. |
 2017, Vol. 37
2017, Vol. 37 
