2. 福建中医药大学生物医药研发中心, 福州 350122;
3. 福州集珍园生物科技有限公司, 福州 350002
2. Centre of Biomedical Research & Development, Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China;
3. Fuzhou JiZhenYuan Bio-Technique Co. Ltd., Fuzhou 350002, China
黄酮类化合物(flavonoids)是广泛存在于自然界的一大类化合物,数量之多列天然酚类化合物之首,大多具有颜色。在植物体内大部分与糖成苷,广泛存在于多种植物中,现代药理研究表明黄酮类成分是许多中草药的重要药效物质基础[1]。因此,总黄酮常常作为中草药质量控制的重要内容之一,总黄酮成分常采用紫外-可见分光光度法(UV-Vis法)测定。经典的显色方法有NaNO2-Al(NO3)3-NaOH法、AlCl3-KAc法、三乙胺法3种方法,每种方法都有其适用性,选择哪种方法作为药材质量控制需要经过黄酮成分结构鉴定显色比较后才能确定[2]。
三叶青是中国特有的珍稀药用植物,为葡萄科崖爬藤属植物三叶崖爬藤(Tetrastigma hemsleyanum Diels et Gilg)[3],以块根或者全草入药,具有清热解毒、祛风化痰、活血止痛的功效,其主要活性成分为有机酸类、黄酮类及挥发油类成分等[4-8]。前期课题组已经针对三叶青的块根进行了质量评价[9-11],但对于三叶青另外重要的药用部位——叶的质量评价研究较少,三叶青叶也广泛用于多种国药准字中成药和保健食品,如结石康胶囊、排石利胆胶囊、三叶青茶等,本研究针对三叶青叶进行总黄酮质量评价的研究,首先通过RRLC-Q-TOF-MS法快速鉴定三叶青叶中主要黄酮成分,根据黄酮成分鉴定结果,进行3种显色法(NaNO2-Al(NO3)3-NaOH法、AlCl3-KAc法、三乙胺法)的比较,筛选最佳的UV-Vis显色方法并进行三叶青叶总黄酮的定量分析,为三叶青叶的开发利用和质量评价提供实验依据。
1 仪器与试药1290型超高效液相色谱仪(安捷伦公司);MicrOTOF飞行时间质谱仪(Bruker公司);Waters CORTECS C18Waters色谱柱(2.1 mm× 100 mm,1.6 μm;填料:十八烷基硅烷键合硅胶;沃特世公司);CPA225D型十万分之一分析天平(Sartorius公司);KQ-500E台式超声波清洗器(昆山市超声仪器有限公司);DFY-500型500克摇摆式高速中药粉碎机(温岭市林大机械有限公司);甲醇、乙腈为色谱纯,Milli-Q超纯水(Millipore公司),其余试剂均为分析纯。
对照品牡荆苷(批号111687-200602)购自中国食品药品检定研究院;其他对照品新绿原酸(批号SH906332)、隐绿原酸(批号SH905997)、绿原酸(批号SH327979)购自北京赛百草科技有限公司,供Q-TOF定性比较使用;牡荆素鼠李糖苷、荭草苷、异荭草苷、异牡荆苷、荭草素鼠李糖苷的对照品由本实验室分离制备[12],供Q-TOF定性鉴定比对使用。三叶青叶样品采自福建省10个不同地方,分别为顺昌、闽侯、南安、光泽、霞浦、福安、泰宁、宁化、建阳和仙游,经福建中医药大学药用植物实验室范世明高级实验师及生药教研室黄泽豪副教授鉴定为葡萄科植物三叶青Tetrastigma hemsleyanum Diels et Gilg的干燥叶;样本存放于福建中医药大学药学院药用植物标本室。
2 方法与结果 2.1 RRLC-Q-TOF-MS分析三叶青叶化学成分 2.1.1 色谱条件采用Waters CORTECS C18色谱柱(2.1 mm×100 mm,1.6 μm),以乙腈(A)-0.1%甲酸水溶液(B)为流动相,梯度洗脱(0~0.5 min,5%A→5%A;0.5~1.5 min,5%A→9%A,1.5~16 min,9%A;16~17.5 min,9%A→10%A;17.5~19 min,10%A→30%A;19~22 min,30%→70%A),流速0.25 mL·min-1,柱温30 ℃,进样量2 μL。
2.1.2 质谱条件飞行时间质谱采用电喷雾正、负离子模式,毛细管电压4.5 kV(-)和3.5 kV(+),喷雾器压力0.2 MPa,干燥气体(N2)流速4.0 L·min-1,干燥气体温度180 ℃,离子漏斗funnel 1峰值电压200.0 V,funnel 2峰值电压200.0 V,六极杆射频(hexapole Rf)峰值电压100.0 V,四极杆离子能量3.0 eV,碰撞射频(collision Rf)峰值电压150.0 V,离子传输时间80 μs,前脉冲存储时间5 μs,碰撞气体为氩气,碰撞能量20~30 eV。质谱测定数据采用全扫描模式采集,数据采集范围m/z 50~1 000。
2.1.3 Q-TOF-MS定性比较用对照品溶液的制备取新绿原酸、绿原酸、隐绿原酸、异荭草苷、荭草苷、牡荆素鼠李糖苷、异牡荆苷、牡荆苷、荭草素鼠李糖苷对照品适量,精密称定,加入甲醇分别制备质量浓度均约为0.2 mg·mL-1的单一对照品储备液,稀释至10 g·mL-1,即得。
2.1.4 供试品溶液制备取三叶青干燥叶粉碎,过60目筛,取100 mg,精密称定,置具塞三角瓶中,精密加入80%甲醇25 mL,密塞、称量,超声处理(功率250 W,频率80 kHz)30 min,放冷,再称量,用80%甲醇补足减失的量,摇匀,0.22 μm滤膜滤过,取续滤液,即得。
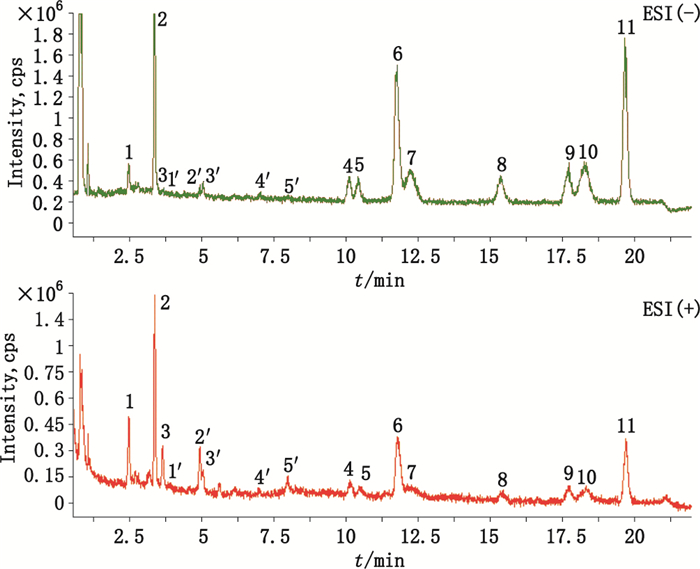
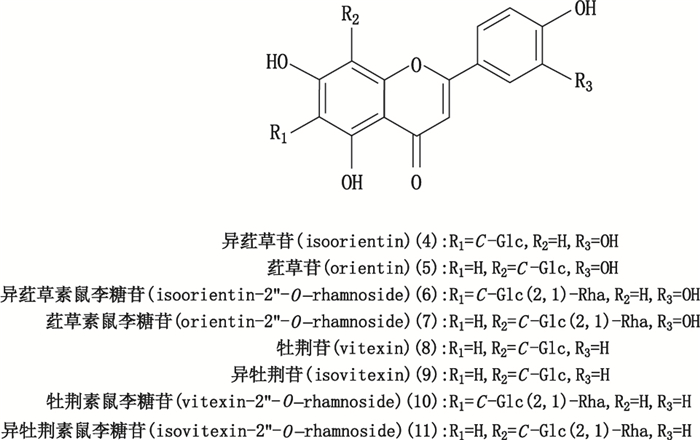
2.1.5 三叶青叶中主要化学成分的鉴定取供试品溶液2 μL在“2.1.1”色谱条件及“2.1.2”质谱条件下进样分析得三叶青的RRLC-Q-TOF-MS总离子流图,见图 1。其化合物的鉴定方法:首先,根据总离子流色谱峰上所得到的精确化合物分子量信息,通过Compass DataAnalysis Smart Formula Manually软件在5×10-6的质量偏差范围内计算其精确分子式,对各化合物进行初步鉴定;其次,选择合适分子离子峰进行碰撞诱导解离(CID),通过二级质谱的裂解,获得化合物相应的碎片离子,根据离子的裂解情况并结合质谱相关文献[8]比对推测,共鉴定三叶青叶中11个成分,其中化合物1(峰1)、化合物2(峰2)和化合物3(峰3),化合物4(峰4)与化合物5(峰5),化合物6(峰6)与化合物7(峰7),化合物8(峰8)与化合物9(峰9),化合物10(峰10)与化合物11(峰11)均互为同分异构体(黄酮类成分结构见图 2),不仅一级质谱相似(分子式相同),二级质谱裂解碎片也较相似,为此为了进一步确认鉴定结果的准确性,通过相关对照品进行进一步的比对确认,最终通过与对照品的色谱保留时间、一级质谱和二级质谱的比对确认了三叶青主要的黄酮成分均为C-苷骨架型黄酮:8个黄酮由4对同分异构体构成,在负离子模式下的响应优于正离子模式,其中,6个黄酮成分异荭草苷(化合物4)、荭草苷(化合物5)、荭草素鼠李糖苷(化合物7)、异牡荆苷(化合物9)、牡荆苷(化合物8)、牡荆素鼠李糖苷(化合物10)经对照品比对确认,而化合物6与荭草素鼠李糖苷质谱一级质谱和二级质谱均相似,因此推断为异荭草素鼠李糖苷,同样化合物11与牡荆素鼠李糖苷的一级质谱和二级质谱均相似,因此推断为异牡荆素鼠李糖苷;另外,化合物1、2和3经对照品比对鉴定为新绿原酸、绿原酸和隐绿原酸,而化合物1′~5′无对照品比对,采用文献及一级、二级质谱数据进行推断和初步鉴定,如化合物1′负离子模式下分子离子峰精确质量数为179.033 9,经Compass DataAnalysis SmartFormula在5×10-6的质量偏差范围内计算其分子式与咖啡酸C9H8O4一致,并且二级子离子m/z 135与文献[13]咖啡酸二级子离子[M-H-CO2]-一致,因此初步推断其为咖啡酸,其他化合物2′~5′同法根据文献质谱数据[8, 13-14]初步鉴定,鉴定结果见表 1。
|
图 1 三叶青样品RRLC-Q-TOF-MS的总离子流图 Figure 1 RRLC-Q-TOF-MS total ion chromatograms of Tetrastigma hemsleyanum leaves in both positive and negative ion mode |
|
图 2 三叶青叶中鉴定的黄酮类成分结构 Figure 2 Chemical structures of 8 flavonoids in Tetrastigma hemsleyanum leaves |
|
|
表 1 三叶青各化学成分的鉴定分析结果 Table 1 Identification of chemical constituents in Tetrastigma hemsleyanum leaves |
总黄酮含量作为质量控制指标,常采用可见分光光度法测定。应用较广的有NaNO2-Al(NO3)3-NaOH法、AlCl3-KAc法及三乙胺法3种,到底选择哪种方法取决于黄酮类化合物的骨架类型,经过RRLC-Q-TOF-MS分析发现三叶青黄酮类成分以C-苷黄酮为主,因此考察不同显色方法对三叶青总黄酮测定的影响。
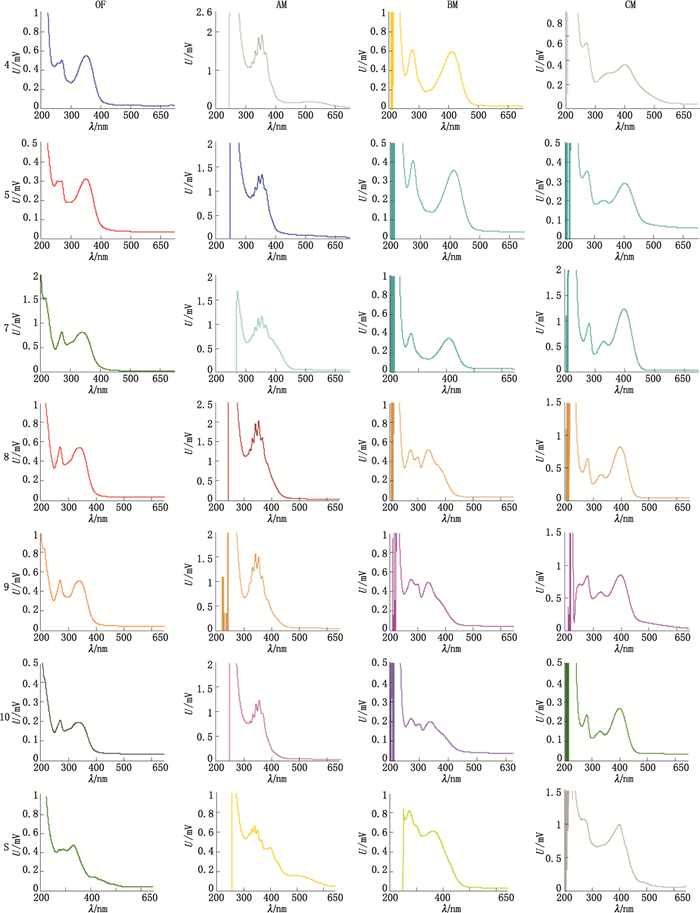
2.2.1 NaNO2-Al(NO3)3-NaOH法NaNO2-Al(NO3)3-NaOH法是先以NaNO2还原黄酮类化合物,再加Al(NO3)3络合,最后加NaOH溶液显色,产生红色化合物进行比色测定。其显色操作[2]:取各三叶青C-苷黄酮对照品溶液(200 μg·mL-1)0.5 mL,分别置于5 mL量瓶中,加80%甲醇至2.5 mL,加5%NaNO2溶液0.15 mL,摇匀,反应6 min,加10%Al(NO3)3溶液0.15 mL,摇匀,反应6 min,加1 moL·L-1 NaOH溶液2.0 mL,用80%甲醇稀释至刻度,摇匀,10 min后以试剂空白作参比,在200~650 nm进行扫描分析,结果见图 3。
|
4.异荭草苷(isoorientin)5.荭草苷(orientin)7.荭草素鼠李糖苷(orientin-2″-O-rhamnoside)8.牡荆苷(vitexin)9.异牡荆苷(isovitexin)10.牡荆素鼠李糖苷(vitexin-2″-O-rhamnoside)S.三叶青叶样品提取液(the extract of Tetrastigma hemsleyanum) OF:显色前原液(Original fluid before chromogenic reaction)AM:NaNO2-Al(NO3)3-NaOH法显色(NaNO2-Al(NO3)3-NaOH chromogenic reaction method)BM:AlCl3-KAc法显色(AlCl3-KAc chromogenic reaction method)CM:三乙胺法显色(triethylamine chromogenic reaction method) 图 3 对照品和三叶青样品显色溶液的紫外可见光谱扫描图(200~650 nm) Figure 3 UV-Vis spectra of reference substance and Tetrastigma hemsleyanum leaves |
AlCl3-KAc法是通过利用黄酮类化合物在适当的pH条件下,能与金属铝离子形成稳定的黄色螯合物这一特性,而建立出的比色法。其操作[2]:取各三叶青C-苷黄酮对照品溶液(200 μg·mL-1)0.5 mL,分别置于5 mL量瓶中,加0.1 moL·L-1 AlCl3溶液1 mL,1 moL·L-1 KAc溶液1.5 mL,用80%甲醇定容,摇匀,以试剂空白为参比,在200~650 nm进行扫描分析,结果见图 3。
2.2.3 三乙胺法三乙胺法是因为在碱性条件下在光谱上能产生明显的变化,黄酮吸收峰红移。其操作[2]:取各三叶青C-苷黄酮对照品溶液(200 μg·mL-1)0.5 mL,分别置于5 mL量瓶中,加80%甲醇至2 mL,以1%三乙胺(TEA)定容,摇匀,以试剂空白为参比,在200~650 nm进行扫描分析,结果见图 3。
2.2.4 显色方法的确定由图 3可知,三叶青经过3种显色方法比较发现采用三乙胺法显色后三叶青中黄酮类成分在400 nm处均有最大吸收波长,并且三叶青叶样品经过三乙胺法显色也在该波长下有最大吸收,因此本文采用三乙胺法做为三叶青总黄酮含量测定的方法。
2.3 三乙胺UV-Vis法测定三叶青总黄酮含量 2.3.1 供试品溶液制备同“2.1.4”项制备方法。
2.3.2 对照品溶液制备精密称取牡荆苷对照品8.15 mg,用80%甲醇稀释成0.032 6 mg·mL-1的溶液,即得。
2.3.3 方法学考察 2.3.3.1 线性关系考察精密移取牡荆苷对照品溶液0.3、0.6、0.9、1.2、1.5 mL,分别加入5 mL量瓶中,按“2.2.3”项下方法显色,以同样方法处理的空白显色体系为参比,在400 nm波长处测吸光度,以吸光度对浓度进行回归计算,得线性方程:
A=0.081 03C-0.000 9 r=0.999 5
表明牡荆苷的质量浓度在1.956~9.780 μg·mL-1范围内与吸光度值呈良好线性关系。
2.3.3.2 精密度试验精密移取对照品溶液和供试品溶液各500 μL,分别置于5 mL量瓶中,按“2.2.3”项下方法显色后,以同样方法处理的空白显色体系为参比,在紫外分光光度计上连续测定6次,结果供试品溶液和对照品溶液吸光度的RSD分别为0.10%,0.03%,表明试验精密度良好。
2.3.3.3 稳定性试验精密移取对照品溶液和供试品溶液各500 μL,分别置于5 mL量瓶中,按“2.2.3”项下方法显色处理后,分别在0、8、15、30、60、90、120、240、270 min测定吸光度,结果RSD分别为2.5%和0.67%,表明供试品和对照品显色产物在室温下30~270 min内稳定。
2.3.3.4 重复性试验取三叶青样品(S1号样品)6份,分别按“2.3.1”项下方法制成供试品溶液,精密吸取500 μL按“2.2.3”项下显色后测定吸收度,并根据标准曲线计算,结果该批提取物总黄酮含量平均值为22.56 mg·g-1,RSD为2.6%,说明重复性良好。
2.3.3.5 加样回收试验取重复性实验同批三叶青(S1号样品)50 mg,精密称定,加入近似50 mg样品中总黄酮含有量的对照品量(1:1),依“2.3.1”项下方法制成供试品溶液。精密吸取供试品溶液500 μL置于5 mL量瓶中,按“2.2.3”项方法显色,平行测定6份。结果见表 2;该方法平均回收率为99.8%,RSD为3.4%,结果良好。
|
|
表 2 加样回收实验 Table 2 The results of recovery |
分别取10个不同福建地方产地的三叶青各3份,分别按“2.3.1”项下方法制备供试品溶液,按“2.2.3”项方法显色,以同样方法处理的空白试剂为参比,测定吸光度,并计算总黄酮含量,结果见表 3。
|
|
表 3 福建不同产地三叶青叶中总黄酮含量(n=3) Table 3 The contents of total flavonoids in Tetrastigma hemsleyanum leaves from different habitants of Fujian |
本文比较了三叶青叶定性质谱正离子模式和负离子检测模式,发现负离子模式下峰响应优于正离子模式,同时通过色谱条件优化,比较了4种流动相系统(乙腈-0.5%醋酸水溶液,乙腈-0.1%甲酸水溶液,甲醇-0.1%甲酸水溶液,甲醇-0.5%醋酸水溶液),结果表明,使用乙腈-0.1%甲酸水溶液最佳,添加0.1%甲酸不仅有利于峰形和分离度的改善,还可以增加质谱响应。另外,结构相似的同分异构体,其不仅分子式一样,而且有着类似的质谱裂解方式,如牡荆苷和异牡荆苷,荭草苷和异荭草苷等,它们的区分就需要对照品的比对来进一步确认,同时也要求在色谱条件上将这些同分异构体区分。
3.2 UV-Vis显色分析经NaNO2-Al(NO3)3-NaOH法、AlCl3-KAc法及三乙胺法显色比较,三叶青叶中的总黄酮测定以三乙胺法特异性最好,在400 nm下每个对照品及三叶青样品均有最大吸收波长;而NaNO2-Al(NO3)3-NaOH法下,异荭草苷等成分略有吸收(500 nm),多数成分未见红移;AlCl3-KAc法下,异荭草苷、荭草苷、荭草素鼠李糖苷有红移吸收峰(400 nm),而牡荆苷、异牡荆苷、牡荆素鼠李糖苷则在其相应的波长下未见吸收红移。提示了不同黄酮骨架其测定总黄酮的方法应该进行适用性评价,即通过光谱扫描评价确定最佳的测定方法,同时也提示先利用高分辨率质谱进行化学成分的定性分析,对主要黄酮进行鉴定后,以其为依据进行针对性的显色条件摸索,有利于中药总黄酮含量测定方法的确定和评价。同时,本研究也考察了三叶青叶样品背景基质对测定的影响,结果发现同稀释浓度下三叶青样品(未进行显色)在400 nm下测定吸光度值均低于0.03,说明该测试浓度下三叶青基质对总黄酮的测定没有明显影响。
3.3 含量测定分析对于福建的10个不同产地的三叶青叶含量测定,结果表明不同产地的三叶青叶中总黄酮含量存在着差异,其中顺昌、闽侯、光泽、福安和宁化三叶青叶中总黄酮含量较高(达到20 mg·g-1),其余产地略低,可能是由于生长环境如温度、光照、土壤、水质及采收时间等因素导致总黄酮含量的差异。
综上,本文建立RRLC-Q-TOF-MS联用技术,共鉴定三叶青叶11个化合物,为三叶青叶成分定性提供了一种快速、高效的分析方法;建立三乙胺法UV-Vis测定三叶青叶中总黄酮含量,方法简便、快捷、准确,为综合评价三叶青叶的质量提供参考。
| [1] |
延玺, 刘会青, 邹永青, 等. 黄酮类化合物生理活性及合成研究进展[J]. 有机化学, 2008, 28(9): 1534. YAN X, LIU HQ, ZOU YQ, et al. Physiological activities and research advance in synthesis of flavonoids[J]. Chin J Org Chem, 2008, 28(9): 1534. |
| [2] |
池玉梅, 居羚, 邓海山, 等. 分光光度测定总黄酮法的适用性[J]. 分析化学, 2010, 38(6): 893. CHI YM, JU L, DENG HS, et al. Suitability of spectrophotometry for determination of total flavonoids spectrophotometry[J]. Chin J Anal Chem, 2010, 38(6): 893. |
| [3] |
PENG X, WU X, JI Q, et al. Molecular authentication of Tetrastigma hemsleyanum from its adulterant species using ISSR, CAPS, and ITS2 barcode[J]. Mol Biol Rep, 2016, 43(8): 785. DOI:10.1007/s11033-016-4023-x |
| [4] |
LIN Z, CHEN L, QIU Q, et al. Isolation and identification of antiproliferative compounds from the roots of Tetrastigma hemsleyanum against MDA-MB-435S cell lines[J]. Pak J Pharm Sci, 2016, 29(4): 1171. |
| [5] |
傅志勤, 黄泽豪, 林婧, 等. 蛇附子化学成分及抗氧化活性研究[J]. 中草药, 2015, 46(11): 1583. FU ZQ, HUANG ZH, LIN J, et al. Chemical constituents in root tuber of Tetrastigma hemsleyanum and their anti-oxidative activities[J]. Chin Tradit Herb Drugs, 2015, 46(11): 1583. |
| [6] |
霍昕, 杨迺嘉, 刘文炜, 等. 三叶青块根乙醚提取物成分研究[J]. 药物分析杂志, 2008, 28(10): 1651. HUO X, YANG NJ, LIU WW, et al. Determination of chemical constituents of ether extract of Radix Tetrastigmae Hemsleyani[J]. Chin J Pharm Anal, 2008, 28(10): 1651. |
| [7] |
YAN X, XUE WW, LI QR. Tetrastigma hemsleyanum(Sanyeqing)root tuber extracts induces apoptosis in human cervical carcinoma HeLa cells[J]. J Ethnopharmacol, 2015, 165: 46. DOI:10.1016/j.jep.2015.02.030 |
| [8] |
SUN Y, LI HY, HU JN, et al. Qualitative and quantitative analysis of phenolics in Tetrastigma hemsleyanum and their antioxidant and antiproliferative activities[J]. J Agric Food Chem, 2013, 61(44): 10507. DOI:10.1021/jf4037547 |
| [9] |
范世明, 黄泽豪, 林婧, 等. 蛇附子中4种黄酮类成分的分离及含量测定[J]. 中药材, 2014, 37(12): 2226. FAN SM, HUANG ZH, LIN J, et al. Separation and quantitative determination of four flavonoids in Tetratigma hemsleyanum[J]. J Chin Med Mater, 2014, 37(12): 2226. |
| [10] |
许文, 傅志勤, 林婧, 等. UPLC-MS/MS法同时测定三叶青中10种黄酮类成分[J]. 药学学报, 2014, 49(12): 1711. XU W, FU ZQ, LIN J, et al. Rapid simultaneous determination of ten major flavonoids in Tetrastigma hemsleyanum by UPLC-MS/MS[J]. Acta Pharm Sin, 2014, 49(12): 1711. |
| [11] |
许文, 傅志勤, 林婧, 等. HPLC-Q-TOF-MS和UPLC-QqQ-MS的三叶青主要成分定性与定量研究[J]. 中国中药杂志, 2014, 39(22): 4365. XU W, FU ZQ, LIN J, et al. Qualitative and quantitative analysis of major constituents in Tetrastigma hemsleyanum by HPLC-Q-TOF-MS and UPLC-QqQ-MS[J]. China J Chin Mater Med, 2014, 39(22): 4365. |
| [12] |
林婧, 纪明妹, 黄泽豪, 等. 三叶青的化学成分及其体外抗肿瘤活性研究[J]. 中国药学杂志, 2015, 50(8): 658. LIN J, JI MM, HUANG ZH, et al. Chemical constituents of whole plants of Tetrastigma hemsleyanum and their antitumor activities[J]. Chin Pharm J, 2015, 50(8): 658. |
| [13] |
向青, 王小花, 林慧, 等. HPLC-DAD-Q-TOF-MS/MS法的银黄颗粒主要成分定性与定量研究[J]. 中成药, 2015, 37(1): 105. XIANG Q, WANG XH, LIN H, et al. Qualitative and quantitative analysis of major constituents in Yinhuang granules by HPLC-DAD-Q-TOF-MS/MS[J]. Chin Tradit Pat Med, 2015, 37(1): 105. |
| [14] |
WU SB, MEYER RS, WHITAKER BD, et al. A new liquid chromatography-mass spectrometry-based strategy to integrate chemistry, morphology, and evolution of eggplant(Solanum)species[J]. J Chromatogr A, 2013, 1314: 154. DOI:10.1016/j.chroma.2013.09.017 |
 2017, Vol. 37
2017, Vol. 37 
