2. 福建中医药大学药学院, 福州 350122
2. School of Pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China
金牡感冒片由金银花、牡荆根、贯众、葫芦茶、三叉苦、山甘草、薄荷油共7味中药组成,具有疏风解表、清热解毒之功效,临床上用于外感风热、发热恶寒、头痛咳嗽和咽喉肿痛[1]。目前,金牡感冒片的含量测定主要是采用HPLC法测定绿原酸等成分的含量[2-3],测定指标较单一,难以对金牡感冒片进行综合评价。课题组前期采用HPLC-DAD-Q-TOF-MS对金牡感冒片化学成分进行鉴定研究[4],表明该复方中含有黄酮、酚酸及环烯醚萜苷三大类成分,其中酚酸类有效活性成分主要包括绿原酸、新绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C、原儿茶酸、对羟基苯甲酸;黄酮类有效成分主要包括木犀草苷、夏佛塔苷、异夏佛塔苷、牡荆素鼠李糖苷、牡荆苷;环烯醚萜苷类则主要是獐牙菜苷和穗花牡荆苷。据报道[5-10],黄酮、酚酸及环烯醚萜类化合物为金银花的主要药效成分;黄酮类化合物牡荆苷为牡荆根的主要活性成分。基于此,为了对金牡感冒片进行更为全面的质量评价,本研究将针对上述15个主要活性成分进行定量研究。
查阅文献,中药复方多成分含量测定采用HPLC法往往分析时间过长[11-12],甚至需要1 h以上。随着近年来分析技术、分析仪器的发展而产生的超高效液相色谱(UPLC)与传统的HPLC相比,极大地改善了色谱分离度,缩短了分析时间,同时将UPLC与MS联用,更提高了该技术的分析灵敏度及精确度[13-15]。因此,本研究建立UPLC-MS/MS法同时对金牡感冒片中绿原酸、原儿茶酸、异绿原酸A、B、C等15个成分的定量分析,为金牡感冒片的质量控制提供了一种分析速度快、选择性强、灵敏度高、准确度高的检测方法。
1 仪器与试药ACQUITY UPLC H-Class超高效液相色谱仪(Waters公司);Xevo TQMS三重四极杆质谱(Waters公司);Waters Cortecs UPLC C18色谱柱(100 mm×2.1 mm,1.6 μm;填料:十八烷基硅烷键合硅胶;Waters公司);CAP225D型十万分之一分析天平(Sartorius公司);KQ-500E台式超声波清洗器(昆山市超声仪器有限公司)。
乙腈、甲醇均为色谱纯,Mili-Q超纯水。
新绿原酸(批号SH906332)、原儿茶酸(批号SH99503)、对羟基苯甲酸(批号SH99967)、绿原酸(批号SH327979)、隐绿原酸(批号SH905997)、木犀草苷(批号5373115)、芍药内酯苷(批号SH39011900)、甘草苷(批号SH551155)和2-羟基肉桂酸(批号SH614608)购自北京赛百草科技有限公司;獐牙菜苷(批号A0392)、夏佛塔苷(批号A0792)、穗花牡荆苷(批号A6810)购自成都曼思特生物科技有限公司;异绿原酸A、B、C(批号分别为E-0449、E-0450、E-0451)购自上海同田生物技术股份有限公司;异夏佛塔苷(批号B21563)、牡荆素鼠李糖苷(批号B20878)、牡荆苷(批号B20875)购自上海源叶生物科技有限公司,所有对照品质量分数均≥98%。12批金牡感冒片样品均来自漳州片仔癀药业股份有限公司。
2 方法与结果 2.1 色谱-质谱条件 2.1.1 色谱条件采用Waters Cortecs UPLC C18色谱柱(100 mm×2.1 mm,1.6 μm),柱温45 ℃;以乙腈(A)-0.1%甲酸水溶液(B)为流动相,梯度洗脱(0~2 min,5%A;2~4 min,5%A→10%A;4~6 min,10%A→16%A;6~8 min,16%A→23%A;8~8.5 min,23%A→58%A;8.5~9.5 min,58%A→90%A;9.5~10 min,90%A→5%A;10~12 min,5%A),流速为0.25 mL·min-1;进样量为2 μL。
2.1.2 质谱条件采用正负切换的质谱多反应监测模式(MRM),正离子模式毛细管电压3.0 kV,负离子模式毛细管电压2.5 kV;脱溶剂气流N2 800 L·h-1,脱溶剂温度500 ℃,锥孔气流N2 50 L·h-1,氩气作为碰撞气体;氮气为载气;离子源温度150 ℃;停留时间5 ms。
2.2 溶液的制备 2.2.1 对照品储备液及内标储备液取新绿原酸、原儿茶酸、对羟基苯甲酸、绿原酸、隐绿原酸、獐牙菜苷、夏佛塔苷、穗花牡荆苷、异夏佛塔苷、牡荆素鼠李糖苷、牡荆苷、木犀草苷、异绿原酸B、异绿原酸A、异绿原酸C的对照品适量,精密称定,分别加70%甲醇水溶液溶解并制备成质量浓度均为1 mg·mL-1的单一对照品储备液。以同样的方法制备甘草苷、芍药内酯苷、2-羟基肉桂酸3种内标储备液,质量浓度分别为0.32、0.25、0.81 μg·mL-1。
2.2.2 供试品溶液取金牡感冒片磨细并混合均匀,取0.20 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇水溶液100 mL,密塞,称量,超声处理(频率40 kHz,功率500 W)30 min,放冷,再称量,用70%甲醇水溶液补足减失的量,摇匀,提取液于15 000 r·min-1离心10 min,取上清液按1:1(500 μL:500 μL)加入内标储备液,摇匀,0.22 μm滤膜滤过,取续滤液进行测定。
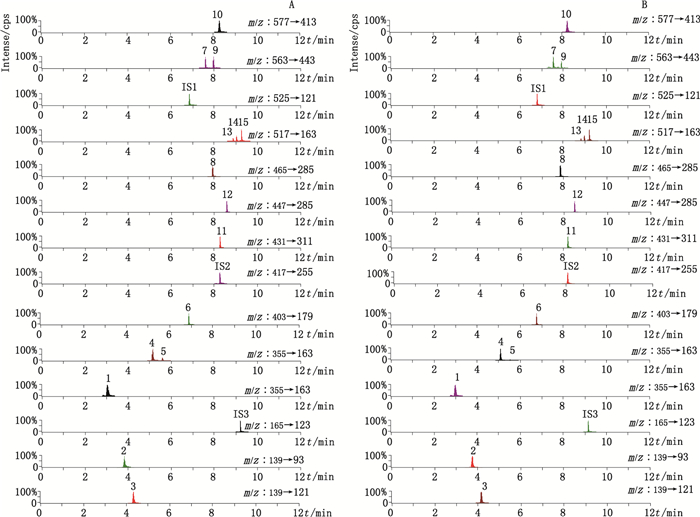
2.3 方法学考察 2.3.1 质谱测定方法采用正负切换的多反应监测模式(MRM),15个成分及内标的质谱分析条件参数见表 1,金牡感冒片和混合对照品在“2.1”项色谱和质谱条件下分析得到UPLC-MS/MS色谱图,见图 1。15个成分及内标均分离度良好,符合定量分析要求。
|
|
表 1 15个成分及3个内标物(IS)的质谱测定条件 Table 1 MS parameters for 15 analytes and 3 internal standards |
|
图 1 对照品(A)和金牡感冒片样品(B)的UPLC-MS/MS MRM色谱图 Figure 1 UPLC-MS/MS chromatograms of reference substances(A)and Jinmu Ganmao tablets(B)in multiple reaction monitoring(MRM)mode |
取“2.2.1”项下方法制备的对照品储备液适量,混合,再用70%甲醇水溶液稀释配制7个系列梯度浓度的混合对照品溶液,并按照1:1(500 μL:500 μL)加入内标储备液。在“2.1”项下色谱-质谱条件下进样测定峰面积,以各成分峰面积与内标物峰面积比值(Y)为纵坐标,以各成分质量浓度(X)为横坐标进行线性回归,绘制标准曲线,得到各成分的回归方程、相关系数及线性范围,结果见表 2。以信噪比(S/N)=10确定各成分的定量限,以信噪比(S/N)=3确定各成分的检测限,结果见表 2。
|
|
表 2 金牡感冒片中15个成分的回归方程、线性范围、检测限、定量限 Table 2 Regression equations, linear range, LOQ and LOD of 15 analytes |
取同一份对照品的混合溶液,并按照1:1(500 μL:500 μL)加入内标储备液,在“2.1”项下色谱-质谱条件下进样测定峰面积,1 d内连续进样6次测定日内精密度,连续测定3 d,每天进样3次测定日间精密度,分别计算各对照品与内标物的峰面积比值及比值的RSD,结果见表 3,表明仪器精密度良好。
|
|
表 3 精密度、稳定性、重复性结果 Table 3 Precision, stability and repeatability |
按“2.2.2”项下方法制备供试品溶液,分别于0、4、8、12、24 h按“2.1”项下色谱-质谱条件下进样进行测定,根据标准曲线计算各成分的浓度及其RSD,结果见表 3,表明供试品溶液在24 h内基本稳定。
2.3.5 重复性试验精密称取同一批金牡感冒片(批号S0010)6份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱-质谱条件下进样测定峰面积,根据标准曲线计算15个成分的含量及其RSD,结果见表 3,表明方法重复性良好。
2.3.6 回收率试验精密称取“2.3.5”项下已测知含量的金牡感冒片粉末6份,约0.10 g,分别精密加入15个对照品的混合溶液,按“2.2.2”项下方法制备供试溶液,按“2.1”项下色谱-质谱条件下进样测定峰面积,根据标准曲线计算各成分的含量,并计算回收率,结果见表 4。
|
|
表 4 金牡感冒片中15个成分的回收率试验(n=6) Table 4 Recoveries of 15 compounds in Jinmu Ganmao tablets |
取不同批号的金牡感冒片粉末,按照“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱-质谱条件下进样测定峰面积,根据标准曲线计算各成分的含量,结果见表 5。
|
|
表 5 金牡感冒片中15个成分的含量(mg·g-1,n=3) Table 5 Contents of 15 compounds Jinmu Ganmao tablets |
通过比较索氏、超声波和回流提取法,结果显示待测成分超声提取率最高,索氏提取法最低,因此选择超声提取法制备供试品溶液。在此基础上,比较了30%、50%、70%和90%甲醇溶液提取率,结果表明70%甲醇溶液提取率最高;接着考察了料液比1:50、1:100、1:500、1:1 000,结果表明1:500和1:1 000最佳;最后分别考察超声提取时间15、30、45、60 min,结果表明30 min后即可达到最大提取率。因此,最终确定供试品溶液制备方法:0.20 g样品加70%甲醇100 mL,超声波处理30 min即可。
3.2 色谱-质谱条件的选择色谱条件:通过比较超高效液相色谱柱不同粒径(1.6、1.7、1.8 μm)对色谱分离的影响,由于测定的绿原酸类成分及其聚合体异绿原酸类成分多个成分互为同分异构体,质谱行为相似,为了使其基线分离,最终选择1.6 μm的色谱柱;同时考察了甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.1%甲酸水等流动相对色谱分离和质谱检测的影响,最终选择乙腈-0.1%甲酸水作为流动相;质谱条件考察了正、负离子模式对检测的响应情况,结果发现酚酸类成分正离子模式优于负离子模式,而环烯醚萜苷类和黄酮类则相反,负离子模式优于正离子模式。因此,最终选择正负离子切换模式,并且对每一个测试化合物进行MRM条件的优化,优选最佳的母离子和检测子离子,其中酚酸类绿原酸、新绿原酸、隐绿原酸是一分子咖啡酰基奎宁酸同分异构体,质谱最佳灵敏度的子离子是分子离子峰失去奎宁酸基团的[M+H-quinic acid]+(m/z 163),异绿原酸A、B、C是两分子咖啡酰基奎宁酸同分异构体,同样其最佳子离子也是为[quinic acid+H-H2O]+(m/z 163);原儿茶酸则是母离子中性丢失H2O和CO2产生的[M+H-H2O-CO2]+(m/z 93);对羟基苯甲酸则是母离子失去一分子H2O产生的[M+H-H2O]+(m/z 121);环烯醚萜苷类獐牙菜苷最佳子离子是其脱葡萄糖基[glucose-H]-(m/z 179);穗花牡荆苷则是失去一分子水和葡萄糖基产生的[M-H-Glc-H2O]-(m/z 285);黄酮类成分木犀草苷最佳定量子离子是其分子离子峰失去葡萄糖基产生的[M-H-Glc]-(m/z 285);牡荆素鼠李糖苷失去鼠李糖基产生灵敏度最高的[M-H-Rha]-(m/z 413)子离子;夏佛塔苷、异夏佛塔苷和牡荆苷是C-苷类黄酮,其最佳定量子离子都是[M-H-C4H8O4]-子离子。同时,为了确保3类成分测定的准确性,本研究采用内标法进行测定,选择2-羟基肉桂酸作为有机酸类成分检测的内标,选择黄酮苷甘草苷作为黄酮类成分检测的内标,采用单萜苷芍药内酯苷作为环烯醚萜苷检测的内标。
综上,本文采用UPLC-MS/MS法同时测定12批次金牡感冒片中8个酚酸类、5个黄酮类、2个环烯醚萜苷类成分共计15个成分,该方法简便,快捷,准确,为综合评价金牡感冒片提供参考。
| [1] |
中华人民共和国卫生部药品标准中药成方制剂. 第十册[S]. 1998: 91 The Chinese Herbal Medicine Product Specifications Promulgated by the Ministry of Public Health, P R China.Vol 10[S].1998:91 |
| [2] |
魏尊喜. HPLC法测定金牡感冒片中绿原酸的含量[J]. 药物分析杂志, 2009, 29(8): 1359. WEI ZX. HPLC determination of chlorogenic acid in Jinmu Ganmao tablets[J]. Chin J Pharm Anal, 2009, 29(8): 1359. |
| [3] |
许舒瑜, 彭军, 陈小玲, 等. 金牡感冒片的质量标准研究[J]. 中国药房, 2014, 25(39): 3682. XU SY, PENG J, CHEN XL, et al. Study on quality standard of Jinmu Ganmao tablets[J]. China Pharm, 2014, 25(39): 3682. DOI:10.6039/j.issn.1001-0408.2014.39.12 |
| [4] |
HUANG MQ, XU SY, XU W, et al. Qualitative and quantitative analysis of the major constituents in Jin-Mu-Gan-Mao tablets by high-performance liquid chromatography with diode-array detection and quadrupole time-of-flight tandem mass spectrometry[J]. J Sep Sci, 2014, 37(23): 3497. DOI:10.1002/jssc.v37.23 |
| [5] |
PARK SH, ROH E, KIM HS, et al. Inhibition of IRAK-4 activity for rescuing endotoxin LPS-induced septic mortality in mice by lonicerae flos extract[J]. Biochem Biophys Res Commun, 2013, 442(3-4): 183. DOI:10.1016/j.bbrc.2013.11.045 |
| [6] |
LIAO Y, DONG S, KIYAMA R, et al. Flos Lonicerae extracts and chlorogenic acid protect human umbilical vein endothelial cells from the toxic damage of perfluorooctane sulphonate[J]. Inflammation, 2013, 36(3): 767. DOI:10.1007/s10753-013-9603-5 |
| [7] |
WU L, ZHANG ZJ, ZHANG ZS. Characterization of antioxidant activity of extracts from Flos Lonicerae[J]. Drug Dev Ind Pharm, 2007, 33(8): 841. DOI:10.1080/03639040701378019 |
| [8] |
LING TJ, LING WW, CHEN YJ. Antiseptic activity and phenolic constituents of the aerial parts of Vitex negundo var.cannabifolia[J]. Molecules, 2010, 15(11): 8469. DOI:10.3390/molecules15118469 |
| [9] |
QI LW, CHEN CY, LI P. Structural characterization and identification of iridoid glycosides, saponins, phenolic acids and flavonoids in Flos Lonicerae Japonicae by a fast liquid chromatography method with diode-array detection and time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom, 2009, 23(19): 3227. DOI:10.1002/rcm.v23:19 |
| [10] |
GAUTAM K, KUMAR P, POONIA S. Larvicidal activity and GC-MS analysis of flavonoids of Vitex negundo and Andrographis paniculata against two vector mosquitoes Anopheles stephensi and Aedes aegypti[J]. J Vector Borne Dis, 2013, 50(3): 171. |
| [11] |
向青, 王小花, 林慧, 等. HPLC-DAD-Q-TOF-MS / MS法的银黄颗粒主要成分定性与定量研究[J]. 中成药, 2015, 37(1): 105. XIANG Q, WANG XH, LIN H, et al. Qualitative and quantitative analysis of major constituents in Yinhuang granules by HPLC-DAD-Q-TOF-MS/MS[J]. Chin Tradit Pat Med, 2015, 37(1): 105. |
| [12] |
许文, 林婧, 丘建芳, 等. 双波长HPLC-DAD法测定闽产泽泻三萜类含量[J]. 福建中医药大学学报, 2013, 23(5): 23. XU W, LIN J, QIU JF, et al. Determination of triterpenoid isolated from Rhizoma Alismatis in Fujian by dualwavelength HPLC-DAD method[J]. J Fujian Univ TCM, 2013, 23(5): 23. |
| [13] |
许文, 傅志勤, 林婧, 等. HPLC-Q-TOF-MS和UPLC-QqQ-MS的三叶青主要成分定性与定量研究[J]. 中国中药杂志, 2014, 39(22): 4365. XU W, FU ZQ, LIN H, et al. Qualitative and quantitative analysis of major constituents in Tetrastigma hemsleyanum by HPLC-Q-TOF-MS and UPLC-QqQ-MS[J]. China J Chin Mater Med, 2014, 39(22): 4365. |
| [14] |
许文, 傅志勤, 林婧, 等. UPLC-MS/MS法同时测定三叶青中10种黄酮类成分[J]. 药学学报, 2014, 49(12): 1711. XU W, FU ZQ, LIN J, et al. Rapid simultaneous determination of ten major flavonoids in Tetrastigma hemsleyanum by UPLC-MS/MS[J]. Acta Pharm Sin, 2014, 49(12): 1711. |
| [15] |
罗益远, 刘娟秀, 刘廷, 等. UPLC-MS/MS法同时测定何首乌中二苯乙烯、蒽醌、黄酮及酚酸类成分[J]. 质谱学报, 2016, 37(4): 327. LUO YY, LIU JX, LIU T, et al. Simultaneous determination of stilbenes, anthraquinones, flavonoids and phenolic acids in Polygoni Multiflori Radix by UPLC-MS/MS[J]. J Chin Mass Spectrom Soc, 2016, 37(4): 327. DOI:10.7538/zpxb.youxian.2016.0016 |
 2017, Vol. 37
2017, Vol. 37 
