2. 中肽生化有限公司, 杭州 310018
2. Chinese Peptide Co., Ltd., Hangzhou 310018, China
醋酸亮丙瑞林是一种合成的线性九肽,它是强效促性腺激素释放激素激动剂,临床上用于激素依赖型肿瘤的治疗,主要用于前列腺癌、子宫内膜异位、中枢性性早熟等症,还可用于良性纤维瘤引起的贫血患者的术前治疗[1]。其注射剂Eligard用于晚期前列腺癌患者的姑息治疗。本品在美国药典39(USP 39-NF 34)和欧洲药典8.0(EP 8.0)均有收载,相关原料药和制剂在国内已经有上市产品,但中国药典尚未收载。
国内对醋酸亮丙瑞林注射剂的有关物质测定已有文献报道[2],但对醋酸亮丙瑞林的杂质谱研究[3]和基于杂质谱的有关物质分析方法还未见文献报道。合成多肽类药物属于特殊的化学药物,目前对此类药物有关物质的控制国内还停留在限度控制阶段[4-6],未对多肽类药物的杂质谱进行深入的研究,本文以醋酸亮丙瑞林工艺路线中的中间体、潜在副产物、降解产物和文献报道的已知杂质[7-8]为研究对象,依据欧洲药典8.0附录“Substances for pharmaceutical use”中化学合成多肽有机杂质研究限度推荐[9]、多肽药物研究指导原则[10-12]和分析方法验证指导原则[13-14],对本品的杂质谱进行研究,并建立了检测所有可能杂质的有关物质分析方法,为醋酸亮丙瑞林的质量控制提供有效保障。
1 仪器与试药安捷伦公司1100和1260型高效液相色谱仪,EZChrom色谱软件;安捷伦公司1100-热电LCQ Advantage质谱仪(ESI),Xcalibur软件;布鲁克公司MADLI-TOF/TOF(FLEXTM Series autoflexspeedTM),FlexControl软件;Waters ACQuity UPLC超高效液相色谱仪,EMPOWER软件;赛分公司Sepax GP-C18色谱柱(150 mm×4.6 mm,3 μm;填料:全覆盖键合硅胶);赛多利斯公司ME215P十万分之一电子天平,梅特勒托利多公司FE20 pH计。
醋酸亮丙瑞林对照品(批号CK-04-0001,由中肽生化有限公司标化,可溯源至Leuprolide Acetate USP对照品/批号H0L044);醋酸亮丙瑞林原料药供试品(批号CK-04-0002、CK-04-0003、CK-04-0004、方法验证批CK-03-0001),中间体(批号CK-01-0001),杂质A、B、C、D、E、F、G、H、I、M对照品(批号和序列信息详见表 1),均为中肽生化有限公司提供。乙腈、正丙醇、三乙胺和磷酸为色谱纯,水为纯化水,其他试剂均为分析纯。
|
|
表 1 亮丙瑞林和研究杂质的批号和氨基酸序列信息 Table 1 The batch number and sequence information for leuprorelin and impurities |
色谱柱:全覆盖键合硅胶色谱柱,Sepax GP-C18(150 mm×4.6 mm,3 μm);流动相:三乙胺缓冲溶液(取三乙胺15.2 g溶解于800 mL水中,用磷酸调节pH至3.0,加水稀释至1 000 mL)-正丙醇乙腈混合溶液[(正丙醇-乙腈(2:3)](83:17),等度洗脱90 min;流速:0.9 mL·min-1;柱温:35 ℃;检测波长:220 nm;进样量:20 μL。
2.2 杂质谱研究 2.2.1 杂质分析策略醋酸亮丙瑞林工艺过程可能产生的杂质:合成过程中带入的工艺杂质,如因起始物料带入或反应过程中产生的消旋杂质(本肽链中的氨基酸均具有手性,特别是组氨酸His为易消旋的氨基酸),因部分氨基酸未连接上产生的缺失肽(肽链经多步反应可能存在反应不完全的情况),因肽键断裂产生的断裂肽,氨基酸侧链的不完全脱保护所形成的副产物等肽类相关物质;肽链中存在大量的酰胺键,与一般药物相比更不稳定,容易由于多肽脱酰胺、氧化、水解、消旋等不稳定因素而产生降解产物。美国药典和欧洲药典中醋酸亮丙瑞林各论项下均提及的指定杂质:杂质A、B、C、D;欧洲药典亮丙瑞林各论项下列出的其他杂质:杂质E、F、G、H、I。欧洲药典8.0附录[9]中规定合成多肽的杂质报告限度0.1%,鉴定限度0.5%和质控限度1.0%。基于工艺和相关文献报道,开展醋酸亮丙瑞林的杂质谱研究。
2.2.2 待研究杂质定向合成和确证根据“2.2.1”项的杂质分析,对有关杂质进行定向合成,用美国药典方法对各杂质进行纯度控制和相对保留时间(RRT)定位,使用热电ESI质谱对各杂质进行分子量测定,采用Waters UPLC法氨基酸分析专用试剂包和色谱柱(Accq Tag Ultra C18 1.7 μm 100 mm×2.1 mm)对各序列氨基酸组成进行分析确证,确保定向合成杂质的正确性。
2.2.3 醋酸亮丙瑞林中杂质确证 2.2.3.1 杂质收集分析通过对醋酸亮丙瑞林各批次HPLC有关物质检测图谱杂质比对分析,确认无大于0.5%的杂质,大于0.1%的杂质主要是主峰相邻前杂质和相邻后杂质,见图 1。对主峰前杂质和后杂质进行富集,通过氨基酸组成和质谱分析,初步确认主峰相邻前杂质为醋酸亮丙瑞林同分异构体,主峰相邻后杂质为序列中4号位少丝氨酸(Ser)的残缺肽(杂质M)。
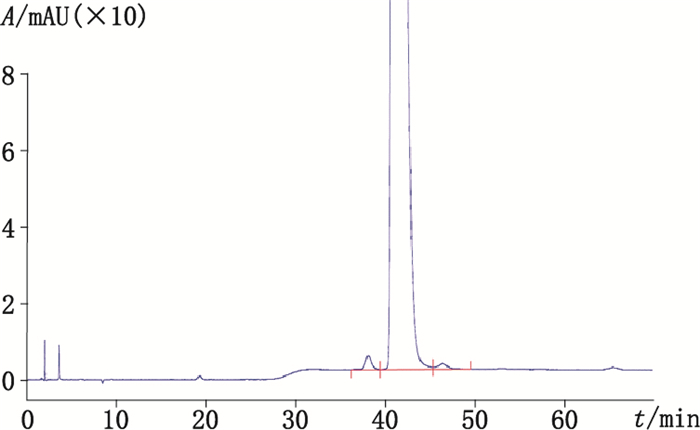
|
图 1 醋酸亮丙瑞林供试品溶液(1 mg·mL-1)色谱图 Figure 1 Chromatogram of leuprorelin acetate tested solution(1 mg·mL-1) |
分析收集的主峰前杂质相对分子质量测定结果为1 209.7,和亮丙瑞林的相对分子质量1 209.4一致;且氨基酸分析结果也和亮丙瑞林的理论序列一致;可判定为亮丙瑞林的同分异构体。根据药典已经报道的主峰相邻前杂为杂质B(RRT0.9)和杂质I(RRT0.94),杂质B和杂质I均为异构体杂质;而在色谱条件下前杂质的RRT也约为0.9,故可以初步推断主峰前杂质为杂质B或杂质I。
2.2.3.1.2 主峰相邻后杂质收集分析收集的主峰后杂质相对分子质量测定结果为1 122.0,和亮丙瑞林的相对分子质量1 209.4相比少了87.4,通过计算分析可能为亮丙瑞林序列中少了1个丝氨酸Ser;且氨基酸分析结果和亮丙瑞林序列中少Ser的氨基酸种类和个数一致;亮丙瑞林序列中只有4位有Ser,故初步推断主峰后杂质为杂质M。
2.2.3.2 已知杂质定位将定向合成杂质A、B、C、D、E、F、G、H、I、M各自用流动相配制成0.01 mg·mL-1(相当1%供试品溶液浓度)的杂质定位溶液,按“2.1”项色谱条件检测定位。再分别称取以上杂质各0.1 mg和醋酸亮丙瑞林10 mg至10 mL量瓶中,加流动相溶解并定容至刻度,作为供试品杂质混合溶液,按“2.1”项色谱条件检测。结果表明,各杂质在本色谱条件下均能被检出,且供试品中未检出杂质A、D、E、F、G、H;杂质C和杂质M均在主峰后出峰,但不能很好分离,由于“2.2.3.1”项已经确认主峰相邻后杂质收集液为杂质M,故认为供试品中不含杂质C。见图 2。
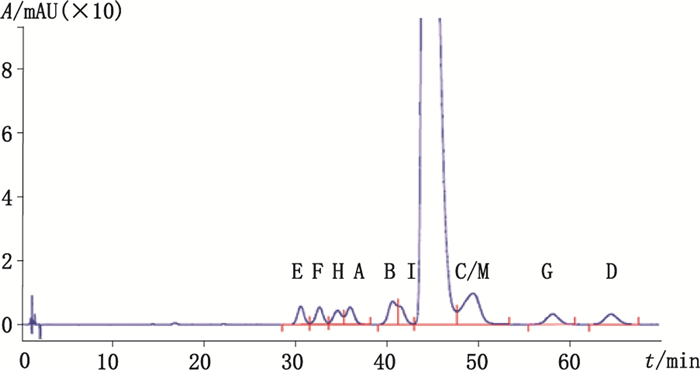
|
图 2 供试品溶液添加杂质后的溶液色谱图 Figure 2 Chromatogram of tested sample solution spiked with the impurities |
从图 2可见主峰相邻前杂质峰为杂质B或杂质I,且两者均为醋酸亮丙瑞林异构体,从相对分子质量和氨基酸组分分析都无法识别,故单独将0.01 mg·mL-1杂质I溶液、供试品溶液、供试品溶液和0.002 5 mg·mL-1杂质I混合溶液(称取供试品1 mg,加入1mL的0.002 5mg·mL-1杂质I溶液溶解,即得),按“2.1”项色谱条件检测。结果表明,供试品主峰相邻前杂质不可能是杂质I。见图 3。
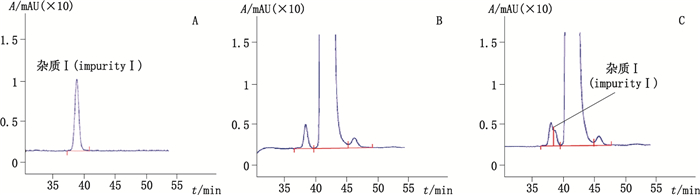
|
图 3 杂质I溶液(A)、供试品溶液(B)、供试品和杂质I混合溶液(C)色谱图 Figure 3 Chromatogram of impurity I(A), tested sample solution(B), tested sample solution spiked with impurity I(C) |
通过系列杂质谱研究,最终确定采用本生产工艺的醋酸亮丙瑞林,无大于0.5%的杂质,大于0.1%的杂质如下:主峰相邻前杂质,即杂质B(2-D-His-leuprorelin);主峰相邻后杂质,即杂质M(序列中4号位的Ser缺失)。且本色谱条件能将各可能杂质有效分离和检出。
2.3 专属性试验 2.3.1 系统适用性试验分别取空白溶液(流动相)、系统适用性溶液(按USP各论项下描述的碱和100 ℃水浴破坏后的溶液),按照“2.1”项色谱条件进行测定,记录色谱图。结果表明,在上述色谱条件下,系统适用性溶液中主峰与杂质B和杂质M之间均能得到良好分离(分离度2.6和2.3),且空白对测定无干扰,方法专属性良好,结果见图 4。
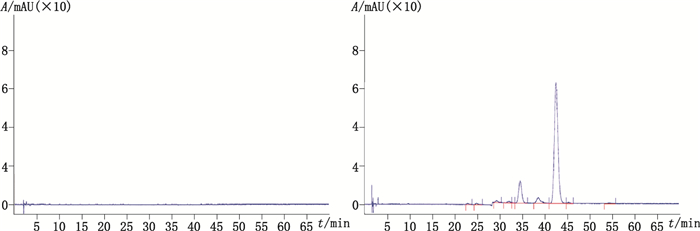
|
图 4 空白溶液(A)、系统适用性溶液(B)色谱图 Figure 4 Chromatogram of the blank sample solution(A)and system stability sample solution(B) |
称取醋酸亮丙瑞林进行如下试验:
(1) 酸破坏:取本品10 mg置玻璃容器中,加0.1 mol·L-1盐酸1 mL,100 ℃水浴1 h后,用0.1 mol·L-1氢氧化钠溶液中和,将溶液转移入10 mL量瓶中,加流动相定容至刻度,摇匀;(2)碱破坏:取本品10 mg,置10 mL量瓶中,加0.1 mol·L-1氢氧化钠溶液1 mL,室温放置0.5 h后,用0.1 mol·L-1盐酸中和,加流动相定容至刻度,摇匀;(3)氧化破坏:取本品10 mg置10 mL量瓶中,加30%过氧化氢溶液1 mL,室温放置2 h后,加流动相定容至刻度,摇匀;(4)光照破坏:取光照(4 500±500)1x 14 d后的样品10 mg,置10 mL量瓶中,加流动相溶解并定容至刻度,摇匀;(5)高温破坏:取高温(130 ℃)24 h后的样品10 mg,置10 mL量瓶中,加流动相溶解并定容至刻度,摇匀;(6)高湿破坏:取湿度(92.5%)5 d后的样品10 mg,置10 mL量瓶中,加流动相溶解并定容至刻度,摇匀;(7)称取中间体(粗品)1 mg加入流动相1 mL溶解、混匀。取上述制得的溶液按照“2.1”项色谱条件进行测定,记录色谱图。结果表明,醋酸亮丙瑞林在光照和高湿条件下较稳定,在其他各破坏条件下均有不同程度的新杂质产生;且在各破坏条件下产生的杂质峰与主峰均基线分离(分离度≥2.3),通过峰纯度扫描确认降解后色谱主峰仍为单峰(峰纯度1.000)。见图 5。
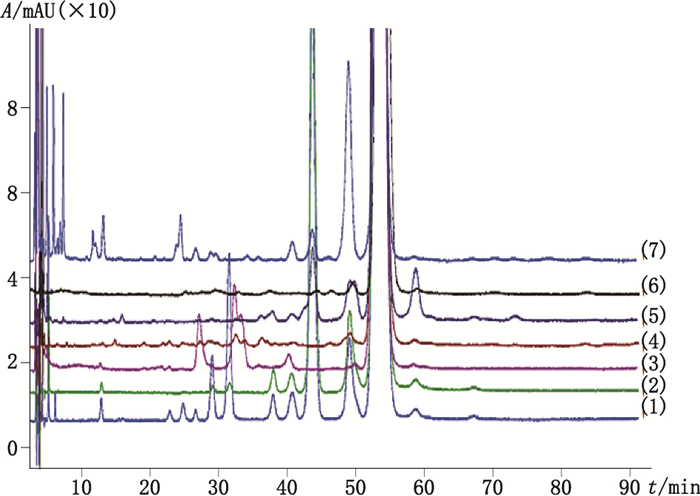
|
(1)酸破坏(acid hydrolysis)(2)碱破坏(alkaline hydrolysis)(3)氧化破坏(oxidative degradation)(4)光照破坏(photolytic degradation)(5)高温破坏(thermo degradation)(6)高湿破坏(moisture degradation)(7)中间体(intermediate) 图 5 醋酸亮丙瑞林经强降解试验后的色谱图 Figure 5 Chromatogram of leuprorelin acetate after forced degradation |
称取醋酸亮丙瑞林供试品、杂质B和杂质M对照品适量,用流动相溶解并逐步定量稀释,进样分析,按S/N≈3和S/N≈10,确定醋酸亮丙瑞林、杂质B和杂质M的检测限均为16 ng,定量限均为50 ng。
2.5 线性关系考察及校正因子测定分别精密称取醋酸亮丙瑞林对照品、杂质B和杂质M对照品各10 mg,置10 mL量瓶中,加流动相溶解并定容至刻度,摇匀;精密量取上述溶液2.0 mL置100 mL量瓶中,加流动相定容至刻度,摇匀,作为线性最高浓度点溶液(0.02 mg·mL-1),取该溶液用流动相逐步稀释成系列浓度对照品溶液(0.001、0.002、0.004、0.008、0.01 mg·mL-1),按照“2.1”项色谱条件进行测定,记录色谱图。按最小二乘法,以浓度X(mg·mL-1)为横坐标,峰面积Y为纵坐标进行线性回归,得到醋酸亮丙瑞林和各杂质的回归方程即为标准曲线。以杂质标准曲线的斜率和醋酸亮丙瑞林标准曲线的斜率比值计算校正因子,同时计算Y轴截距相当于100%响应值的比例(X用0.01 mg·mL-1代入忽略截距的计算结果即为100%响应值)。结果显示,醋酸亮丙瑞林和各杂质浓度从0.001 mg·mL-1至0.02 mg·mL-1范围内线性良好,各杂质相对于醋酸亮丙瑞林的校正因子均在0.9~1.1范围内,见表 2。
|
|
表 2 醋酸亮丙瑞林及其有关物质的回归方程、相关系数(r2)、校正因子和Y轴截距相当于100%响应值的比例 Table 2 The regression equation, correlation coefficient(r2), correction factor, the ratio between Y-axis intercept and 100% response value of leuprorelin acetate and related substances |
考察杂质限度(0.5%)50%~150%的回收率。精密称取杂质B和杂质M对照品各25 mg至100 mL量瓶中,加流动相溶解并定容至刻度,摇匀,作为杂质对照品储备液(0.25 mg·mL-1);精密量取上述杂质对照品储备液1.0、2.0、3.0 mL置100 mL量瓶中,加流动相稀释至刻度,摇匀,分别作为杂质对照品50%、100%、150%的标准工作液。精密称取醋酸亮丙瑞林10 mg,共9份,分别置10 mL量瓶中,分别以50%,100%、150%的标准工作液溶解并稀释定容至刻度,每个浓度各3份。按照“2.1”项色谱条件进行测定,记录色谱图,分别计算50%、100%、150%浓度下的加样回收率。结果显示,50%浓度水平杂质B、杂质M的平均回收率(n=3)分别为96.2%,109.1%;100%浓度水平杂质B、杂质M的平均回收率(n=3)分别为97.2%,110.0%;150%浓度水平杂质B、杂质M的平均回收率(n=3)分别为94.8%,105.8%;杂质B、杂质M的平均回收率(n=9)分别为96.1%、108.3%,RSD分别为1.6%、3.0%。上述结果提示,本方法准确度符合要求。
2.7 精密度试验 2.7.1 重复性试验精密称取醋酸亮丙瑞林10 mg置10 mL量瓶中,加流动相溶解并定容至刻度,作为供试品溶液;精密量取1.0 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀,作为自身对照溶液。平行6份,按照“2.1”项色谱条件进行测定,记录色谱图。计算杂质B、杂质M和总杂质计算结果的RSD,结果杂质B、杂质M和总杂质的RSD分别为0.85%、1.9%和1.7%,表明该方法重复性良好。
2.7.2 中间精密度试验不同天,由另一名分析员,使用另一台HPLC仪器,按重复性试验项下的制备方法,平行制备供试品溶液6份,按照“2.1”项色谱条件进行测定,记录色谱图。取中间精密度和重复性项下12份样品中杂质B、杂质M和总杂质的计算结果,求此3个杂质12份结果的RSD值,结果显示杂质B、杂质M和总杂质的RSD分别为2.0%、3.2%和2.6%,表明该方法中间精密度良好。
2.8 进样精密度试验取回收率试验、线性关系考察、重复性试验和中间精密度试验项下,自身对照溶液和供试品溶液运行5次的结果作为进样精密度评价,记录自身对照、杂质B和杂质M峰面积和保留时间。结果显示,自身对照、杂质B和杂质M峰面积的RSD分别为0.38%、1.4%和0.38%,自身对照、杂质B和杂质M保留时间的RSD分别为0.13%、0.30%和0.34%,说明检测仪器和系统进样精密度良好。
2.9 供试品溶液稳定性试验取重复性试验项下供试品溶液和自身对照溶液,分别在室温放置0、6、12、24、48和72 h,按照“2.1”项色谱条件进行测定,记录色谱图。按自身对照法计算供试品溶液中杂质含量,比较样品待测杂质变化和新杂质产生情况。72 h内杂质B、杂质M和总杂质的RSD分别为1.6%、0.82%和1.1%,杂质B、杂质M和总杂质的最大变化值分别为0.01%、0.01%和0.02%。说明供试品溶液在室温放置72 h内稳定。
2.10 有关物质测定分别精密称取醋酸亮丙瑞林(批号CK-04-0002、CK-04-0003、CK-04-0004)10 mg置10 mL量瓶中,按重复性试验项下方法配制供试品溶液和自身对照溶液。按照“2.1”项色谱条件进行测定,记录色谱图。按自身对照法计算供试品溶液中杂质含量,结果见表 3。
|
|
表 3 有关物质测定结果(%) Table 3 The determination results of the related substances |
本方法以USP 39-NF 34和EP 8.0的leuproreline各论中的色谱条件为基础,在USP和EP允许的变动范围内,流动相比例从三乙胺缓冲液-有机相(85:15)调整为三乙胺缓冲液-有机相(83:17),色谱柱长从100 mm调整为150 mm,色谱柱温度从25 ℃调整为35 ℃,从而使原药典方法不能分离的主峰相邻后杂质(杂质M)得到基线分离。为考察方法耐用性,分别调整柱温、流速、流动相比例、流动相pH、不同批号色谱柱,结果表明,本方法耐用性良好,主峰前后杂质均基线分离(分离度≥1.8)。
3.2 不加校正因子的主成分自身对照法文献[15]中提出杂质相对于主成分的响应因子在0.9~1.1之间,可使用不加校正因子的主成分自身对照法,否则需使用加校正因子的主成分自身对照法。本方法中杂质B和杂质M相对于主成分的响应因子为1.09,因此日常检测可使用不加校正因子的主成分自身对照法。如果开发的色谱条件相对响应因子超出此范围,则必须使用加校正因子的主成分自身对照法,或建立以杂质对照品进行定性定量分析的方法。
3.3 杂质限度控制指标的制定美国药典和欧洲药典对有关物质控制限度如下:指定杂质A、B、C限度分别≤0.5%,指定杂质D限度≤1.0%,其他各单一杂质限度≤0.5%,总杂质限度≤2.5%。本研究基于醋酸亮丙瑞林的杂质谱研究,确认规定生产工艺下制备的醋酸亮丙瑞林不含已知杂质A、C、D、E、F、G、H、I。为严格控制本品中的杂质,特将控制限度提高,规定指定杂质B限度≤0.5%,其他各单一杂质限度限度≤0.5%,总杂质限度≤2.0%。
3.4 小结本文建立了一种能将醋酸亮丙瑞林原料药中的可能杂质有效分离,并对有关物质进行准确检测的分析方法。本方法简单、灵敏、专属、准确,适用于醋酸亮丙瑞林原料药中有关物质放行检测和稳定性考察,同时为多肽药物杂质谱研究提供了参考。
| [1] |
黄红萍. 醋酸亮丙瑞林的研究进展[J]. 海峡药学, 2013, 25(7): 14. HUANG HP. Research progress of leuprorelin acetate[J]. Strait Pharm J, 2013, 25(7): 14. |
| [2] |
刘彤焱, 石涛, 张胜强. 醋酸亮丙瑞林注射液的高效液相色谱分析[J]. 江苏药学与临床研究, 2005, 13(1): 15. LIU DY, SHI T, ZHANG SQ. Determination of the leuprorelin acetate injection liquid by HPLC[J]. Jiangsu Pharm Clin Res, 2005, 13(1): 15. |
| [3] |
胡昌勤. 化学药品杂质控制的现状与展望[J]. 中国新药杂志, 2015, 24(15): 679. HU CQ. Current situation and the trend in impurity profiling of chemical drugs[J]. Chin J New Drugs, 2015, 24(15): 679. |
| [4] |
田文静, 任雪, 廖海明. 多肽类药物质量控制研究进展[J]. 药物分析杂志, 2013, 33(7): 1115. TIAN WJ, REN X, LIAO HM. Research progress of the quality control of peptide drugs[J]. Chin J Pharm Anal, 2013, 33(7): 1115. |
| [5] |
中国药典2015年版. 二部[S]. 2015: 1160 ChP 2015. Vol Ⅱ[S]. 2015:1160 |
| [6] |
中国药典2015年版. 二部[S]. 2015: 1533 ChP 2015. Vol Ⅱ[S]. 2015:1533 |
| [7] |
EP 8. 0[S]. 2014:2601
|
| [8] |
USP 39-NF 34[S]. 2016:4514
|
| [9] |
EP 8. 0[S]. 2014:765
|
| [10] |
黄晓龙. 美国FDA关于合成多肽的指导原则[J]. 中国新药杂质, 2001, 10(8): 626. HUANG XL. FDA guidance for the synthetic peptide[J]. Chin J New Drugs, 2001, 10(8): 626. |
| [11] |
[H]GPH11-1化学合成多肽药物药学研究技术指导原则[S]. 2007 [H]GPH11-1 Technology Guidance of Pharmaceutical Research for Synthetic Peptide[S]. 2007 |
| [12] |
王鹏. 合成多肽药物结构确证和质量研究[J]. 中国新药杂志, 2009, 18(24): 2302. WANG P. Studies for structure determination and quality specification of synthetic peptide drugs[J]. Chin J New Drugs, 2009, 18(24): 2302. DOI:10.3321/j.issn:1003-3734.2009.24.005 |
| [13] |
[H]GPH5-1化学药物质量控制分析方法验证技术指导原则[S]. 2005 [H]GPH5-1 Analysis Method Validation Guidance of Chemical Drugs Quality Control[S]. 2005 |
| [14] |
中国药典2015年版. 四部[S]. 2015: 374 ChP 2015. Vol Ⅳ[S]. 2015:374 |
| [15] |
谢沐风, 罗霞萍, 陈亚美. 如何建立HPLC法测定有关物质的方法[J]. 中国药品标准, 2002, 3(6): 6. XIE MF, LUO XP, CHEN YM. How to build the method of the related substance analysis by HPLC[J]. Drug Stand China, 2002, 3(6): 6. |
 2017, Vol. 37
2017, Vol. 37 
