2. 西北大学 生命科学学院, 西安 710069
2. College of Life Sciences, Northwest University, Xi'an 710069, China
寒凝血瘀证是寒湿之外邪侵袭机体,导致局部或全身的血液循环障碍,伴随机体能量代谢障碍。而三磷酸腺苷(ATP)是维持机体正常活动所需能量的能源物质,机体组织中磷酸腺苷(ATP、ADP、AMP)化合物的含量变化直接反映了机体的能量代谢水平,是判断机体内病变或药效的一个重要指标[1-3],磷酸腺苷含量的升高对于提高机体的御寒和生存能力具有极其重要的意义。
红花(Carthami Flos)为活血化瘀之品,活血止痛,破瘀生新,具有扩张冠状动脉、降血压、抗凝血、耐缺氧、抗炎镇痛、改善微循环等药理作用[4-5]。甘草(Glycyrrhizae Radix et Rhizoma)为百药之首,长于疏通血脉,消肿导毒,调和诸药,具有抗病毒、抗氧化、抗真菌、抗肿瘤、抗诱变等多种作用[6-7]。红花-甘草合用,临床上常用于活血通络、清热解毒、跌打瘀肿、缓急止痛等。本实验以寒凝血瘀证大鼠为研究对象,观察大鼠血液流变学指标及不同组织磷酸腺苷(ATP、ADP、AMP)的含量表达变化,从能量代谢角度探讨甘草对红花对机体能量代谢作用的影响,为红花-甘草配伍的临床应用提供实验依据。
1 材料及方法 1.1 实验仪器Agilent 1100 Series高效液相色谱系统(包括G1312C二元泵,G1315B DAD检测器,Agilent Chemstation工作站;Agilent科技有限公司);KQ5200DE型数控超声波清洗仪(江苏省昆山市超声仪器有限公司);GL-21M高速冷冻离心机(长沙湘仪离心机仪器有限公司);Mettler Toledo XS105DU型十万分之一电子天平(梅特勒托利多公司);Mettler PM 4600电子天平(梅特勒托利多公司);DY89-Ⅱ型电动玻璃匀浆机(宁波新芝生物科技股份有限公司);Maxima超纯水机(上海技舟化工科技有限公司);YDS-10型液氮生物容器(四川成都金凤液氮容器有限公司);NENCO-减压旋蒸仪(上海申生科技有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);VORTEX QILINBTER-6快速混匀器(海门市其林贝尔仪器制造有限公司)。
1.2 药品及试剂红花、甘草药材(购于陕西省药材公司,由西北大学生命科学学院房敏峰教授鉴定);5’-三磷酸腺苷(ATP)二钠盐,5’-二磷酸腺苷(ADP)二钠盐,5’-腺苷一磷酸(AMP)二钠盐(美国Sigma公司,批号分别为SLBB7195V,91M7002V,SLBB5188V,纯度均≥99%);甲醇为色谱纯。
1.3 动物及模型制作SD大鼠(SPF级,陕医动字第08-018号为合格证号),购自西安交通大学医学院实验动物中心,体重为220.0~240.0 g,饲养环境温湿度分别为(25±3)℃、(52±3)%。
SD大鼠在实验室适应7 d后,随机选取10只未予任何处理的正常大鼠为空白对照组,余35只正常大鼠根据中医“寒邪致淤”之病因病机,采用冷刺激的冷水冰浴方法制作寒凝血瘀证大鼠模型。适应性喂养1周后,放入0 ℃的冰水中,每天冷应激5~7 min,连续冷刺激30 d制作寒凝血瘀证模型。观察造模大鼠症状及体征变化,同时对血浆粘度、全血粘度及红细胞压积血液流变学参数进行检测及评价[8-12]。
与空白对照组比较,模型组对照组大鼠毛色萎暗,精神不振,少动,且大部分出现腹泻;全血粘度(ηL、ηM、ηH)和血浆粘度(ηP)均显著升高(P < 0.01),表明造模成功。
1.4 红花、红花-甘草供试品溶液制备取干燥至恒重的粉碎药材红花、红花-甘草(1:1)各200.0 g,分别置于3 000 mL圆底烧瓶中,8倍量水浸泡40 min,加热回流3次,每次2 h,合并滤液,减压旋转蒸发至约300 mL,作为红花、红花-甘草的供试品溶液(相当于2.0 g·mL-1的红花生药),4 ℃冷藏备用。
1.5 对照品储备液的配制精密称取ATP、ADP及AMP的对照品各10.0 mg,分别置于5.0 mL的避光量瓶中,用超纯水定容,制得质量浓度均为2.00 mg·mL-1的对照品母液;精密量取2.00 mg·mL-1的ATP对照品母液1.25 mL、ADP对照品母液2.0 mL和AMP对照品母液2.5 mL,用超纯水稀释至10.0 mL,配制成含ATP为250.0 μg·mL-1、ADP为400.0 μg·mL-1和AMP为500.0 μg·mL-1的混合对照品溶液;取上述混合对照品溶液适量,以超纯水将逐级倍比稀释,即得系列质量浓度的混合对照品溶液(ATP为250.0、125.0、62.5、31.25、6.25、1.25 μg·mL-1;ADP为400.0、200.0、100.0、50.0、10.0、2.0 μg·mL-1;AMP为500.0、250.0、125.0、62.5、12.5、2.5 μg·mL-1);分装,避光,-20 ℃保存备用。
1.6 实验分组、给药及取组织方案30只造模成功的大鼠随机分为模型对照组(10只)、红花组(10只)、红花-甘草组(10只)。空白对照组和模型对照组灌服生理盐水10.0 mL·kg-1,红花组灌服红花供试品溶液20.0 g·kg-1,红花-甘草组灌服红花-甘草合煎液20.0 g·kg-1。连续15 d,于给药结束后12 h,用10%水合氯醛5 mL·kg-1腹腔麻醉大鼠,麻醉后剖开腹腔,取心、肝、脾、肺及肾组织,置于锡箔纸中包扎,立即置于液氮中保存。
1.7 组织供试品溶液的制备取出液氮保存的各组织,用0 ℃的生理盐水洗净,精确称取0.3 g于预冷的玻璃匀浆杯中,按5 mL·g-1加入预冷的0.4 mol·L-1的高氯酸溶液,迅速置于冰浴中制成匀浆液,8 000 r·min-1离心10 min,取上清液,加入1 mol·L-1的氢氧化钠调pH至6.5,再次8 000 r·min-1离心10 min,用0.45 μm滤膜将上清液过滤,即成组织供试品溶液。以上操作在4 ℃下完成。
1.8 色谱条件色谱柱:Agilent TC-C18色谱柱(4.6 mm×250 mm,5 µm);流动相:pH为6.5的20 mmol·L-1 NaH2PO4-Na2HPO4缓冲液(17.6 mmol·L-1 NaH2PO4-2.4 m mol·L-1 Na2HPO4)-甲醇(99:1);流速:0.8 mL·min-1;柱温:25 ℃;检测波长为254 nm;进样量:20.0 μL。
2 结果 2.1 色谱图在本文色谱条件下,ATP、ADP、AMP均得到较好分离。磷酸腺苷混合对照品和标准心组织中ATP、ADP、AMP的色谱图,见图 1。
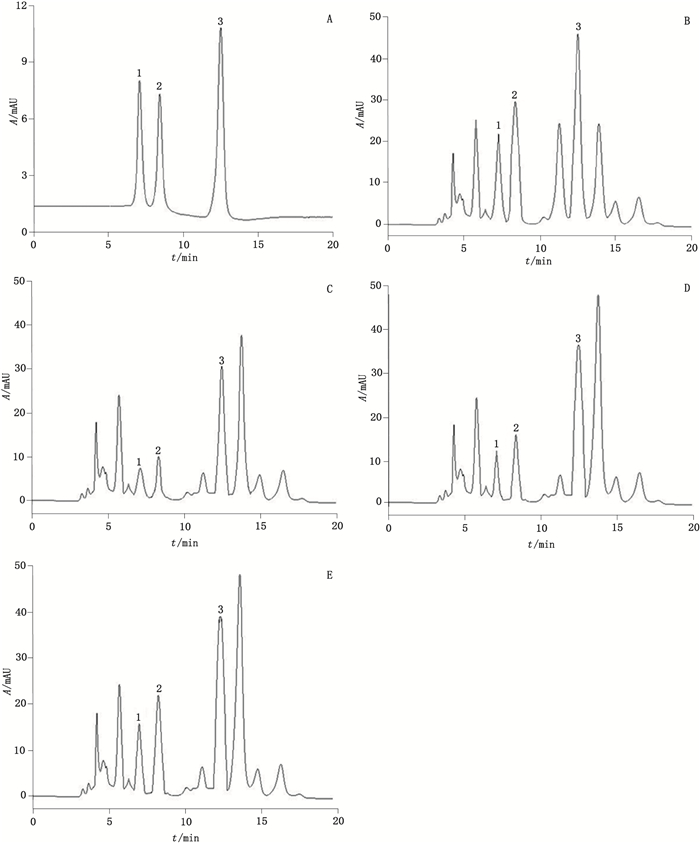
|
A.磷酸腺苷混合对照品(adenosine phosphate mixed reference substances)B~E.心组织(空白对照组、模型对照组、红花组、红花-甘草组)[standard heart tissue (blank control group,model group,Carthami Flos group,Carthami Flos-Glycyrrhizae Radix et Rhizoma group)]
1. ATP2. ADP3. AMP 图 1 对照品与标准心组织样品的色谱图 Figure 1 Chromatograms of the control and standard heart tissue samples |
精密吸取“1.5”项系列质量浓度的ATP、ADP及AMP混合对照品溶液20.0 μL,以拟定的色谱条件进样分析,记录峰面积,以磷酸腺苷化合物的质量浓度(X,μg·mL-1)为横坐标,峰面积(Y)为纵坐标进行线性回归,分别得ATP、ADP及AMP的回归方程:
Y=43.080X-6.048 r=0.999 9
Y=54.520X-23.311 r=0.999 8
Y=55.636X+7.203 r=0.999 8
ATP、ADP及AMP质量浓度分别在1.25~250.0、2.0~400.0和2.5~500.0 μg·mL-1范围内线性关系良好。
取混合对照品溶液,加超纯水逐级稀释。进样测定,求得ATP、ADP及AMP的检出限(S/N=3)分别为0.034、0.038、0.025 μg·mL-1。
2.3 准确度试验从液氮中取出心、肝、脾、肺及肾组织,各等分9份,精确称取0.3 g后置于预冷的玻璃匀浆杯中,按5 mL·g-1加入预冷的0.4 mol·L-1的高氯酸溶液,迅速置于冰浴中制成匀浆液。取已知含量的匀浆液1.0 mL,分别加入“1.5”项的混合对照品溶液适量,配制成低、中、高不同含量的标准组织样品,每个含量3份,按“1.7”项余后步骤操作处理样品并测定,计算加样回收率,结果见表 1。结果显示,各组织中的ATP、ADP、AMP的平均回收率均大于90.0%,准确度试验符合测定要求。
|
|
表 1 心、肝、脾、肺及肾组织中磷酸腺苷的加样回收率(n=9) Table 1 Recovery rates of adenosine phosphate in heart, liver, spleen, lung and kidney |
精密吸取低、中、高质量浓度(ATP为6.25、62.5、250.0 μg·mL-1,ADP为10.0、100.0、400.0 μg·mL-1,AMP为12.5、125.0、500.0 μg·mL-1)的ATP、ADP及AMP混合对照品溶液20.0 μL,分别于同1 d内连续进样6次,测定ATP、ADP及AMP的峰面积,计算日内RSD,进行日内精密度试验;另连续6 d,每天进样1次,测定ATP、ADP及AMP的峰面积,计算日间RSD,进行日间精密度试验。结果低质量浓度ATP、ADP及AMP的日内和日间精密度分别为0.91%、0.30%、0.20%和1.3%、0.58%、0.23%,中质量浓度ATP、ADP及AMP的日内及日间精密度分别为2.3%、0.17%、0.11%和1.1%、1.1%、0.17%,高质量浓度ATP、ADP及AMP的日内及日间精密度分别为1.6%、0.29%、0.15%和0.89%、0.48%、0.12%;表明其精密度良好。
2.5 稳定性试验冻融稳定性试验:从液氮中取出心、肝、脾、肺及肾组织,按“1.7”项方法制备组织供试品溶液,置于-80 ℃冷冻,24 h后于4 ℃下解冻,以拟定色谱条件进样20.0 μL;再将组织供试品溶液重新冷冻24 h后于4 ℃下解冻,以拟定色谱条件进样20.0 μL;如此重复6次,测定各组织中ATP、ADP及AMP的含量,结果心、肝、脾、肺及肾组织中ATP、ADP、AMP的RSD分别为1.1%、1.0%、0.62%,2.9%、1.7%、1.3%,3.3%、1.6%、0.66%,2.3%、1.4%、0.45%及1.6%、0.97%、0.34%,表明组织供试品溶液在此条件下稳定。
短期稳定性试验:从液氮中取出心、肝、脾、肺及肾组织,按“1.7”项方法制备组织供试品溶液,置于4 ℃冷藏2、4、6、8、10、12 h,以拟定色谱条件进样20.0 μL,测定并计算各组织中ATP、ADP及AMP的含量;结果心、肝、脾、肺及肾组织中ATP、ADP、AMP的RSD分别为0.30%、0.29%、0.18%,2.0%、1.1%、1.1%,1.3%、0.57%、0.21%,0.62%、0.66%、0.20%及1.0%、0.69%、0.22%,表明组织供试品溶液在12 h内仍稳定。
长期稳定性试验:从液氮中取出心、肝、脾、肺及肾组织,按“1.7”项方法制备组织供试品溶液,置于-80 ℃保存,分别于冻存1、2、4、6、8周后解冻,以拟定色谱条件进样20.0 μL,测定并计算各组织中ATP、ADP及AMP的含量;结果心、肝、脾、肺及肾组织中ATP、ADP、AMP的RSD分别为3.3%、2.2%、1.6%,4.2%、3.5%、2.6%,4.0%、4.2%、2.1%,3.9%、5.0%、2.2%及2.9%、4.3%、1.8%,表明组织供试品溶液在8周内仍稳定。
2.6 定量限精密吸取“1.5”项中混合对照品溶液,逐级稀释,分别进样20.0 μL,信噪比S/N=10时测得ATP、ADP及AMP的定量限分别为0.114、0.125、0.083 μg·mL-1。
取ATP、ADP及AMP的定量限浓度溶液分别于同1 d内连续进样6次,进行日内精密度试验;另连续6 d,每天进样1次,进行日间精密度试验。结果表明,ATP的日内和日间精密度分别为1.8%和2.0%,ADP的日内及日间精密度分别为1.6%和1.7%,AMP的日内及日间精密度分别为1.5%和1.8%,表明其精密度良好。
于ATP、ADP及AMP的定量限浓度溶液中分别加入不同质量浓度的混合对照品溶液,每个浓度3份,按加样回收率测定法测定,结果见表 2。结果显示,ATP、ADP、AMP的定量限的平均回收率均大于98.0%,准确度试验符合测定要求。
|
|
表 2 磷酸腺苷定量限的加样回收率(n=9) Table 2 Recovery rates of the quantitative limit of adenosine phosphate |
表 3结果显示:与空白对照组比较,模型对照组血液流变学指标均显著升高(P < 0.05)。与模型对照组比较,红花组和红花-甘草组血液流变学指标均降低,但红花-甘草组血液流变学指标的改善显著优于红花组(P < 0.05)。
|
|
表 3 大鼠血液流变学参数(x±s,n=10) Table 3 Parameters of hemorheology in rats |
表 4结果显示:与空白对照组比较,模型对照组各组织ATP、ADP及AMP含量降低(P < 0.01),表明模型对照组大鼠出现能量代谢障碍;与模型对照组比较,红花组和红花-甘草组的ATP、ADP及AMP含量均升高;红花-甘草组与红花组比较,ATP、ADP及AMP含量均升高,提示红花可以提高机体的能量代谢,红花-甘草组改善寒凝血瘀疾病的能量代谢障碍更为显著。
|
|
表 4 心、肝、脾、肺及肾组织样品中磷酸腺苷的含量测定(μg·g-1,x±s,n=10) Table 4 Determination of adenosine phosphate in heart, liver, spleen, lung and kidney tissue samples |
机体的生理功能活动需要持续的能量供给,ATP等能量物质的充分供给是维持机体正常功能和完整结构的保证。能量的产生、存储和利用一旦发生障碍,机体的功能必将受到损害。机体需要充足的血氧提供能量以维持其正常的功能,缺血使细胞氧供和氧耗之间失去平衡,引起机体缺氧,继而氧化代谢受抑制,致使高能磷酸化合物(如ATP)合成减少,细胞内乳酸堆积、H+累积,细胞功能随之发生改变,产生心脑血管疾病[13]。机体组织中ATP、ADP及AMP的含量变化直接反映了机体的能量代谢水平,是判断机体内病变或药效的一个重要指标。因此,测定正常、病理及给药情况下的组织能量代谢对心脑血管疾病的诊断、治疗及预后判定起到极其重要的作用[14]。血液高凝状态是心脑血管疾病重要的发病机制之一。血液粘稠度增高时,血流缓慢,不仅使微循环灌注减少,而且促进血栓形成,加重心绞痛,甚至诱发心肌梗死。因此,监测血液流变学指标和能量代谢物质水平有助于评估心脑血管疾病的危险程度、临床疗效及预后[15]。
本研究组以前应用NMR代谢组学技术研究发现,寒凝血瘀模型大鼠体内的葡萄糖,乳酸,丙酮酸、肌酸等水平明显增加,能量代谢紊乱[16]。Bravo[17]冷水应激大鼠发现,大鼠肝线粒体内的ATP含量明显减少。本实验研究表明,与空白对照组比较,寒凝血瘀模型大鼠的血液流变学指标均增高,心、肝、脾、肺、肾组织中的磷酸腺苷含量均明显下降,而心和肝组织中的ATP含量下降最为显著。进一步证明,寒凝血瘀证机体内能量代谢出现明显障碍。
有文献报道[18],红花黄色素可以升高Langendorff模型大鼠心室肌组织ATP含量,进而缓解心肌缺氧性损伤。徐开蕾等[19]研究红花注射液颈动脉灌注脑梗死大鼠,能明显遏制大鼠脑线粒体腺苷酸含量的降低,可显著改善因缺血、缺氧所致的脑线粒体氧化磷酸化功能下降,纠正能量代谢紊乱和减少呼吸氧耗,在一定程度上保护线粒体功能和结构的完整,从而实现对脑组织的保护作用,减轻脑梗死的损伤程度甚至再缺血的可能。吕莉等[20]报道PCr分子中含高能磷酸键,可通过Lohmann反应使ADP磷酰化形成ATP,理论上可能改善血液流变学。陈铎葆等[21]报道红花水提物等显著降低大鼠高、低切变率的全血粘度、血浆粘度和红细胞的聚集性,对血液流变学具有较强的改善作用。本研究发现,给大鼠灌服红花水提液后,红花组大鼠的血液流变学指标均低于模型对照组,磷酸腺苷含量高于模型对照组,说明,红花能通过纠正大鼠机体能量代谢紊乱,从而起到治疗或改善寒凝血瘀证的作用。
本研究还发现,给大鼠灌服后,红花-甘草组的的血液流变学指标均低于红花组,磷酸腺苷含量高于红花组。陆逸超等[22]研究甘草可以提高cAMP的含量,对心肌能量代谢有一定调节趋势,对阿霉素诱导的小鼠急性心肌损伤有一定的对抗作用。缪萍等[23]研究甘草-附子配伍和附子单用都可以有效调节心衰大鼠的心肌能量代谢紊乱,延缓慢性心衰的发展,但甘草-附子配伍比附子单用效果更好。安晓晶等[24]采用大鼠动静脉旁路血栓实验证实,红花总黄酮和甘草总黄酮均有一定抗血栓形成作用,两者联用有明显协同抗炎镇痛作用可能与其协同活血化瘀作用相关。本实验结果提示,甘草与红花配伍后,能进一步提高寒凝血瘀大鼠组织的磷酸腺苷含量,更能促进红花改善寒凝血瘀疾病的能量代谢障碍,其作用机制有待进一步深入研究和探讨。
| [1] |
毕肖林, 朱小倩, 薛穆, 等. IP-RPHPLC法检测电针后肥胖大鼠肝脏组织中ATP、ADP和AMP含量[J]. 南京中医药大学学报, 2016, 32(4): 371. BI XL, ZHU XQ, XUE M, et al. The application of IP-RPHPLC in determination of ATP, ADP and AMP in liver of the rats treated by electric acupuncture[J]. J Nanjing Univ Tradit Chin Med, 2016, 32(4): 371. |
| [2] |
CHARLES K. ATP as a cotransmitter in the autonomic nervous system[J]. Auton Neurosci, 2015, 191: 2. DOI:10.1016/j.autneu.2015.04.004 |
| [3] |
黄小平, 王蓓, 邱咏园, 等. 黄芪甲苷和三七的主要有效成分配伍对小鼠脑缺血再灌注后脑组织能量代谢的影响[J]. 中草药, 2014, 45(2): 220. HUANG XP, WANG B, QIU YY, et al. Effects of astragaloside Ⅳ with active components in Panax notoginseng on energy metabolism in brain tissues after cerebral ischemic-reperfusion in mice[J]. Chin Tradit Herb Drugs, 2014, 45(2): 220. DOI:10.7501/j.issn.0253-2670.2014.02.013 |
| [4] |
ZHOU X, TANG L, XU Y, et al. Towards a better understanding of medicinal uses of Carthamus tinctorius L. in traditional Chinese medicine:a phytochemical and pharmacological review[J]. J Ethnopharmacol, 2014, 151(1): 27. DOI:10.1016/j.jep.2013.10.050 |
| [5] |
江蔚新, 侯明阳. 红花药材中的化学成分其药理作用[J]. 黑龙江医药, 2015, 28(4): 732. JIANG WX, HOU MY. Chemical composition and pharmacologiacal action of safflower[J]. Heilongjiang Med J, 2015, 28(4): 732. |
| [6] |
WANG X, ZHANG H, CHEN L, et al. Liquorice, a unique "guide drug" of traditional Chinese medicine:a review of its role in drug interactions[J]. J Ethnopharmacol, 2013, 150(3): 781. DOI:10.1016/j.jep.2013.09.055 |
| [7] |
HOSSEIN H, MARJAN NA. Pharmacological effects of Glycyrrhiza spp. and its bioactive constituents:update and review[J]. Phytother Res, 2015, 29(12): 1868. DOI:10.1002/ptr.5487 |
| [8] |
周华妙, 郭勇. 寒凝血瘀证小鼠动物模型的建立及评价[J]. 中国中医药科技, 2010, 17(1): 1. ZHOU HM, GUO Y. Building of mice's models with blood stasis due to cold syndrome and evaluation[J]. Chin J Tradit Chin Med Sci Technol, 2010, 17(1): 1. |
| [9] |
WANG K, HU XQ, HUANG YS, et al. Effects of different directions of moxibustion therapy on hemorheology in rats with blood stasis due to cold retention[J]. J Acupunct Tuina Sci, 2016, 14(1): 10. DOI:10.1007/s11726-016-0893-7 |
| [10] |
曹振华, 尹军祥, 田金洲, 等. 源于冷刺激的血液与血管病理变化研究[J]. 北京中医药, 2009, 28(4): 308. CAO ZH, YIN JX, TIAN JZ, et al. Study on the blood and blood vessel pathological changes due to cold stimulation[J]. Beijing J Tradit Chin Med, 2009, 28(4): 308. |
| [11] |
朱成慧, 孟向文, 朴盛爱, 等. 近5年寒凝血瘀证动物模型实验研究进展[J]. 吉林中医药, 2014, 34(2): 211. ZHU CH, MENG XW, PIAO SA, et al. Progress of experimental research on the animal model of blood stasis with the syndrome of cold accumulation in recent five years[J]. Jilin J Tradit Chin Med, 2014, 34(2): 211. |
| [12] |
王鹏, 付先军, 周扬, 等. 5种温热性活血化瘀中药对寒凝血瘀证大鼠内分泌激素及5-羟色胺、去甲肾上腺素的影响[J]. 中国中西医结合杂志, 2014, 34(11): 1365. WANG P, FU XJ, ZHOU Y, et al. Effect of 5 warm-hot nature Chinese drugs for promoting blood circulation and removing blood stasis on 5-HT, NE, and endocrine hormones of rats of cold coagulation and blood stasis syndrome[J]. Chin J Integr Tradit West Med, 2014, 34(11): 1365. DOI:10.7661/CJIM.2014.11.1365 |
| [13] |
SALEM JE, SAIDEL GM, STANLEY WC, et al. Mechanistic model of myocardial energy metabolism under normal and ischemic conditions[J]. Ann Biomed Eng, 2002, 30(2): 202. DOI:10.1114/1.1454133 |
| [14] |
田岳凤, 吴富东, 王道东, 等. 高效液相色谱法测定心肌组织腺苷酸的方法和意义[J]. 中华中医药学刊, 2007, 25(1): 54. TIAN YF, WU FD, WANG DD, et al. Method and significance of determining the contents of ATP ADP and AMP in myocardial tissue with high-performance liquid chromatography(HPLC)[J]. Chin Arch Tradit Chin Med, 2007, 25(1): 54. |
| [15] |
郭慧芳, 郭志华. 丹红注射液对冠心病稳定性心绞痛患者血液流变学及炎症因子的影响[J]. 中医药导报, 2014, 20(15): 58. GUO HF, GUO ZH. Effect of Danhong injection on hemorheology and inflammatory factors in patients with coronary heart disease and angina pectoris[J]. Guid J Tradit Chin Med Pharm, 2014, 20(15): 58. |
| [16] |
XIAO CN, JIA P, WU M, et al. Cold water forced swimming stressinduced metabolic alterations in rats[J]. Anal Methods, 2014, 6(12): 4144. DOI:10.1039/c4ay00374h |
| [17] |
BRAVO C, VARGAS-SUÁREZ M, RODRÍGUEZ-ENRÍQUEZ S, et al. Metabolic changes induced by cold stress in rat liver mitochondria[J]. J Bioenerg Biomembr, 2001, 33(4): 289. DOI:10.1023/A:1010655223028 |
| [18] |
朴永哲, 金鸣, 臧宝霞, 等. 红花黄色素改善大鼠缺氧心肌能量代谢的研究[J]. 中草药, 2003, 35(5): 436. PIAO YZ, JIN M, ZANG BX, et al. Study of safflower yellow on improving energetic metabolism in hypoxic myocardium of rats[J]. Chin Tradit Herb Drugs, 2003, 35(5): 436. |
| [19] |
徐开蕾, 范华昌, 刘龙民, 等. 红花注射液颈动脉灌注治疗脑梗死的疗效及对大鼠脑线粒体影响的研究[J]. 中成药, 2010, 32(9): 1472. XU KL, FAN HC, LIU LM, et al. Therapeutic effect of injection of safflower injection on cerebral infarction and its effect on brain mitochondria in rats[J]. Chin Tradit Pat Med, 2010, 32(9): 1472. |
| [20] |
吕莉, 韩国柱, 孟璇, 等. 磷酸肌酸对大鼠血液流变学的影响及其作用机制[J]. 中成药, 2013, 22(16): 1936. LÜ L, HAN GZ, MENG X, et al. Effect of phosphocreatine on hemorheology in rats and its possible mechanism[J]. Chin Tradit Pat Med, 2013, 22(16): 1936. |
| [21] |
陈铎葆, 张雷, 孙静文, 等. 红花水提物对心肌缺血大鼠的血液流变学与血小板聚集影响的实验研究[J]. 中国中医药科技, 2004, 11(5): 290. CHEN DB, ZHANG L, SUN JW, et al. Experimental study of effects of aqueous extract of safflower on hemorheology and platelet aggregation in rats with myocardial ischemia[J]. Chin J Tradit Chin Med Sci Technol, 2004, 11(5): 290. |
| [22] |
陆逸超, 凌嘉悦, 万小敏, 等. 人参、黄芪和甘草抗阿霉素致心肌损伤的实验研究[J]. 上海中医药杂志, 2016, 50(3): 78. LU YC, LING JY, WAN XM, et al. Experimental study of ginseng, astragalus and liquorice against myocardial injury induced by adriamycin[J]. Shanghai J Tradit Chin Med, 2016, 50(3): 78. |
| [23] |
缪萍, 裘福荣, 曾金, 等. 四逆汤及其不同配伍方对心力衰竭大鼠心肌能量代谢的影响[J]. 中华中医药学刊, 2016, 34(1): 42. MIAO P, QIU FR, ZENG J, et al. Effect of Sini decoction and its components compatibility on myocardial energy metabolism in rats with heart failure induced by doxorubicin[J]. Chin Arch Tradit Chin Med, 2016, 34(1): 42. |
| [24] |
安晓晶, 王晓娜, 马成俊, 等. 红花和甘草黄酮的协同抗炎镇痛作用分析[J]. 西部中医药, 2012, 25(10): 20. AN XJ, WANG XN, MA CJ, et al. Analysisof synergistic effect on anti-inflammation and analgesia of red flower and licoflavone[J]. West J Tradit Chin Med, 2012, 25(10): 20. DOI:10.3969/j.issn.1004-6852.2012.10.007 |
 2017, Vol. 37
2017, Vol. 37 
