单克隆抗体在其复杂的生产及存储过程中能产生大量的修饰和改变,如氧化/脱酰胺[1]、糖基化[2]、C末端赖氨酸截除[3]、N末端焦谷氨酸环化[4]等,造成抗体在电荷分布方面的异质性,这些修饰对抗体活性、免疫原性及药代动力学均有影响,同时也是整个生产工艺的重要指征。因此电荷变异体是抗体质控中关注的重点,对其进行有效的质量控制是十分必要的。
目前,对抗体电荷异质性分析的常用方法有等电聚焦电泳(IEF)、离子交换色谱(IEC)[5]、毛细管区带电泳(CZE)[6]、毛细管等电聚焦电泳(CIEF)[7]和成像毛细管等电聚焦电泳(iCIEF)[8]。等电聚焦电泳(IEF)是根据抗体总的电荷差异进行分离;IEC中除了总电荷差异外,电荷的分布由于能够影响抗体与色谱柱的相互作用,也会影响电荷变异体的分离检测;CZE根据样品各组分的质荷比差异进行分离。上述方法均能对单抗样品的电荷异构体进行有效的分离,并具有各自的优势。pI是蛋白质的固有属性,通常测定方法有IEF以及CIEF和iCIEF,CIEF和iCIEF由于快速、准确、通用性强等特点,在单抗pI测定中较为常用。
由于以上常用的电荷异质性分析方法在分离机制上存在差异,对单抗异质性的分析可能会存在差异;同时,目前国内申报单位对治疗性单抗制品拟定质量控制方案时,忽略或尚未足够重视对单抗电荷异质性的有效控制。本研究通过对IEC、CZE、CIEF和iCIEF 4种常用电荷异质性分析方法进行比较研究,旨在探讨不同电荷异质性检测方法的差异及在质量控制中的重要性。
1 材料和方法 1.1 材料抗TNFα全人源单克隆抗体样品,由本室保存,置换缓冲液为20 mmol·L-1的Tris缓冲液,pH.0。
十二水磷酸氢二钠(Na2HPO4·12H2O),分析纯,购自Sigma公司。氯化钠(NaCl),分析纯,购自Sigma公司。超纯水:电阻率不低于18.2 MΩ·cm,本研究中所有溶液均用超纯水配制。
Waters公司e2695高效液相色谱仪,UV检测器。Absciex公司PA800 plus系统毛细管电泳仪,UV检测器。ProteinSimple公司iCE280系统成像毛细管等电聚焦电泳仪。Absciex公司Absciex N-CHO涂层毛细管(有效长度20 cm,内径50 μm,聚乙烯醇类涂层)。Thermo公司ProPac WCX-10色谱柱(4 mm×250 mm,固定相为羧酸盐)。GE公司3-10两性电解质。
1.2 IEC分析色谱柱:ProPac WCX-10(4 mm×250 mm,固定相:羧酸盐);流动相:A相为0.01 mol·L-1磷酸氢二钠水溶液(称取3.58 g Na2HPO4·12H2O,加水900 mL溶解,用稀磷酸溶液调节pH至7.5,纯水定容1 000 mL,用0.22 μm滤膜过滤,超声脱气后使用),B相为0.01 mol·L-1磷酸氢二钠和0.5 mol·L-1氯化钠水溶液(称取3.58 g Na2HPO4·12H2O和29.22 g NaCl,加水900 mL溶解,用稀磷酸溶液调节pH至5.5,纯水定容至1 000 mL,用0.22 μm滤膜过滤,超声脱气后使用。),洗脱梯度(0~20 min,6%B→16%B;20~22 min,16%B→100%B;22~26 min,100%B);流速:1.0mL·min-1;上样量:100 μL(1mg·mL-1);检测波长:280 nm。
1.3 CZE分析用纯水将样品稀释至0.5 mg·mL-1,6.895 kPa进样10 s,然后以40 mmol·L-1的ε-氨基己酸-0.2%的羟丙基甲基纤维素为电泳缓冲液,30 kV电压下分离15 min,检测波长214 nm,毛细管有效长度40 cm,总长50 cm,内径50 μm。
1.4 CIEF分析混合200 μL的3 mol·L-1尿素CIEF胶、12 μL的3-10两性电解质、20 μL的阴极稳定剂、2 μL的阳极稳定剂、2 μL的pI marker和10 μL的纯水稀释后的样品溶液(质量浓度5 mg·mL-1)172.375 kPa进样99 s,然后在25 kV电压下聚焦15 min,25 kV电压下化学移动30 min,检测波长280 nm,毛细管有效长度20 cm。
1.5 iCIEF分析将10 μL的纯水稀释后的样品溶液(质量浓度5 mg·mL-1)与70 μL的1%甲基纤维素、1 μL的pI marker 5.12、1 μL的pI marker 9.77、8μL的3-10两性电解质、40μL的8 mol·L-1尿素和70 μL超纯水混匀。预聚焦电压1.5 kV,持续1 min;聚焦电压3 kV,持续10 min。
1.6 理论pI计算通过抗TNFα全人源单克隆抗体一级序列,在Protein Identification and Analysis Tools on the ExPASy Server(http://web.expasy.org/compute_pi/)[9]计算其理论pI值。
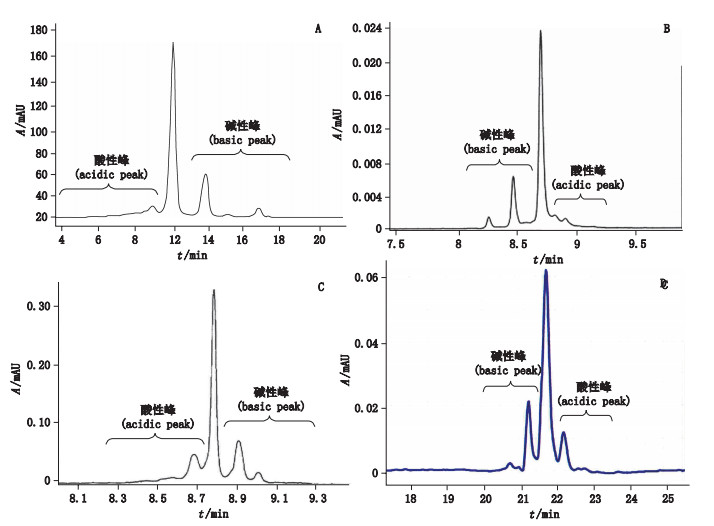
2 结果 2.1 电荷异构体比例分析用IEC、CZE、CIEF和iCIEF 4种方法分别对抗TNFα全人源单克隆抗体的电荷异质性进行了分析,结果如图 1所示,抗TNFα全人源单克隆抗体呈典型的单抗电荷异质性分布,表现为主峰及其左右两侧的酸、碱性峰。由于分离机制的差异,酸、碱性峰的出峰顺序有所不同,在IEC和iCIEF方法下,出峰顺序依次为酸性峰、主峰和碱性峰;CZE和CIEF方法下,出峰顺序依次为碱性峰、主峰和酸性峰。主峰及酸碱峰峰面积百分比见表 1和图 2。
|
A. IEC B. CZE C. iCIEF D. CIEF 图 1 抗TNFα全人源单克隆抗体电荷异质性分析图谱 Figure 1 Chromatograms of charge heterogeneity analysis of human recombinant anti-TNF α monoclonal antibody |
|
|
表 1 抗TNFα全人源单克隆抗体电荷异质性分析(mean±s,n=3) Table 1 Analysis of charge heterogeneity of human recombinant anti-TNF α monoclonal antibody |
|
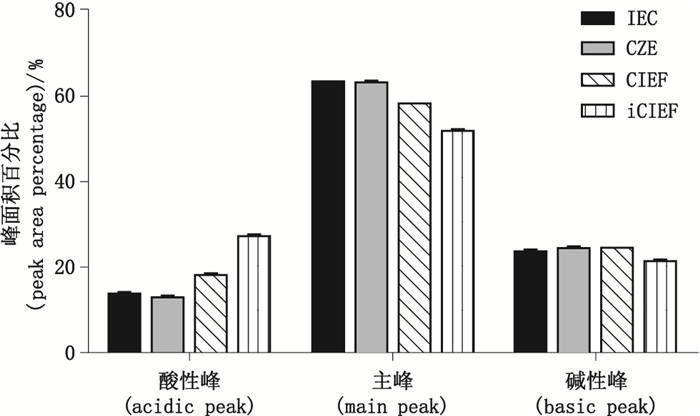
图 2 抗TNFα全人源单克隆抗体电荷异构体峰面积百分比 Figure 2 Peak area percentage of charge isomers of human recombinant anti-TNF α monoclonal antibody |
结果显示,IEC和CZE 2种方法检测的电荷异构体比例较为一致,4种方法检测的碱性峰比例较一致,CIEF和iCIEF检测的主峰与酸性峰面积比例较其他方法具有一定的差异。
2.2 主峰等电点分析利用CIEF和iCIEF 2种方法对单抗样品的主峰pI进行了检测,(CIEF条件:3-10两性电解质,聚焦15 min,pI marker分别为4.1、5.5、7.0和10.0;iCIEF条件:3-10两性电解质,聚焦10 min,pI marker分别为5.12和9.77),结果如表 2所示。2种方法检测得到的主峰pI差异较大,CIEF法的pI为8.36,iCIEF法的pI为8.99。该抗体的理论pI为8.36。
|
|
表 2 不同聚焦时间对pI值分析的影响(mean±s,%,n=3) Table 2 Analysis of pI value by different focusing times |
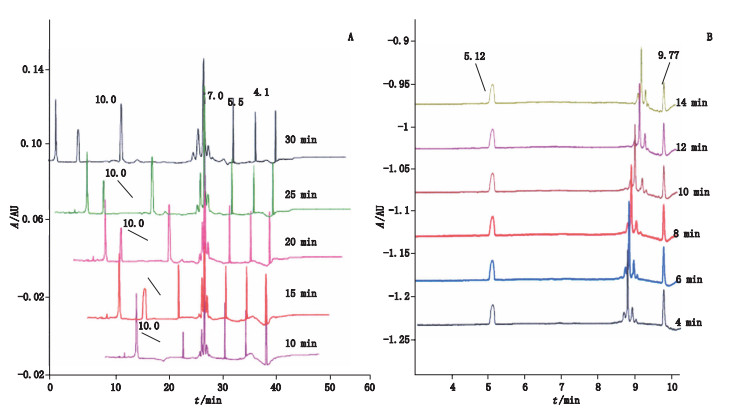
为了评价CIEF和iCIEF中主峰pI检测的影响因素,采用不同聚焦时间和选择不同的pI marker进行分析。由于2种方法聚焦条件存在差异,首先分析了在不同聚焦时间对pI测定的影响。由图 3-A和表 2可见,聚焦时间长短对pI的测定具有较大的影响。CIEF模式下随着聚焦时间的增加,毛细管内pH梯度线性减弱,R2值减小(10 min聚焦时pH线性梯度最好,但聚焦不完全,推荐采用聚焦15 min),样品主峰pI不断减小,pI marker聚焦位置向样品两端扩散。而对于iCIEF,样品主峰pI随着聚焦时间增加不断增加,2个pI marker位置较为固定(图 3-B和表 2)。
|
图 3 不同聚焦时间下CIEF(A)及iCIEF(B)分析 Figure 3 Analysis of CIEF(A) and iCIEF(B) by different focusing time |
对于不同pI marker对样品主峰pI值测定的影响,在聚焦15 min的CIEF模式下进行了分析,结果如表 3所示。当选取样品pI两端的marker进行计算时,不同pI值以及所用marker数量的选择对样品的pI值计算有一定影响,但影响不大(在约0.1 pI范围内),而pI marker均在样品一侧时,测定的样品pI值差异较大。因此,建议在pI测定时,选取样品pI两端与其pI值较接近的marker进行测定。
|
|
表 3 不同pI marker对主峰pI值计算的影响(mean±s,%,n=3) Table 3 Effect of different pI markers oncalculation of pI value of main peak |
虽然2种方法测定的pI值差异较大,但同一种方法内其测定电荷异构体比例和pI值却较稳定,因此这2种方法均适用于单抗的电荷异质性分析和鉴别(根据图谱或pI值),对于2种方法在pI值测定上的差异,将在今后进一步进行研究。
3 讨论抗体电荷异质性的分析,能够更好地保证产品的批间一致性,同时也能够发现由生产工艺的变化引起的抗体电荷分布的改变,从而对整个生产流程进行监测,并能推动对生产工艺的优化,保证抗体的安全有效性,因此在抗体质控和放行中进行电荷异质性分析十分必要。
抗体电荷异质性常规分析方法包括IEC、IEF以及CIEF和CZE。平板等点聚焦电泳法操作烦琐,分辨率比较低,定量不准确;IEC、CIEF和iCIEF具有较好的分辨率及定量优势,CIEF在抗体药物偶联物(ADC)中未偶联抗体的检测也有一定的应用[10];CZE通用性强、分析时间短,且具有相当的分离度和准确性。其中IEC [11]和CZE[12]可与MS兼容进一步对电荷异构体进行表征。上述方法由于分离机制的不同,分别从不同的角度对抗体电荷变异体进行描述[13-15]。
本研究对目前较常使用的IEC、CIEF、iCIEF和CZE 4种电荷异质性方法进行了比对分析,结果表明这些方法能够对单抗的电荷异构体进行有效分离和定量。对本研究中采用的抗TNFα全人源单克隆抗体,4种方法在电荷异构体比例和等电点测定上存在一定的差异。根据质量源于设计的理念,企业应结合产品特性和表征数据,对电荷异构体与抗体活性、免疫原性及体内药代等方面的关联进行评价,从而选择合理的分析方法、设定产品合理科学的质量标准,以保证产品的有效性和安全性。
| [1] |
YAN Y, WEI H, FU Y, et al. Isomerization and oxidationin the complementarity-determining regions of a monoclonal antibody:a study of the modification-structure-function correlations by hydrogen-deuterium exchange mass spectrometry[J]. Anal Chem, 2016, 88(4): 2041. DOI:10.1021/acs.analchem.5b02800 |
| [2] |
BATRA J, RATHORE AS. Glycosylation of monoclonal an-tibody products:current status and future prospects[J]. Biotechnol Prog, 2016, 32(5): 1091. DOI:10.1002/btpr.v32.5 |
| [3] |
LIU H, PONNIAH G, ZHANG HM, et al. In vitro and in vivo modifications of recombinant and human IgGantibodies[J]. MAbs, 2014, 6(5): 1145. DOI:10.4161/mabs.29883 |
| [4] |
BRORSON K, JIA AY. Therapeutic monoclonal antibodies and consistent ends:terminal heterogeneity, detection, and impact on quality[J]. Curr Opin Biotechnol, 2014, 30: 140. DOI:10.1016/j.copbio.2014.06.012 |
| [5] |
FEKETE S, BECK A, VEUTHEY JL, et al. Ion-exchange chromatography for the characterization of biopharmaceuticals[J]. J Pharm Biomed Anal, 2015, 113: 43. DOI:10.1016/j.jpba.2015.02.037 |
| [6] |
MORITZ B, SCHNAIBLE V, KIESSIG S, et al. Evaluation of capillary zone electrophoresis for charge heterogeneity testing of monoclonal antibodies[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015, 983-984: 101. DOI:10.1016/j.jchromb.2014.12.024 |
| [7] |
CAO J, SUN W, GONG F, et al. Charge profiling and stability testing of biosimilar by capillary isoelectric focusing[J]. Electrophoresis, 2014, 35(10): 1461. DOI:10.1002/elps.v35.10 |
| [8] |
ANDERSON CL, WANG Y, RUSTANDI RR. Applications of imaged capillary isoelectric focussing technique in development of biopharmaceutical glycoprotein-based products[J]. Electrophoresis, 2012, 33(11): 1538. DOI:10.1002/elps.201100611 |
| [9] |
WILKINS MR, GASTEIGER E, BAIROCH A, et al. Protein identification and analysis tools in the ExPASyserver[J]. Methods Mol Biol, 1999, 112: 531. |
| [10] |
LIN J, LAZAR AC. Determination of charge heterogeneity and level of unconjugated antibody by imaged cIEF[J]. Methods Mol Biol, 2013, 1045: 295. DOI:10.1007/978-1-62703-541-5 |
| [11] |
A L V A R E Z M, T R E M I N T I N G, W A N G J, et al. O n-line characterization of monoclonal antibody variants by liquid chromatography-mass spectrometry operating in a two-dimensional format[J]. Anal Biochem, 2011, 419(1): 17. DOI:10.1016/j.ab.2011.07.033 |
| [12] |
WHITMORE CD, GENNARO LA. Capillary electrophoresis-mass spectrometry methods for tryptic peptide mapping of therapeutic antibodies[J]. Electrophoresis, 2012, 33(11): 1550. DOI:10.1002/elps.201200066 |
| [13] |
REA JC, FREISTADT BS, MCDONALD D, et al. Capillary ion-exchange chromatography with nanogram sensitivity for the analysis of monoclonal antibodies[J]. J Chromatogr A, 2015, 1424: 77. DOI:10.1016/j.chroma.2015.11.002 |
| [14] |
CHEN XN, NGUYEN M, JACOBSON F, et al. Charge-based analysis of antibodies with engineered cysteines:from multiple peaks to a single main peak[J]. MAbs, 2009, 1(6): 563. DOI:10.4161/mabs.1.6.10058 |
| [15] |
HE Y, LACHER NA, HOU W, et al. Analysis of identity, charge variants, and disulfide isomers of monoclonal antibodies with capillary zone electrophoresis in an uncoated capillary column[J]. Anal Chem, 2010, 82(8): 3222. DOI:10.1021/ac9028856 |
 2017, Vol. 37
2017, Vol. 37 
