2. 浙江中医药大学基础医学院, 杭州 310053
2. College of Basic Medical Sciences, Zhejiang Chinese Medical University, Hangzhou, 310053, China
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新和多向分化潜能的细胞,在体外可向骨骼肌细胞、脂肪细胞、成骨细胞、软骨细胞分化,是细胞和组织工程的理想种子细胞[1]。MSCs动员是指应用动员剂或采用动员措施促使骨髓中的MSCs释放并迁移到外周血,参与损伤修复及组织再生等[2]。此举具有体外细胞移植修复损伤无法比拟的低创性和高效性,应用前景广阔。正常生理状态下,循环中的MSCs含量极少[3],且目前仍缺乏临床行之有效的MSCs动员措施。国内外研究者们曾采用造血干细胞动员剂动员MSCs,结果不太令人满意[4-5]。
脯氨酸羟化酶(prolyl hydroxylase,PHD)抑制剂—二甲基二乙酰基(dimethyloxaloylglycine,DMOG)是一种小分子酮戊二酸类似物,其在干细胞成骨分化、新生血管形成等过程中具有促进作用[6]。前期研究发现:缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)是MSCs动员的关键因子,在MSCs动员中起中心作用,且DMOG对MSCs具有动员作用,其可通过上调HIF-1信号通路将MSCs动员至外周血[2, 7]。而DMOG动员后的外周血间充质干细胞(peripheral blood mesenchymal stem cells,PB-MSCs)是否仍具有多向分化潜能,有待进一步研究。
本研究将通过大鼠腹腔注射DMOG,诱导MSCs动员至外周血,研究DMOG动员后PB-MSCs的多向分化潜能。研究结果将为MSCs动员剂的开发提供新的理论依据和实验基础。
1 实验动物与材料 1.1 细胞供体MSCs培养的外周血供体为健康SD大鼠,清洁级,4周龄,体重(80±10)g,雄性,由浙江中医药大学动物实验中心提供[SYXK(浙)2008-0115],来源于上海西普尔-必凯实验动物有限公司[SCXK(沪)2008-0016]。
1.2 主要试剂药品及主要试剂:DMOG(Cayman公司);DMEM/F-12培养基、LG-DMEM培养基、胎牛血清、0.25%胰酶青霉素-链霉素(Gibco公司);PBS磷酸盐缓冲剂(0.01 mol·L-1,pH=7.4)、淋巴细胞分离液(北京鼎盛生物技术公司);成脂诱导分化培养基A/B、成软骨诱导分化培养基(含TGF-β3细胞因子)套装、油红O储存液(赛业生物科技有限公司);β-巯基乙醇、β-磷酸甘油、维生素C、甲苯胺蓝染料、硝酸银(Sigma公司);地塞米松(Cayman公司)。抗体:兔抗大鼠CD34-FITC抗体、兔抗大鼠CD90-PE抗体、兔抗大鼠CD45-FITC抗体、荧光抗体同型对照、抗大鼠Nestin一抗、抗大鼠GFAP一抗(Santa Cruz公司),FITC标记二抗(联科生物公司),免疫染色洗涤液、免疫染色固定液、免疫染色分泌液、DAPI染液(达文生物公司)。
2 实验方法 2.1 细胞提取取5只雄性SD大鼠腹腔注射DMOG 40 mg·kg-1,连续给药7天,第7天后,10%水合氯醛(3.5 mL·kg-1)腹腔注射麻醉大鼠,无菌条件下,10 mL注射器从腹主动脉取血5 mL,根据密度梯度离心法用淋巴细胞分离液分离外周血单个核细胞,2 000 r·min-1离心20 min后,提取白雾层,添加白雾层5倍体积的PBS离心(1 500 r·min-1,10 min),洗涤细胞2次,最后一次离心后去掉上清,即得到外周血单个核细胞。
2.2 PB-MSCs的培养和扩增取上述的外周血单个核细胞,重悬于5 mL DMEM/F-12培养基中(含10%FBS、1%青-链霉素),接种到25 cm2的塑料培养瓶,置于37 ℃、5% CO2培养箱培养,5天后更换新鲜培养液,弃去未贴壁的细胞继续培养,以后每3天换1次液。当细胞生长接近90%融合时,按1:3比例进行传代培养,即得到外周血单个核细胞。按上述培养方法将得到的细胞培养至第4代并进行后续实验使用。
2.3 PB-MSCs的免疫表型检测将第4代外周血单个核细胞消化计数后,取5×105个·mL-1的外周血单个核细胞用PBS 100 μL重悬于流式管,同时设置异硫氰酸荧光素(fluorescein isothiocyanate,FITC)与藻红蛋白(P-phycoerythrin,PE)同型对照组,每组5管。每管细胞加入兔抗大鼠CD90-PE抗体5 μL、兔抗大鼠CD45-FITC抗体2 μL和兔抗大鼠CD34-PE抗体5 μL。室温避光条件孵育30 min后,PBS 1mL洗去未结合抗体,流式细胞仪检测CD34、CD45和CD90的表达。
2.4 PB-MSCs成骨定向分化潜能检测成骨诱导分化培养基:用LG-DMEM基础培养基配制含β-磷酸甘油10 mmol·L-1、地塞米松0.1 μmol·L-1、维生素C 50 μmol·L-1和FBS 10%的成骨诱导分化培养基,总体积1 000 mL,0.22 μm针头式滤器过滤除菌。取第4代5×105个·mL-1 PB-MSCs(“2.3”项中已鉴定),弃去旧培养基,每孔加入PBS 1 mL洗涤2次,加入成骨诱导分化培养基2 mL,置于37 ℃培养箱继续培养,以后每3天换1次成骨诱导分化培养基;14 d后,弃去成骨诱导分化培养基,用4%多聚甲醛固定30 min,硝酸银染液染色5 min,紫外照射30 min,每孔加入5%硫代硫酸钠溶液2 mL,染色2 min后用PBS 1 mL冲洗2次,倒置相差荧光显微镜下检测。
2.5 PB-MSCs成软骨定向分化潜能检测取培养的第4代PB-MSCs(“2.3”项中已鉴定)弃去旧培养基,以PBS 1 mL洗涤2次后,消化计数,以5×104个·mL-1重悬于新鲜配制的成软骨诱导分化培养基于6孔板中培养,每孔加入2 mL细胞悬液,放入37 ℃、CO2培养箱继续培养,待细胞融合接近80%后,去掉旧培养基,PBS洗涤2次,最后加入培养基套装中的TGF-β3细胞因子100 μL,6孔板置于37 ℃培养箱继续培养,以后每3天换1次成软骨诱导分化培养基,同时加入TGF-β3细胞因子100 μL。培养诱导分化21 d后,弃去诱导分化培养基,以PBS 1 mL洗涤2次,4%多聚甲醛固定60 min,甲苯胺蓝染液染色30 min,倒置相差荧光显微镜下检测。
2.6 PB-MSCs成脂定向分化潜能检测取第4代的PB-MSCs(已鉴定)弃去旧培养基,以PBS 1 mL洗涤2次后,消化计数,以1×106个·mL-1重悬于含1%青-链霉素、10%FBS的DMEM/F-12培养基中,6孔板培养细胞,每孔加入细胞悬液2 mL,置于37 ℃、CO2培养箱继续培养。待细胞融合接近90%后,弃去旧培养基,以PBS洗涤2次,每孔加入成脂诱导分化培养基A 2 mL,置于37 ℃、CO2培养箱继续培养,3 d后,换用成脂诱导分化培养基B 2 mL培养1 d后,再用成脂诱导分化培养液A 2 mL继续培养。培养基A和培养基B交替作用3~5次,继续用培养基B维持培养4~7 d,直到脂滴变得足够大、圆。随后用4%多聚甲醛500 μL固定30 min,以PBS洗涤2次后,每孔加入油红O 2 mL染色30 min,以PBS充分洗涤,倒置相差荧光显微镜下检测。
2.7 PB-MSCs成神经定向分化潜能检测成神经分化预诱导液:用LG-DMEM基础培养基配制含β-巯基乙醇1 mmol·L-1,FBS 20%的成神经定向分化培养基,总体积1 000 mL,0.22 μm针头式滤器过滤除菌。成神经分化诱导液:用LG-DMEM基础培养基配制含β-巯基乙醇5 mmol·L-1,FBS 20%的成神经定向分化培养基,总体积1 000 mL,0.22 μm针头式滤器过滤除菌。
细胞爬片制作:取第4代的PB-MSCs(已鉴定)以5×105个·mL-1重悬于含10% FBS、1%青-链霉素的DMEM/F-12培养基中,取细胞悬液200 μL滴加到盖玻片上(盖玻片置于6孔板中),放入37 ℃培养箱培养。待细胞融合接近80%后弃去培养基,每孔加入新鲜配制的神经分化预培养基2 mL培养。24 h后,弃去神经分化预诱导液,PBS充分冲洗,换用神经分化培养基2 mL继续培养6 h,并在诱导1、3、6 h时间点观察细胞状态。弃去诱导分化培养液,每孔PBS 2 mL洗涤5 min重复2次,每孔加固定液2 mL固定15 min,弃去固定液,PBS 2 mL洗涤2次,每次5 min,封闭液1 mL封闭90 min,弃去封闭液并用滤纸吸干多余液体,加入封闭液稀释50倍的巢蛋白(Nestin)或100倍的胶质纤维酸性蛋白(glial fibrillary acidic peotein,GFAP)一抗工作液1 mL,室温孵育60 min后,弃去一抗工作液,再加入稀释100倍的FITC二抗工作液1 mL室温避光孵育30 min,洗涤液洗涤2次,每次5 min,倒置相差荧光显微镜下检测。
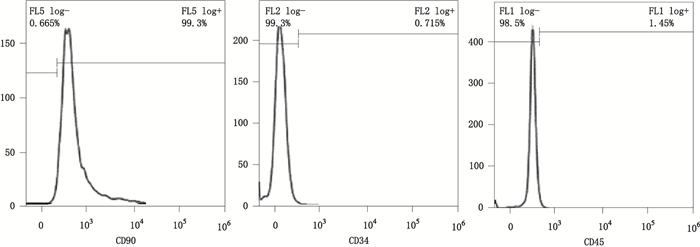
3 结果 3.1 DMOG动员后PB-MSCs的免疫表型分析通过流式细胞术检测PB-MSCs表面CD34、CD45及CD90的表达情况,结果显示PB-MSCs造血系标记CD34(0.37±0.38)%及CD45(0.20±0.10)%阴性表达,而CD90(98.50±2.18)%阳性表达(图 1)。
|
图 1 PB-MSCs表面标记物的表达结果 Figure 1 Expression results of PB-MSCs surface markers |
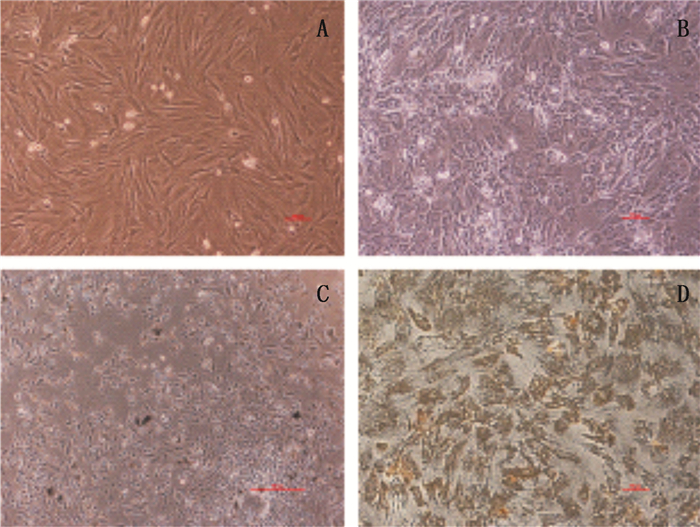
成骨诱导分化液诱导PB-MSCs 1 d后,细胞形态生长形态呈成纤维样无显著变化(图 2-A);成骨诱导PB-MSCs分化7 d后,细胞排列紧密,逐渐失去细胞结构,呈多边形状,细胞外开始有颗粒状物体分泌(图 2-B);成骨诱导PB-MSCs分化14 d后,已看不出明显的细胞形态,细胞开始融合,细胞外分泌许多钙盐,形成钙结节(图 2-C)。硝酸银染色结果发现:细胞被染成许多黑色颗粒,结果呈阳性(图 2-D)。以上结果表明:DMOG动员后的PB-MSCs具有成骨分化潜能。
|
图 2 PB-MSCs的成骨分化结果 Figure 2 Osteogenic results differentiation of PB-MSCs |
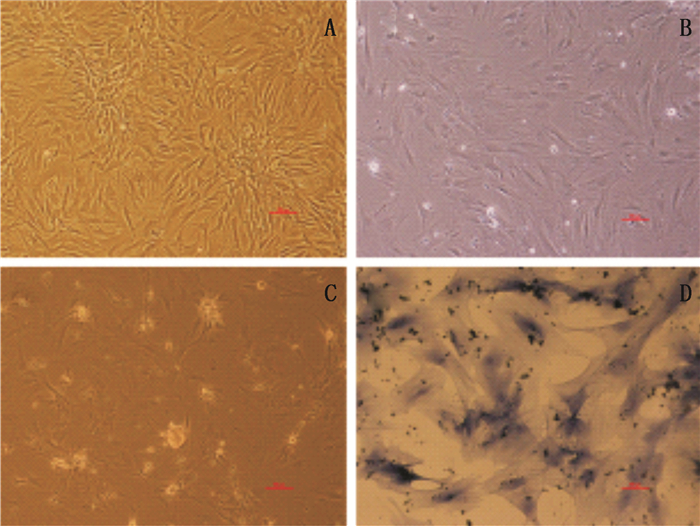
成软骨诱导分化液诱导PB-MSCs 1 d后,细胞生长形态呈成纤维样无显著变化(图 3-A);诱导PB-MSCs分化7 d后,PB-MSCs胞质开始收缩,典型的成纤维样开始消失,部分细胞变为圆形或椭圆形,细胞外有少量颗粒分泌(图 3-B);诱导PB-MSCs分化21 d后,PB-MSCs胞质进一步收缩,细胞呈不规则形态,胞质外有大量折光性基质分泌(图 3-C)。甲苯胺蓝染色发现:细胞外基质被染成紫色,细胞核被染成深蓝色(图 3-D)。通过以上结果分析得到:DMOG动员后的PB-MSCs具有成软骨分化潜能。
|
图 3 PB-MSCs的成软骨分化结果 Figure 3 Cartilage differentiation results of PB-MSCs |
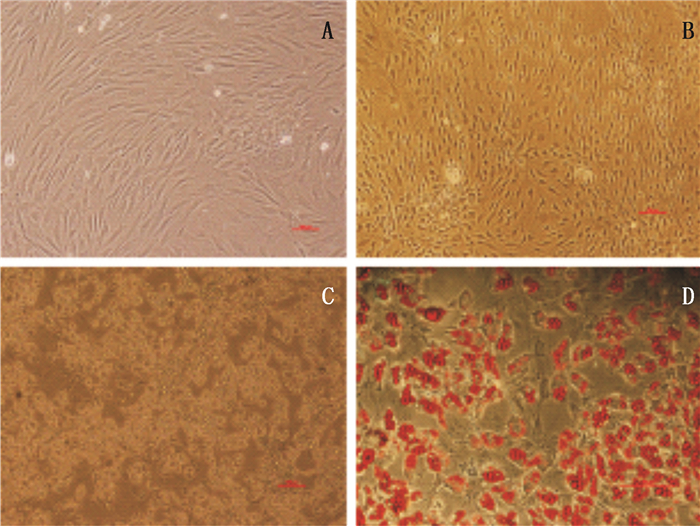
成脂诱导PB-MSCs分化1 d后,细胞生长形态呈成纤维样无显著变化(图 4-A);成脂诱导PB-MSCs分化7 d后,细胞质收缩,细胞开始变圆,典型的成纤维样开始消失,排列无序(图 4-B);成脂诱导PB-MSCs分化21 d后,胞浆中出现充满大小不一的折光性脂滴,细胞排列无序且失去细胞轮廓(图 4-C)。油红O染色发现:细胞中的脂滴均被染成红色(图 4-D)。以上结果表明:DMOG动员后的PB-MSCs具有成脂分化潜能。
|
图 4 PB-MSCs的成脂分化结果 Figure 4 Adipogenic differentiation results of PB-MSCs |
预诱导液诱导PB-MSCs 24 h后,细胞生长形态呈成纤维样无显著变化(图 5-A);诱导液诱导PB-MSCs 1 h后,细胞形态无显著变化(图 5-B);诱导液诱导PB-MSCs 3 h后,细胞形态变化明显,典型的成纤维样开始消失,细胞质开始收缩,细胞质外分泌许多圆形颗粒,部分细胞伸出长短不一的轴突(图 5-C);诱导液诱导PB-MSCs 6 h后,PB-MSCs已经失去原有的MSCs形态,细胞大小不一,大多数胞体呈圆形的核周体形态,细胞质继续收缩,周围可见折光性较强颗粒,轴突末端出现一级和二级分支,相互延伸并形成网状,呈典型的神经元样细胞(图 5-D)。免疫荧光结果发现:Nestin表达阳性(图 5-E),GFAP阴性表达(图 5-F)。以上结果表明:DMOG动员后的PB-MSCs具有成神经分化潜能。
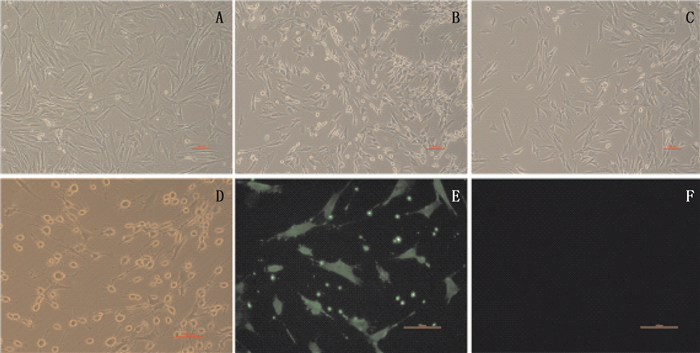
|
图 5 PB-MSCs成神经分化结果 Figure 5 Neural differentiation results of PB-MSCs. |
MSCs是干细胞家族的重要成员,在体外特定的诱导条件下,可分化为脂肪、骨、软骨、神经、肌肉、心肌、内皮等多种组织细胞,可作为理想的种子细胞用于细胞移植治疗、组织工程治疗等。前期研究发现:HIF-1α是缺氧诱导MSCs动员的关键因子,在MSCs动员过程中起中心作用[8]。而DMOG作为PHD的小分子抑制剂,通过抑制PHD的活性,而抑制HIF-1α的降解,稳定HIF-1α的表达,上调HIF-1信号通路[9-10]。前期研究证实:DMOG通过上调HIF-1α,从而调控其下游SDF-1/CXCR4通路与VEGF/VEGFR通路,从而诱导MSCs动员[2]。本研究通过探讨DMOG动员后大鼠PB-MSCs的多向分化潜能,以评价DMOG作为动员剂的可行性,为MSCs动员剂的开发提供理论基础和实验依据。
本研究依据密度梯度离心法,采用淋巴细胞分离液分离外周血单个核细胞,培养DMOG动员后的PB-MSCs。已有研究表明,MSCs不表达造血细胞的标志CD34和CD45[11],而阳性表达CD73、CD90和CD105等[12],由于缺乏高度特异性表面标志物,可联合应用多种抗体帮助鉴定MSCs,CD34、CD45和CD90是鉴定MSCs的常用标志物[13-15]。通过流式细胞术检测DMOG动员的MSCs免疫表型,结果显示MSCs造血系标记CD45(0.20±0.10)%、CD34(0.37±0.38)%为阴性表达,而CD90(98.50±2.18)%阳性表达。证明了本研究中DMOG动员后的外周血细胞是MSCs。
在多向分化方面,通过形态观测、特殊标志物检验来研究DMOG动员后的PB-MSCs的成骨、成软骨、成脂肪和成神经细胞分化的能力。结果显示,PB-MSCs成骨标志物和硝酸银染色结果均呈阳性,证实动员后的PB-MSCs具有成骨分化能力。在PB-MSCs成软骨分化中,细胞形态观察和染色结果证实诱导后的PB-MSCs是软骨细胞。在成脂方面,“脂滴”和油红O染色结果证实DMOG动员后的PB-MSCs是脂肪细胞。成神经分化常通过神经干细胞表面的标记蛋白Nestin和GFAP鉴定[16],DMOG动员后的PB-MSCs免疫荧光结果显示,Nestin阳性表达,GFAP阴性表达,表明其具有成神经分化的能力。
综上所述,脯氨酸羟化酶抑制剂DMOG动员后的大鼠PB-MSCs具有成骨、成软骨、成脂肪、成神经细胞分化的能力,进一步明确了动员剂DMOG的可行性,为其临床应用提供了一定的理论依据和实验基础,为动员剂的开发提供新路径。
| [1] |
BAI C, CHEN S, GAO Y, et al. Multi-lineage potential research of bone marrow mesenchymal stem cells from Bama miniature pig[J]. Exp Zool B Mol Dev Evol, 2015, 324(8): 671. DOI:10.1002/jez.b.22646 |
| [2] |
胡韶君, 余勤, 刘丽珍, 等. HIF-1信号通路在介导DMOG动员MSCs中的作用[J]. 中国比较医学杂志, 2015, 25(1): 9. HU SJ, YU Q, LIU LZ, et al. Mechanism of HIF-1 signaling pathway in mediating MSCs mobilization with DMOG[J]. Chin J Comp Med, 2015, 25(1): 9. |
| [3] |
MANSILLA E, MARIN GH, DRAGO H, et al. Bloodstream cells phenotypically identical to human mesenchymal bone marrow stem cells circulate in large amounts under the influence of acute large skin damage:new evidence for their use in regenerative medicine[J]. Transplant Proc, 2006, 38(3): 967. DOI:10.1016/j.transproceed.2006.02.053 |
| [4] |
PITCHFORD SC, HAHNEL MJ, JONES CP, et al. Troubleshooting:quantification of mobilization of progenitor cell subsets from bone marrow in vivo[J]. J Pharmacol Toxicol Methods, 2010, 61(2): 113. DOI:10.1016/j.vascn.2010.01.013 |
| [5] |
HE Q, WAN C, LI G, et al. Concise review:multipotent mesenchymal stromal cells in blood[J]. Stem Cells, 2007, 25(1): 69. DOI:10.1634/stemcells.2006-0335 |
| [6] |
DING H, GAO YS, WANG Y, et al. Dimethyloxaloylglycine increases the bone healing capacity of adipose-derived stem cells by promoting osteogenic differentiation and angiogenic potential[J]. Stem Cells Dev, 2014, 23(9): 990. DOI:10.1089/scd.2013.0486 |
| [7] |
刘伟, 余勤, 刘丽珍, 等. 脯氨酸羟化酶抑制剂对小鼠间充质干细胞的动员作用[J]. 浙江中医药大学学报, 2013, 37(12): 1371. LIU W, YU Q, LIU LZ, et al. Effect of prolylhydroxylase inhibitor on mobilization of mesenchymal stem cells in mice[J]. Zhejiang Chin Med Univ, 2013, 37(12): 1371. |
| [8] |
LIU LZ, YU Q, LIN J, et al. Hypoxia -Inducible Factor-1α is essential for hypoxia-induced mesenchymal stem cell mobilization into the peripheral blood[J]. Stem Cells Dev, 2011, 20(11): 1961. DOI:10.1089/scd.2010.0453 |
| [9] |
BEMHARDT WM, GOTTMANM U, DOYON F, et al. Donor treatment with a PHD-inhibitor activating HIFs prevents graft injury and prolongs survival in an allogenic kidney transplant model[J]. Proc Natl Acad Sci USA, 2009, 106(50): 21276. DOI:10.1073/pnas.0903978106 |
| [10] |
LIU XB, WANG JA, OGLE ME, et al. Prolyl hydroxylase inhibitor dimethyloxalylglycine enhances mesenchymal stem cell survival[J]. Cell Biochem, 2009, 106(5): 903. DOI:10.1002/jcb.v106:5 |
| [11] |
DE U, ALFONSO Z, ZUK PA, et al. Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from adipose tissue and bone marrow[J]. Immunol Lett, 2003, 89(2): 267. |
| [12] |
CONGET PA, MINGUELL JJ. Phenotypical and functional properties of human bone marrow mesenchymal progenitor cells[J]. Cell Physiol, 1999, 181(1): 67. DOI:10.1002/(ISSN)1097-4652 |
| [13] |
DOMINICI M, LE BK, MUELLER L, et al. Minimal criteria for defining multipotent mesenchymal stromal cells[J]. Cytotherapy, 2006, 8(4): 315. DOI:10.1080/14653240600855905 |
| [14] |
刘慧娟, 胡若愚, 戴玉娟, 等. 绿色荧光蛋白转基因大鼠骨髓间充质干细胞培养及鉴定[J]. 中国医学科学院学报, 2016, 38(1): 9. LIU HJ, HU RY, DAI YJ, et al. Culture and identification of bone marrow mesenchymal stem cells from enhanced green fluorescent protein transgenic rats[J]. Acta Acad Med Sin, 2016, 38(1): 9. |
| [15] |
HELAL MA, SHAHEEN NE, ABU Z. Immunomodulatory capacity of the local mesenchymal stem cells transplantation after severe skeletal muscle injury in female rats[J]. Immunopharmacol Immunotoxicol, 2016, 38(6): 414. DOI:10.1080/08923973.2016.1222617 |
| [16] |
JIANG MH, CAI B, TUO Y, et al. Characterization of Nestinpositive stem Leydig cells as a potential source for the treatment of testicular Leydig cell dysfunction[J]. Cell Res, 2014, 24(12): 1466. DOI:10.1038/cr.2014.149 |
 2017, Vol. 37
2017, Vol. 37 
