注射剂或注射用无菌粉末中的不溶性微粒是指药物在生产、运输、储存、应用过程中通过各种途径产生的流动性的、不溶解的污染颗粒(不含气泡),这些颗粒会造成毛细血管栓塞,诱发血管炎症,导致肉芽肿、组织坏死,甚至引发过敏反应和肺动脉高压等[1-3],严重影响到患者的用药安全,因此,需要对不溶性微粒进行严格控制。由于这些微粒直径小于100 μm,肉眼不可见,需要依靠仪器进行检测。2015年版中国药典、欧洲药典8.5版和美国药典38版均有光阻法和显微镜法2种方法,光阻法原理为当液体中的微粒通过窄小的检测区时,与液体流向垂直的入射光被微粒阻挡而减弱,使传感器输出的脉冲信号降低,这种信号的变化与微粒的截面积大小成正比并能反映微粒的大小,脉冲信号的多少能反映微粒的数量,该方法具有自动化程度较高,相对客观、省时、变异小等优势[4],目前应用更为广泛。2015年版中国药典、欧洲药典8.5版和美国药典38版均仅对≥10 μm和≥25 μm的不溶性微粒进行了限定[5-7],判定标准基本一致,即标示装量≥100 mL的静脉用注射液,每1 mL含≥10 μm的微粒数不得过25粒,≥25 μm的微粒数不得过3粒;标示装量 < 100 mL的静脉用注射液、静脉注射用无菌粉末、注射用浓溶液等,每个样品容器中含≥10 μm的微粒数不得过6 000粒,≥25 μm的微粒数不得过600粒。在光阻法检测操作中,中国药典对标示装量为25 mL及以上与25 mL以下样品的取样方式分别进行了规定,其中,对于25 mL以下的样品,可以采取单支取样、合并取样及合并后稀释取样等方法,但并未指出各取样方法的结果是否有差异及优选哪种取样方法,故本文以25 mL以下的小装量治疗性抗体为例对该问题进行探讨。
治疗性抗体具有特异性高,性质均一,可针对特定靶点定向制备,靶向性强,疗效确切等优点,被誉为“生物导弹”,在肿瘤、自身免疫性疾病、感染性疾病以及移植排斥反应中应用越来越广。由于其靶向性强,药物用量相对较少,分装体积也相对较小。按2015年版中国药典用光阻法进行不溶性微粒检测时,标示装量为25 mL以下的静脉用注射液或注射用浓溶液以及静脉注射用无菌粉末,可以单支检测,单次取样体积为适量,但并未明确规定何为适量,也可以合并至少4支使总体积至少25 mL,则单次取样体积为5 mL;而按照欧洲药典8.5版和美国药典38版,标示装量为25 mL以下的静脉用注射液,均要求合并体积至少为25 mL,单次取样体积为5 mL进行检测。由于抗体装量较小,取样体积适量不易掌握,多取可能造成吸入气泡,少取则可能代表性不足;另外,抗体制备成本较高,样品珍贵,合并体积的方法会增加样品用量,可能造成浪费,并且也会增加液-气、液-固界面的接触,加大了不溶性微粒产生的可能性以及外源性污染的机会[7]。因此,本文以体积小于25 mL的治疗性抗体为例,将单支样品不同取样体积检测与合并样品检测、合并样品不同取样体积检测以及合并样品后稀释检测与合并样品检测的结果进行比较,探讨不同取样方式是否会对治疗性抗体中不溶性微粒检测结果产生影响以及产生何种影响等进行了分析,以便得到一种相对合理的操作方式。
1 材料与方法 1.1 微粒标准物质本研究所使用的≥2 μm(货号GBW(E)120021,批号20170201)、≥10 μm(货号GBW09702,批号20161009)、≥25 μm(货号GBW(E)120027,批号20162507)微粒标准物质均购自北京海岸鸿蒙标准物质技术有限责任公司。不溶性微粒检查用水:采用MILLI-Q Millipore纯水仪制备,经孔径为0.22 μm的微孔滤膜过滤所得,经检测符合中国药典2015年版不溶性微粒检查用水的要求。
1.2 样品本研究使用了3组抗体,第1组用于比较单支样品不同取样体积与合并样品的微粒检测结果,第2组用于比较合并样品不同取样体积的微粒检测结果,第3组用于比较合并样品后稀释检测与合并样品检测的结果。3组抗体具体信息见表 1,所用抗体均为本室留样。
|
|
表 1 本研究所使用的治疗性抗体信息 Table 1 The information of therapeutic antibodiesadopted in this study |
GWJ-8智能微粒检测仪,天津天大天发科技有限公司;SG-603超净工作台,BAKER公司。
1.4 方法 1.4.1 微粒标准物质检测方法检测前用力摇100次混匀,在超净台中全部倾入取样杯中,静置脱气。检测时采用与标准物质粒径相对应的检测通道,每次取样预走体积为0.5 mL,取样体积为5 mL;每次检测进行4次取样,其中第1次结果弃去,取后续3次结果的平均值作为检测值;重复检测3次。
1.4.2 第1组样品检测方法单支样品进行不溶性微粒检查时,分别用水将容器外壁洗净,小心翻转20次,若样品为注射用无菌粉末,则在超净台中小心开启瓶盖,精密加入规定量的微粒检查用水,小心盖上瓶盖,缓缓翻转至内容物完全溶解;将室温静置脱气后的样品置于微粒仪上进行检测,检测时以手缓缓转动使溶液混匀,避免气泡产生。检测通道采用≥2μm、≥10μm与≥25μm;每次取样预走体积均为0.5 mL,各支样品的取样体积分别为0.5、1、3 mL;每次检测进行4次取样,其中第1次结果弃去,取后续3次结果的平均值作为检测值;重复检测4次。合并样品检测时,取至少4支,用水将容器外壁洗净,在超净台中开启容器合并内容物至取样杯中,使总体积不少于25 mL;每次取样预走体积为0.5 mL,取样体积为5 mL。其余操作同单支样品。
1.4.3 第2组样品检测方法取样品至少4支,按上述方法合并内容物至取样杯中,使总体积不少于50 mL,每次取样预走体积均为0.5 mL,取样体积分别为0.5、1、3、5 mL。其余操作同单支样品。
1.4.4 第3组样品检测方法取适当支数样品,在超净台中分别用不溶性微粒检查用水稀释20、10、5倍,使总体积不少于25 mL,小心翻转20次,室温静置脱气后置于微粒仪上进行检测,每次取样预走体积为0.5 mL,取样体积为5 mL;另取样品至少4支,合并内容物至取样杯中,使总体积不少于25 mL,每次取样预走体积为0.5 mL,取样体积为5 mL。其余操作同单支样品。
1.4.5 数据处理方法检测数据采用GraphPad Prism 5.0进行分析。检测结果以平均值与标准误表示,显著性差异的判定标准为P < 0.05。
2 结果 2.1 3国药典不溶性微粒检测操作比较对中国药典2015年版、欧洲药典8.5版、美国药典38版中不溶性微粒检测的操作进行比较,详见表 2。
|
|
表 2 中国药典2015年版、欧洲药典8.5版、美国药典38版中不溶性微粒检测的操作比较 Table 2 Comparison of methods for sub-visible particle testing in ChP of 2015 edition、EP 8.5 and USP 38 |
尽管3国药典对于不溶性微粒的判定标准基本一致,但从表 2可以看出,在不溶性微粒检测时,欧洲药典和美国药典对于各种剂型和装量的注射剂的取样体积均为≥5 mL,而中国药典则对 < 25 mL注射液与注射用无菌粉末则采取2种可选方案,一种为针对单支检测,取样体积适量,另一种为合并体积后检测,取样体积≥5 mL。另外,对于高粘度等样品,3国药典均给出了稀释后检测的思路,但并未给出特定的稀释方案,因此,这些取样方式都是需要进一步探讨的。
统计申请注册检验的1063批次治疗性抗体的剂型和标示装量发现,≥25 mL注射液仅为22批次,占2.1%,而 < 25 mL注射液或注射用无菌粉末则为1041批次,占97.9%,其中≤2 mL注射液为266批次,占25.0%,且这部分抗体的浓度一般较高,粘度也较大,可见,< 25 mL注射液或注射用无菌粉末为绝大多数,这些抗体都存在着选择适当取样方式的问题,而各企业在对这些抗体进行检测时,出于不同考虑,采用的取样体积为0.5~5 mL不等,取样方式也各不相同,因此,本研究对不同取样方式是否会对微粒检测结果产生显著影响以及会产生何种影响进行了考察。
2.2 微粒标准物质检测本研究中所采用的检测通道包括了3国药典中要求的≥10 μm与≥25 μm通道,以及其中未要求的≥2μm通道,因此,也采用相应的微粒标准物质对仪器的状态和方法的准确性进行了验证,结果见表 3。可见与示值相比,3种微粒标准物质的检测相对误差均在±2.5%以内,说明仪器状态良好,检测结果可信。
|
|
表 3 微粒标准物质检测结果 Table 3 Testing results of standard particles |
对第1组样品中的不溶性微粒,分别比较了单支检测取样体积为0.5、1、3 mL的结果与合并样品取样体积为5 mL的结果,见图 1。对于≥2 μm、≥10 μm、≥25 μm 3个检测通道,配对t检验均显示,5 mL组与相应的0.5、1、3 mL组检测结果无显著差异,说明在实际检测过程中,单支样品检测方式与合并样品检测方式均可供选用,且单支样品的检测体积可以根据实际情况进行选择。另外,由于各粒径的微粒在检测体系中处于一种“聚集-解离”的动态平衡,大粒径微粒由小粒径微粒聚集而成,所以粒径越小,微粒数越多,结果一致性越好,从图 1中也可看出这种趋势,即≥2μm微粒数量要远远超过≥10 μm、≥25 μm微粒数量,且≥ 2μm微粒不同取样体积的检测结果一致性更好。
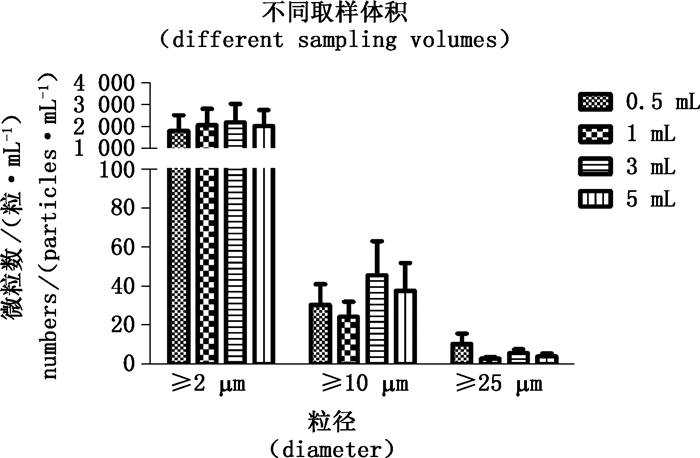
|
图 1 单支样品不同取样体积检测与合并样品检测结果 Figure 1 Testing results of separate dose with different sampling volumes and combined doses |
对第2组样品不溶性微粒的检测方法采用合并样品后检测,结果见图 2。与第1组样品的结果类似,对于≥2 μm、≥10 μm、≥25 μm 3个检测通道,配对t检验显示,5 mL组均与相应的0.5、1、3 mL组检测结果无显著差异,说明合并样品后取样体积对检测结果无统计学意义上的影响。尽管3国药典中要求合并样品后体积需要达到25 mL,且每次取样体积为5 mL以便使结果更具有代表性,但对于小装量抗体而言,该结果提示了减少样品用量和取样体积的可能性。此外,与≥10 μm、≥25 μm微粒相比,≥2 μm微粒不同取样体积的检测结果一致性更好。

|
图 2 合并样品不同取样体积检测结果 Figure 2 Testing results of combined doses with different sampling volumes |
考虑到有些抗体药物的装量很小,浓度较高,粘度较大,并且3国药典中均给出了稀释检测的方法,因此,将体积≤2 mL的第3组样品进行了合并后稀释检测与合并后原倍检测,并对其检测结果进行比较,以评价该检测方式的优劣。图 3显示的是将检测结果还原为原倍后的不溶性微粒数,可见,对于≥2μm、≥10μm、≥25μm 3个检测通道,原倍检测结果均低于稀释检测的结果;配对t检验显示,原倍检测结果与20、10、5倍稀释的检测结果均具有显著性差异;并且,稀释倍数越大,计算所得的不溶性微粒数值越高。这些结果说明稀释检测与原倍检测是有统计学差异的,尽管3国药典中均提示可以采用该种检测方式,但在实际应用时需对该方式进行全面评估和验证。

|
图 3 样品合并后稀释检测与合并检测结果 Figure 3 Testing results of combined doses with different dilutions and combined doses |
本研究首次对治疗性抗体,尤其是小装量抗体不溶性微粒的不同检测方式进行了考察,以针对19个靶点的65个批次抗体为例,分3组分别对单支样品不同取样体积检测与合并样品检测、合并样品不同取样体积检测以及合并样品后稀释检测与合并样品检测的结果进行比较;结果发现,不管是采用单支样品不同取样体积还是合并样品后不同取样体积,与合并样品后每次取样5 mL的不溶性微粒检测结果相比,均没有统计学意义上的差异,说明针对小装量抗体而言,不管采用单支取样,还是合并取样,也不管取样体积是否达到5 mL,只要操作规范,便能得到相对可信的结果。这对单支抗体来说,可以降低因追求取样体积最大化而吸入气泡的风险;对于合并样品的方式来说,也能节省样品用量,并减少因液-气、液-固界面接触而引入不溶性微粒的可能性。而合并样品后稀释检测的结果则与合并样品检测的结果具有统计学差异,且稀释后的结果要高于未稀释的结果,稀释倍数越大,与未稀释结果的差异也越大,说明采用合并样品后稀释的检测方式时应对稀释方案进行全面评估并慎重选择。
抗体中的蛋白聚体是微粒的主要内源性来源,它的产生是一个从寡聚到多聚,体积从小到大的动态变化过程[8-11],因此,小体积的微粒占绝大多数。尽管3国药典目前对 < 10 μm的微粒未作限定,但已有多项研究表明,< 10 μm的微粒数远大于≥10 μm的微粒数,加上人体毛细血管内径仅为4~7 μm,而只有小于2 μm的微粒才能从肾脏排出,因此,危害性更大的为2~10 μm的微粒;目前,已有企业对产品中的这部分微粒进行了关注与监测,未来对不溶性微粒的控制也会更加细化[12]。鉴于上述原因,本研究除了检测3国药典中规定的≥10 μm、≥25 μm的微粒,还检测了≥2 μm的微粒,检测结果也证实其数量远远大于≥10 μm、≥25 μm微粒的数量;对于本研究中所探讨的不同取样体积,≥2 μm微粒的结果与≥10 μm、≥25 μm微粒是一致的,不同的是,≥2 μm微粒不同取样体积的结果与≥10 μm、≥25 μm微粒相比更趋于一致,由此可见,影响取样体积变异的主要因素是微粒的粒径大小。
对于合并样品后稀释检测的方式,3国药典并未对稀释液和稀释倍数进行具体规定,本研究在稀释样品时均使用微粒检查用水。稀释后因体系变大,浓度降低,使不同粒径的不溶性微粒在“结合-解离”的动态变化中更趋向于解离,一个微粒解离为多个微粒,导致最终结果偏高;并且稀释倍数越高,该现象越明显。当然,如果样品缓冲体系的抗稀释能力比较好,或者稀释样品时使用制剂缓冲液以及其他适宜溶剂,并采取低倍稀释等方案,则该种差异可能会大大减少[13];因此,若要采用合并样品后稀释检测的方式,这些因素都需要一一验证。此外,针对高粘度高浊度的小装量样品,如果光阻法不易准确检测,也可考虑采用取样体积小的微流数字成像技术等对其不溶性微粒进行检测与控制[14]。
本研究中样品溶解,翻转混匀,合并体积等操作均应在超净工作台中小心缓慢进行,以避免外源微粒的引入,如果不加注意,很有可能出现不可解释的结果。此外,抗体的本质是蛋白质,在复溶或混匀的过程中都会不可避免地产生气泡,因此需要静置适当时间来脱气,但不可超声脱气,以避免蛋白结构发生断裂等改变而造成结果异常[15]。因此,应重视试验过程中的操作细节,避免外源因素导致的异常结果。
尽管本研究所采用的抗体靶点较广泛,不但包括五大常规抗体,也包括BLYS、PD-1、PD-L1、α4β7等新靶点抗体;纳入的抗体种类也较多样,包括完整免疫球蛋白,以及免疫球蛋白片段、融合蛋白、抗体偶联药物、双特异性抗体等,但特定的抗体有其特定的质量属性,本文的结果也可能并不适用于所有抗体。本研究以所测样本为例,提供了一种思路和可能性,旨在提示研发单位在对不溶性微粒进行考察时,有必要根据不同的样品、不同的微粒粒径、可接受的取样体积、不同的稀释方案等确定如何对检测方式进行充分验证和合理选择,从而达到对抗体不溶性微粒进行监测和控制的目的。
| [1] |
KOTAREK J, STUART C, DE PAOLI SH, et al. Sub-visible particle content, formulation, and dose of an erythropoietin peptide mimetic product are associated with severe adverse postmarketing events[J]. J Pharm Sci, 2016, 105(3): 1023. DOI:10.1016/S0022-3549(15)00180-X |
| [2] |
ROSENBERG AS. Effects of protein aggregates:an immunologic perspective[J]. AAPS J, 2006, 8(3): E501. DOI:10.1208/aapsj080359 |
| [3] |
CROMWELL ME, HILARIO E, JACOBSON F. Protein aggregation and bioprocessing[J]. AAPS J, 2006, 8(3): E572. DOI:10.1208/aapsj080366 |
| [4] |
陈如柳, 曲丹丹, 付斌. 光阻法对注射液不溶性微粒检测的准确性影响因素探讨[J]. 天津药学, 2014, 26(5): 76. CHEN RL, QU DD, FU B. Factors affecting accuracy of lightblockage detection of insoluble particles in injections[J]. Tianjin Pharm, 2014, 26(5): 76. |
| [5] |
中国药典2015年版. 三部[S]. 2015: 通则0903 ChP 2015 Vol Ⅲ[S]. 2015:General Rule 0903 |
| [6] |
EP 8. 5[S]. 2014:Methods of Analysis 2. 9. 19
|
| [7] |
USP 38-NF 33[S]. 2015:Physical Tests<788>
|
| [8] |
THIRUMANGALATHU R, KRISHNAN S, RICCI MS, et al. Silicone oil and agitation induced aggregation of a monoclonal antibody in aqueous solution[J]. J Pharm Sci, 2009, 98(9): 3167. DOI:10.1002/jps.21719 |
| [9] |
李萌, 于传飞, 王兰, 等. 重组单抗药物质控中物理检查的有关问题探讨[J]. 药物分析杂志, 2015, 35(11): 169. LI M, YU CF, WANG L, et al. Discussion on issues related to physical tests in quality control of Mabs[J]. Chin J Pharm Anal, 2015, 35(11): 169. |
| [10] |
CARPENTER JF, RANDOLPH TW, JISKOOT W, et al. Overlooking subvisible particles in therapeutic protein products:gaps that may compromise product quality[J]. J Pharm Sci, 2009, 98(4): 1201. DOI:10.1002/jps.21530 |
| [11] |
JOUBERT MK, HOKOM M, EAKIN C, et al. Highly aggregated antibody therapeutics can enhance the in vitro innate and late-stage T-cell immune responses[J]. J Biol Chem, 2012, 287(30): 25266. DOI:10.1074/jbc.M111.330902 |
| [12] |
JNARHI LO, CORVARI V, RIPPLE DC, et al. Subvisible(2-100μm)particle analysis during biotherapeutic drug product development:Part 1, considerations and strategy[J]. J Pharm Sci, 2015, 104(6): 1899. DOI:10.1002/jps.24437 |
| [13] |
MANNING MC, CHOU DK, MURPHY BM, et al. Stability of protein pharmaceuticals:an update, considerations and strategy[J]. Pharm Res, 2010, 27(4): 544. DOI:10.1007/s11095-009-0045-6 |
| [14] |
WERK T, VOLKIN DB, MAHLER HC, et al. Effect of solution properties on the counting and sizing of subvisible particle standards as measured by light obscuration and digital imaging methods[J]. Eur J Pharm Sci, 2014, 12(53): 95. |
| [15] |
王敏力, 肖林, 侯继峰. 人血白蛋白中不溶性微粒的检测及制品质量考察趋势分析[J]. 药物分析杂志, 2012, 32(4): 725. WANG ML, XIAO L, HOU JF. Quality investigation of human albumin and analysis tendency of content insoluble particles[J]. Chin J Pharm Anal, 2012, 32(4): 725. |
 2017, Vol. 37
2017, Vol. 37 
