2. 奥克胜美生物科技有限公司, 北京 100085
2. OnkoRx Ltd., Beijing 100085, China
胃泌素(gastrins)是由胃窦与十二指肠黏膜G细胞分泌的多肽类激素,1906年由英国学者Edkins发现并命名[1]。胃泌素的翻译后加工是一个典型的由前激素原加工成激素原,再由激素原加工成具有不同作用的生物活性体过程,其种类包括酰胺化胃泌素34、甘氨酸延伸型胃泌素34、酰胺化胃泌素17、甘氨酸延伸型胃泌素17、胃泌素原,其中酰胺化胃泌素为主要产物。正常情况下,胃泌素通过结合相应受体发挥促进胃酸分泌与胃肠道粘膜生长作用;而胃泌素过量表达及种类失衡情况下,其可通过自分泌、旁分泌或内分泌方式导致多种肿瘤(包括胃癌、肠癌、胰腺癌、食管癌等)的发生发展,该分子日益得到相关研究者的重视并已成为治疗相关肿瘤的靶点。本文围绕胃泌素的表达、胃泌素表达的调节、胃泌素的作用、胃泌素的促瘤机制进行综述,以期为研究者进行相关研究与开发提供参考。
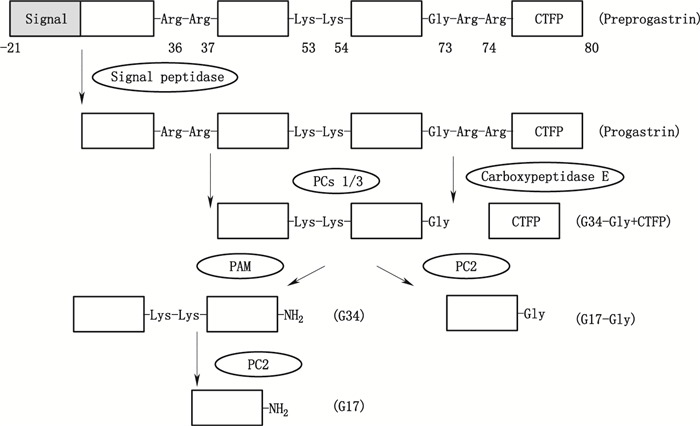
1 胃泌素的表达所有哺乳动物的胃泌素基因均包含3个外显子,人类胃泌素基因是单拷贝基因,位于染色体17q23区,全长4.1 kb。G细胞转录产生单一且长度为0.7 kb的胃泌素mRNA,在粗面内质网中翻译生成含101个氨基酸残基的前胃泌素原(preprogastrin)。
胃泌素翻译后加工是一个典型的由前激素原加工成激素原,再由激素原加工成具有不同作用的生物活性体过程(见图 1)[2]。核糖体上翻译的多肽(即前胃泌素原)带有N末端信号肽,进入内质网后N端信号肽剪去21个氨基酸残基形成含80个氨基酸的胃泌素原(progastrin,proG)[3-4]。
胃泌素原进入分泌小泡后经肽酶、羧肽酶(carboxypeptidase E)的作用迅速发生剪切,该剪切作用由激素原转换酶(prohormone convertases,PCs)的差异化表达进行修饰,并通过调整分泌小泡的内环境(如pH)进行;剪切后羧肽酶随即移除C末端氨基酸残基(the 6-amino acid C-terminal flanking peptide of progastrin,CTFP),释放C末端甘氨酸延伸型胃泌素,其剪切产物主要为甘氨酸延伸型胃泌素34(glycine-extend gastrin 34,gly-G34)[3, 5]。
gly-G34既可切去C末端多肽成为甘氨酸延伸型胃泌素17(glycine-extend gastrin 17,gly-G17),也可经C末端甘氨酸酰胺化反应转变为酰胺化胃泌素34(amidated gastrin 34,amidated-G34),胃泌素酰胺化反应经肽基α酰胺化单氧酶(peptidyl α-amidating nomo-oxygenase,PAM)催化分两步进行,首先在氧、铜、抗坏血酸盐的参与下单氧酶催化产生C末端甘氨酸中间体,然后该中间体经酶的裂解作用转变为C末端酰胺化合物;对amidated-G34的赖氨酸-赖氨酸(Lys-Lys)连接处进行剪切可形成酰胺化胃泌素17(amidated gastrin 17,amidated-G17)[5]。
酰胺化胃泌素称为经典或成熟胃泌素,胃泌素原与甘氨酸延伸型胃泌素称为胃泌素中间体[6]。人G细胞中95%的胃泌素产物为酰胺化胃泌素(其中85%~90%为amidated-G17,5%~10%为amidated-G34),其余5%为胃泌素中间体[2],成年哺乳动物其胃泌素主要表达于胃幽门窦部的G细胞,在某些情况下可表达于胰岛β细胞、结肠及结直肠肿瘤细胞,还可低水平表达于脑下垂体与睾丸[5, 7]。
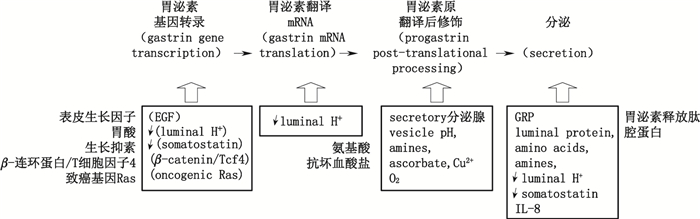
2 胃泌素表达的调节胃泌素表达(包括转录、翻译、翻译后加工、分泌)受胃酸、胃泌素释放肽(gastrin releasing peptide,GRP)、氨基酸、激素等多种因素的调节(见图 2)[5]。如胃酸可通过促进分泌生长抑素(somatostatin)来抑制胃泌素的转录;由粘膜神经纤维分泌的GRP则可在G细胞中引起钙离子依赖的胃泌素胞外分泌;氨基酸(特别是芳香族氨基酸)、钙均能刺激胃泌素的分泌;激素也可影响胃泌素基因的表达,如表皮生长因子(epithelial growth factor,EGF)可主要通过有丝分裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)激活Sp1激酶,Sp1激酶使转录因子磷酸化后与EGF胃泌素反应元件(gastrin EGF response element,gERE)结合而产生促胃泌素基因转录作用;一些比较独特的顺式作用原件,如与Sp1连接的GC富集原件可通过调节EGF来促进胃泌素基因的表达;结直肠肿瘤中,因致癌基因Ras突变通过激活Ras-Raf-Mek-MAP激酶进而促进胃泌素基因转录。
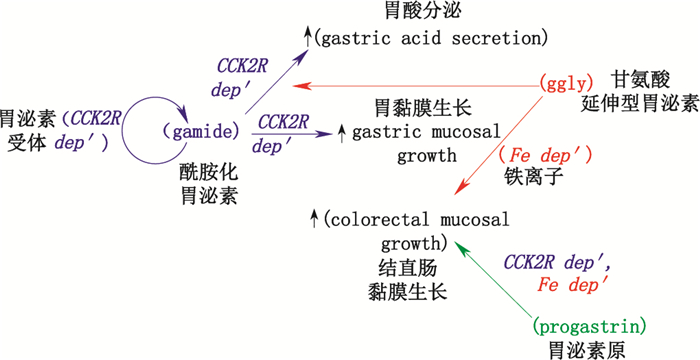
3 胃泌素的作用 3.1 正常情况下,可促进胃酸分泌与胃肠道粘膜细胞生长前胃泌素原产生的多种胃泌素具有各自不同的生物活性(见图 3)[8]。正常情况下由酰氨化胃泌素通过内分泌方式发挥促进胃酸分泌与胃黏膜细胞生长作用[5],其主要通过与肠嗜铬样细胞(enterochromaffin-like cells,ECL)上的CCK-B受体(cholecystokinin B receptors,CCKBR)结合,促进相关基因表达(特别是组胺合成与储存相关基因)与组胺分泌,再由组胺刺激壁细胞分泌胃酸;胃泌素也能与壁细胞上的CCK-B受体结合,通过引起壁细胞内Ca2+浓度的改变促进胃酸分泌;同时胃泌素还可调节对壁细胞功能起重要作用蛋白的基因表达,使壁细胞自分泌转化生长蛋白等肽类物质。
酰胺化胃泌素通过结合CCK-B受体调节上皮组织不同类型细胞的比例与壁细胞的成熟,促进胃粘膜细胞生长[5]。如Dockray等发现剔除小鼠中编码胃泌素基因或CCK-B受体基因后,2种情况下小鼠壁细胞与肠嗜铬样细胞的数量均减少。酰胺化胃泌素还可通过结合CCK-B受体活化丝裂原蛋白激酶促进胃泌素基因表达。
甘氨酸延伸型胃泌素不是胃酸促分泌素,不能刺激胃酸的分泌,其作为壁细胞功能调节因子可调节壁细胞对胃酸促分泌素的反应能力,提高酰胺化胃泌素促进胃酸分泌的能力[9];参与壁细胞的成熟与分化,促进壁细胞的成熟与迁移;通过活化酪氨酸激酶促进壁细胞质子泵α亚单位的表达。胃泌素原与甘氨酸延伸型胃泌素的作用靶点主要位于结直肠,作为结直肠的生长因子促进结直肠细胞生长,如胃泌素缺陷型转基因鼠结肠粘膜增生降低,输注甘氨酸延伸型胃泌素可改善结肠粘膜的低增生状态,输注酰胺化胃泌素却无效[10]。
此外,胃泌素可作为肠促胰岛素发挥降血糖作用,还具有促进血细胞生成作用。如Fosgerau等[11]研究发现胃泌素与胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)合用控制糖尿病鼠血糖的效果要显著好于单用GLP-1时的效果;Kovac等[12]研究报道铁元素缺乏情况下,胃泌素缺陷型小鼠可出现严重贫血。
酰胺化胃泌素的C末端氨基酸对其生物活性至关重要,如移除酰胺化胃泌素的C末端氨基酸可致其完全丧失经CCK-B受体介导的促进胃酸分泌作用。铁离子的结合对于非酰胺化胃泌素(胃泌素原、甘氨酸延伸型胃泌素)的体内外生物活性有重要作用,甘氨酸延伸型胃泌素中谷氨酸7为第1个铁离子结合位点,谷氨酸8和9为第2个铁离子结合位点,铁离子螯合剂可抑制甘氨酸延伸型胃泌素的生物活性[8]。如GglyE7A变异物,因其铁离子结合部位已破坏而丧失生物活性[13];Ferrand等[14]研究报道铁离子螯合剂去铁胺(desferrioxamine)可阻断胃泌素原、甘氨酸延伸型胃泌素的促结直肠黏膜增殖作用。
3.2 胃泌素与疾病关系过量分泌情况下,胃泌素可通过自分泌、旁分泌或内分泌方式导致多种肿瘤(包括肠癌、胃癌、胰腺癌、食管癌等)的发生发展。
3.2.1 胃泌素与结直肠肿瘤正常情况下,胃泌素原与甘氨酸延伸型胃泌素具有促进结直肠粘膜生长作用,分泌异常情况下它们与结直肠肿瘤的发生发展密切相关[15]。如Ciccotosto等[16]发现无论幽门螺旋杆菌阳性还是阴性的结肠肿瘤患者,胃泌素原的检出率为100%,甘氨酸延伸型胃泌素的检出率为44%,酰胺化胃泌素的检出率为69%,患者体内非酰胺化胃泌素含量比例显著增加,酰胺化胃泌素含量比例相对降低;Van Solinge等[17]研究发现结直肠癌表达胃泌素原的量显著高于正常结直肠粘膜;Paterson等[18]发现外周血胃泌素浓度升高会增加病人患结直肠癌的风险;其余多项研究表明非酰胺化胃泌素可加速结直肠癌的发展。
体内实验通过建立仅分泌胃泌素原与甘氨酸延伸型胃泌素转基因小鼠发现其结肠厚度增加,经致癌物氧化偶氮甲烷诱导可诱发结肠癌,且有些小鼠肺部可发生支气管肺泡癌[19]。
体外实验也表明胃泌素可发挥促进结肠癌细胞系(如LoVo、HT29、YAMC、DLD-1、Colo32、HCT116)增殖、迁移、抗凋亡等多种促瘤作用。如Stepan等[20]研究发现甘氨酸延伸型胃泌素可通过结合非CCK-B受体激活Jun激酶促进结肠癌细胞系LoVo、HT29的增殖;Kermorgant等[21]研究发现甘氨酸延伸型胃泌素可促进人结肠癌细胞系LoVo的侵袭与迁移;Hollande等[22]研究发现甘氨酸延伸型胃泌素可促进鼠结肠癌细胞系YAMC的增殖与迁移;Westwood等[23]研究发现非酰胺化胃泌素可以抵抗低氧所引起人结肠癌细胞系LoVo的凋亡;Ellrichmann等[24]研究发现amidated-G17可通过结合CCK-B受体促进人结肠癌细胞系LoVo中VEGF-A基因与蛋白的表达进而发挥促瘤作用;Watson等[25]研究报道amidated-G17可促进人结肠癌细胞系HT29的增殖;Masia-Balague等[26]研究发现胃泌素可通过激活Gα13依赖的ArhGEF28蛋白进而促进人结肠癌细胞系DLD-1的发展;Singh等[27]研究发现胃泌素基因的表达在结肠癌细胞系(Colo32、HCT116)的增殖与致瘤中具有重要作用。
3.2.2 胃泌素与胃肿瘤胃泌素也与胃肿瘤的发生发展密切相关[28-29]。如Goetze等对20例胃腺癌病人肿瘤中酰胺化胃泌素与胃泌素受体的表达情况进行研究,发现酰胺化胃泌素的表达率为80%,胃泌素受体表达率为100%[30];Sun等[31]研究发现随胃癌发生,人体内血清胃泌素17浓度会显著升高;Huang等[32]也发现随胃癌进展,胃泌素及其受体的蛋白表达呈递增趋势。
体内实验表明过量表达胃泌素的转基因小鼠中过量分泌的酰胺化胃泌素可促进胃与结肠上皮增殖,小鼠患胃泌素血症持续近20个月后会有发生胃癌的倾向,幽门螺旋杆菌感染会加速该倾向,一般在6~8个月左右发生胃癌[33]。
体外实验也表明胃泌素可发挥促进胃癌细胞系(如AGS-P/AGSE/AGS、SGC7901、MKN45/MKN45G、ST16)增殖、迁移、抗凋亡等多种促瘤作用。如Ishizuka等[34]发现amidated-G17可通过结合人胃癌细胞系AGS-P上的胃泌素受体增加细胞内钙离子浓度进而促进细胞增殖;Mishra等[35]研究发现amidated-G17可通过结合CCK-B受体,激活混合谱系激酶3/c-Jun蛋白氨基末端激酶1[(mixed lineage kinase-3,MLK3)/(c-Jun-NH2-terminal kinase-1,JNK1)]通路,发挥促进人胃癌细胞系AGSE的迁移作用;Patel等[36]研究发现胃泌素原可经PI3K依赖途径抵抗人胃癌细胞系AGS的凋亡;Xu等[37]研究报道amidated-G17可通过结合CCK-B受体,激活JAK1/STAT3/PI3K通路,上调环氧化酶-2(cyclooxygenase-2,COX-2)表达,发挥促进胃癌细胞系SGC7901、MKN45的增殖作用[37];人胃癌细胞系MKN45G、ST16可分别通过自分泌/旁分泌、内分泌胃泌素促进自身生长[25]。
3.2.3 胃泌素与其他肿瘤(胰腺癌、食管癌、肺癌)体内实验通过建立胰腺部位过量表达胃泌素与CCK-B受体的转基因小鼠发现过量酰胺化胃泌素可使其后代胰腺分泌管道发育不良且增加胰腺的纤维化[38]。
体外实验也表明胃泌素可发挥促进其他多种肿瘤[如胰腺癌(AR42J、Panc-1、PAN1、BXPC3)、肝癌(PLC/PRF/5)、食管癌(OE33)、脑垂体癌细胞系(GH3)、小细胞肺癌与非小细胞肺癌]增殖、粘附、抗凋亡等作用[39]。如Caplin等[40]研究报道amidated-G17、gly-G17可显著促进胰腺癌细胞系AR42J的增殖,gly-G17可显著促进肝癌细胞系PLC/PRF/5的增殖;Cayrol等[41]研究报道酰胺化胃泌素可通过结合CCK-B受体激活αV整合素进而促进人胰腺癌细胞系Panc-1的粘附;胃泌素还可促进人胰腺癌细胞系PAN1、BXPC3的抗凋亡,并降低其对化疗药的敏感性[42];甘氨酸延伸型胃泌素也可以促进食管腺癌细胞系OE33的抗凋亡[43];Xu等[44]研究报道胃泌素可通过自分泌或旁分泌作用方式结合CCK-B受体促进脑垂体癌细胞系GH3的生长。
小细胞肺癌(small cell lung carcinoma,SCLC)占肺癌总数的15%~25%并具有较强的恶化倾向[45],包括酰胺化胃泌素、甘氨酸延伸型胃泌素、胆囊收缩素(cholecystokinin,CCK)在内的多种神经肽可通过自分泌或旁分泌方式结合CCK-B受体促进SCLC细胞系(如GLC19)的生长[3]。非小细胞肺癌细胞系中,酰胺化胃泌素、CCK、未硫酸化CCK-8可通过增加细胞内钙离子浓度促进细胞增殖,特异性CCK-B受体拮抗剂L365260可阻断该增殖作用[46]。
4 胃泌素的促瘤机制 4.1 胃泌素结合的受体种类胃泌素至少可与4类受体结合发挥作用,其中能与其结合的主要受体为胆囊收缩素受体(cholecystokinin receptors,CCK-R),CCK-R结合胃泌素的作用方式有2种,一种为细胞外环路,即胃泌素分泌至细胞外,结合细胞表面CCK-R进而发挥生物效应;另一种为细胞内环路,即细胞内胃泌素与胞内受体结合;CCK-R包括3类,即CCK-AR、CCK-BR、CCK-CR。
经典的CCK-R为CCK-AR、CCK-BR,其同属于具有7个跨膜区的G蛋白偶联受体超家族,各自氨基酸序列有50%的差异,能被不同的拮抗剂识别[47]。CCK-AR主要位于胰腺腺泡细胞核胆囊平滑肌细胞,其对硫酸化CCK的亲和力要比硫酸化胃泌素或非硫酸化CCK高500~1 000倍[7]。
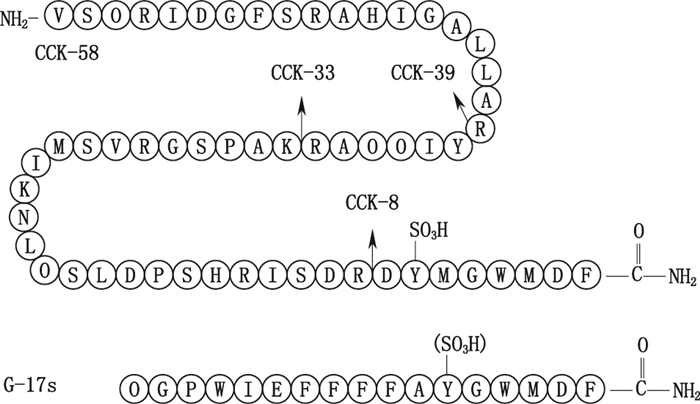
|
图 4 胆囊收缩素(CCK)与胃泌素17(G17s)的结构[48] Figure 4 The structure of cholecystokinin (CCK) and gastrin 17 (G17s) [48] |
CCK-BR因最初发现于大脑而得名,主要位于肠嗜铬样细胞,主导胃酸分泌,又称为胃泌素受体(gastrin receptor),其含有与CCK和胃泌素亲和力相同的7个跨膜区域,在不同物种间具有高度同源性,可结合酰胺化胃泌素C末端四肽,不能结合甘氨酸延伸型胃泌素与胃泌素原[2, 49]。
CCK-BR可表达于多种肿瘤,曾被认为是介导胃泌素促进肿瘤生长的受体。如Huang等[32]对胃癌中CCK-BR的表达情况研究后发现该受体的表达量及亲和力与胃癌的发生发展呈正相关,并可作为胃癌的诊治指标。Reubi等应用体外受体自动放射线成相技术对406例各种人源性肿瘤中CCK-BR与CCK-AR的表达进行了研究,结果表明CCK-BR在甲状腺髓样癌、小细胞肺癌、星型细胞瘤、基质卵巢癌的表达率分别为90%、89%、65%、100%[50]。CCK-BR也可表达于脑膜瘤、子宫内膜癌和卵巢腺癌、乳腺癌、胃肠胰腺神经内分泌肿瘤[51],较少表达于结肠癌、胃癌。除胆囊癌(76.6%)、食道癌(63%)外,CCK-AR较少表达于肿瘤[47]。
CCK-CR(也称为78 kD胃泌素结合蛋白)属于脂肪酸β-氧化酶类,为低亲和力受体,对酰胺化胃泌素与甘氨酸延伸型胃泌素有相似的亲和力。经RNA酶保护法与RT-PCR法证实,CCK-CR在结肠肿瘤与结肠癌细胞系中的检出率显著高于CCK-BR。Murphy等[52]研究报道该78 kD蛋白的N端与C端均可结合胃泌素17、胃泌素受体拮抗剂(proglumide,benzotript)。
除上述受体外,其他可结合胃泌素的新受体也陆续被研究报道。如甘氨酸延伸型胃泌素受体,该受体分布广泛,可表达于胰腺癌细胞系AR42J、胃癌细胞系AGS、结肠癌细胞系LoVo与HT29、小肠癌细胞系YAMC、肾胚胎细胞系HEK,为高亲和力受体,主要结合甘氨酸延伸型胃泌素的中心七肽铁离子复合物,能促进细胞生长。Singh等[53]还报道了一个45 kD的胃泌素新结合位点,该位点位于纤维母细胞,对甘氨酸延伸型胃泌素和酰胺化胃泌素具有相同的亲和力,也能促进细胞生长。此外,Kowalski-Chauvel等[54]研究发现甘氨酸延伸型胃泌素可与结肠癌细胞系或粘膜内皮细胞表面的F1-ATPase蛋白结合进而促进细胞增殖。
膜联蛋白Ⅱ(annexin Ⅱ,ANX Ⅱ)受体为胃泌素原受体,该受体为33~36 kD单体蛋白,也可结合甘氨酸延伸型胃泌素[48]。如Sarkar等研究报道胃泌素原可与胚胎上皮细胞表面的膜联蛋白A2(annexin A2,CS-ANXA2)结合进而发挥促瘤作用[49];Singh等[55]研究报道ANXⅡ蛋白可结合胃泌素原与胃泌素样肽,并介导胃泌素以自分泌或旁分泌方式促进结肠癌细胞系(HCT-116)与肠道上皮细胞(IEC-18)的生长。
总之,目前不同于CCK-AR、CCK-BR、CCK-CR的新受体已广为接受,有学者认为CCK-BR有多种异构体,所谓新受体只是CCK-BR异构体中的1种。如Hellmich等在人结直肠癌细胞上发现了CCK-BR的1个变异体CCK2i4sv,激活该受体可促进细胞增殖[3]。
4.2 胃泌素激活的信号通路 4.2.1 酰胺化胃泌素激活的信号通路 4.2.1.1 ERK 1/2、JNK、p38-MAPK信号通路丝裂原激活蛋白激酶(mitogen-activated protein kinases,MAPKs)为丝/苏氨酸激酶,其可通过某些受体家族被激活,如酪氨酸激酶受体、G蛋白偶联受体或细胞因子受体。MAPKs包括4个亚型:细胞外信号调节激酶1/2(extracelluar signal-regulated kinase 1/2,ERK 1/2,也称为p44MAPK和p42MAPK)、c-jun氨基末端激酶(c-jun NH2-terminal kinases,JNKs)、ERK5及p38MAPKs。这些激酶参与如细胞生长、分化、凋亡在内的许多细胞功能。
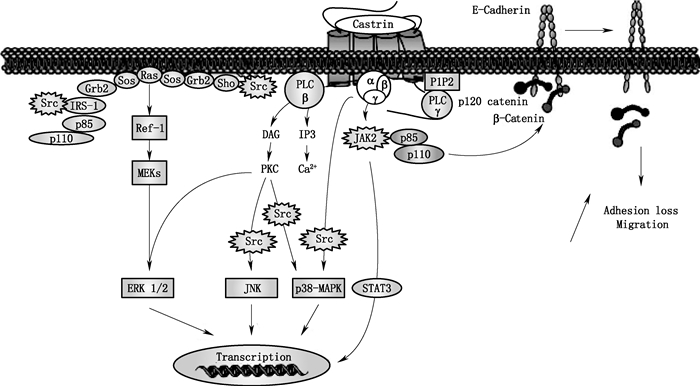
酰胺化胃泌素可经异源三聚体Gαβγ蛋白激活PLC-β引起磷脂酰肌醇二磷酸(phosphatidyl inositol 4,5-bisphosphate,PIP2)的快速水解,进而生成三磷酸肌醇(inositol 1,4,5-triphosphate,IP3)与甘油二酯(1,2-diacylglycerol,DAG),它们可分别引起Ca2+的调动与蛋白激酶C(protein kinase C,PKC)的活化,活化的PKC可进一步激活ERK 1/2、JNK、p38-MAPK信号通路,其中JNK、p38-MAPK信号通路具有Src激酶依赖性。酰胺化胃泌素也可经Gαβγ直接激活Src依赖的p38-MAPK信号通路[56];还可直接激活Src家族激酶,经Shc/Grb2/Sos或p110/p85/IRS-1Grb2/Sos复合物激活Ras-Raf-1-MEKs依赖的ERK1/2[57]。
小G蛋白超家族包括至少5个亚型(Ras、Rho/Rac/Cdc42、Rab、Arf/Sar1、Ran),该蛋白在许多信号通路中的上游具有关键作用并参与调节多种细胞活动。胃泌素可经CCK-B受体激活ERK1/2与PI3K/AKT通路上游中的小GTPaseRas,进而引发细胞增殖与抗凋亡作用。
4.2.1.2 JAK2-STAT3信号通路Janus激酶(Janus kinases,JAKs)是一类非受体酪氨酸激酶家族,包含可在造血细胞中发现并普遍表达的JAK1、JAK2、TYK2与JAK3共4个成员。它们可磷酸化并激活STAT家族转录因子(信号转换和激活转录)。一旦被磷酸化,STAT蛋白形成二聚体,转运至细胞核并结合目标基因。JAK/STAT信号通路可由细胞因子及生长因子激活,该通路可参与包括免疫反应、分化、细胞存活、增殖与肿瘤形成在内的多种细胞活动。
酰胺化胃泌素可经Gαβγ直接激活JAK2-STAT3信号通路,其中JAK2激酶还可通过p85/p110复合物引起与细胞膜上E-钙黏蛋白结合的p120连环蛋白、β-连环蛋白脱落,导致细胞粘附力降低产生迁移[58]。此外,酰胺化胃泌素也可经Gβγ激活PLC-γ1进而形成IP3[3](图 5)。
4.2.1.3 经CCK-B受体介导的其他通路除ERK1/2、JNK、p38-MAPK外,在转染CCK-B受体的结肠细胞系RIE-1中胃泌素可激活ERK5通路。该细胞系中,ERK5可能参与转录因子MEF2的激活及CCK-B受体下游COX-2的调节。
某些细胞模型中,如胃与结肠癌细胞、肠上皮细胞、转染CCK-B受体的纤维细胞,胃泌素可增强COX-2的基因表达。该前列腺素合成的关键酶在炎症和致瘤作用中具有重要作用,特别是COX-2可参与过度增殖、变形、侵袭与血管生成。在结肠癌细胞中,ERK1/2与PI3K通路参与胃泌素诱发的COX-2表达,而在肠细胞中,包括ERK1/2、ERK5、JNK、p38-MAPK的多种MAPK通路可导致经胃泌素调节的COX-2转录。
在表达内源性与稳定转染CCK-B受体的不同细胞系中,胃泌素可激活IA型PI3K。其分子机制包括位于酪氨酸残基上衔接r蛋白IRS-1的Src磷酸化,该位点为招募并激活p85/p110 PI3K复合物的结合位点。p85/p110 PI3K下游效应因子AKT(也称为PKB)在CCK-B受体信号通路中也起到作用,并可由胃泌素经磷酸化快速激活。PI3K/AKT通路参与CCK-B受体诱发的细胞增殖及抗凋亡过程,也可调节经该受体诱发的细胞黏附与迁移。
在表达CCK-B受体的胃癌细胞中,胃泌素也可调节与细胞迁移与侵袭(如MMP9,一种基质金属蛋白酶)相关基因的表达,该作用需要PKCs/Raf/ERK1/2通路的参与。
p125-FAK(focal adhesion kinase)为一种位于病灶黏附位点的细胞质蛋白酪氨酸激酶,其可在细胞形态、运动与侵袭中控制多种细胞内信号通路,该蛋白可被包括整合素、RTKs及GPCRs在内的多种细胞膜受体激活。在多种细胞中,p125-FAK磷酸化可导致Src激酶的招募及p125-FAK/Src复合物的活化,该复合物结合并磷酸化整合素相关蛋白(如桩蛋白、踝蛋白)以及衔接蛋白(如Shc、p130Cas)。p125-FAK/Src复合物可经CCK-B受体激活,而经胃泌素形成的p130Cas磷酸化具有Src依赖性。
细胞周期中可控制G1/S过渡的细胞周期素在细胞增殖中具有重要作用,胃泌素可引起周期素D1、D3、E的转录增加。如对表达CCK-B受体的胃癌细胞研究表明胃泌素可介导周期素D1促进子的CRE位点经2个转录因子CREB与β-catenin的结合进而引起周期素D1生成。
4.2.2 甘氨酸延伸型胃泌素、胃泌素原激活的信号通路 4.2.2.1 p70-S6K、JNK、ERK 1/2、JAK2-STAT3信号通路甘氨酸延伸型胃泌素可激活PI3K并通过IRS-1/p85/p110复合物引起由可磷酸化核糖体蛋白S6的p70-S6K激酶介导的转录[59];甘氨酸延伸型胃泌素与胃泌素原可直接激活JNK、Src依赖的ERK 1/2与STAT3、JAK2-STAT3信号通路[60](图 6)。

|
图 6 甘氨酸延伸型胃泌素、胃泌素原激活的信号通路[3] Figure 6 The signal pathway activated by glycine-extend gastrins and progastrin[3] |
甘氨酸延伸型胃泌素与胃泌素原可经Src或JAK2通过p85/p110/PI3K复合物激活AKT(也称为PKB),进而经PI3K/AKT通路激活翻译过程中相关成分(如P70S6K、启动子eIF4E)控制蛋白质合成,调节细胞增殖、抗凋亡、黏附与迁移[60]。此外,胃泌素原还可通过PKCα/p85/p110复合物激活PI3K。
5 总结与展望发现胃泌素至今,人们对该分子的表达及其调节、作用与促瘤机制等方面的认识正不断得到扩展与加深,特别针对该分子与肿瘤关系的研究正日益得到重视与发展,利用该分子特性研发相关靶向药物也日益受到关注。而针对该分子也尚有一些问题需要解决,如胃泌素在促肿瘤作用中涉及的信号通路纷繁复杂,且各条信号通路之间又存在着广泛交叉(cross-talk)与联系,几乎涉及目前认知的大部分信号通路,使得对信号通路研究和认识难以系统化,同时导致胃泌素过量分泌与种类失衡的关键因素,胃泌素分子对肿瘤细胞增殖、迁移、浸润之外生理活动的影响,哪些潜在受体可与胃泌素分子结合等问题应是未来研究的重点。
| [1] |
EDKINS JS. The chemical mechanism of gastric secretion[J]. J Physiol, 1906, 34(1-2): 133. DOI:10.1113/jphysiol.1906.sp001146 |
| [2] |
CHUECA E, LANAS A, PIAZUELO E. Role of gastrin-peptides in Barrett's and colorectal carcinogenesis[J]. World J Gastroenterol, 2012, 18(45): 6560. DOI:10.3748/wjg.v18.i45.6560 |
| [3] |
FERRAND A, WANG TC. Gastrin and cancer:a review[J]. Cancer Lett, 2006, 238(1): 15. DOI:10.1016/j.canlet.2005.06.025 |
| [4] |
FOURMY D, GIGOUS V, REUBI JC. Gastrin in gastrointestinal diseases[J]. Gastroenterology, 2011, 141(3): 814. DOI:10.1053/j.gastro.2011.07.006 |
| [5] |
DOCKRAY GJ, VARRO A, DIMALINE R, et al. The gastrins:their production and biological activities[J]. Annu Rev Physiol, 2001, 63: 119. DOI:10.1146/annurev.physiol.63.1.119 |
| [6] |
KOVAC S, SHULKES A, BALDWIN GS. Peptide processing and biology in human disease[J]. Curr Opin Endocrinol Diabetes Obes, 2009, 16(1): 79. DOI:10.1097/MED.0b013e3283202555 |
| [7] |
BUNDGAARD JR, REHFELD JF. Posttranslational processing of progastrin[J]. Results Probl Cell Differ, 2010, 50: 207. |
| [8] |
KOVAC S, ANDERSON GJ, BALDWIN GS. Gastrins, iron homeostasis and colorectal cancer[J]. Biochim Biophys Acta, 2011, 1813(5): 889. DOI:10.1016/j.bbamcr.2011.02.007 |
| [9] |
CUI G, KOH TJ, CHEN D, et al. Overexpression of glycineextended gastrin inhibits parietal cell loss and atrophy in the mouse stomach[J]. Cancer Res, 2004, 64(22): 8160. DOI:10.1158/0008-5472.CAN-04-0876 |
| [10] |
CHEN D, ZHAO CM, DOCKRAY GJ, et al. Glycine-extended gastrin synergizes with gastrin 17 to stimulate acid secretion in gastrin-deficient mice[J]. Gastroenterology, 2000, 119(3): 756. DOI:10.1053/gast.2000.16480 |
| [11] |
FOSGERAU K, JESSEN L, LIND TOLBORG J, et al. The novel GLP-1-gastrin dual agonist, ZP3022, increases β-cell mass and prevents diabetes in db/db mice[J]. Diabetes Obes Metab, 2013, 15(1): 62. DOI:10.1111/dom.2013.15.issue-1 |
| [12] |
KOVAC S, ANDERSON GJ, ALEXANDER WS, et al. Gastrin-deficient mice have disturbed hematopoiesis in response to iron deficiency[J]. Endocrinology, 2011, 152(8): 3062. DOI:10.1210/en.2010-1474 |
| [13] |
PANNEQUIN J, BARNHAM KJ, HOLLANDE F, et al. Ferric ions are essential for the biological activity of the hormone glycineextended gastrin[J]. J Biol Chem, 2002, 277(50): 48602. DOI:10.1074/jbc.M208440200 |
| [14] |
FERRAND A, LACHAL S, BRAMANTE G, et al. Stimulation of proliferation in the colorectal mucosa by gastrin precursors is blocked by desferrioxamine[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 299(1): G220. DOI:10.1152/ajpgi.00046.2010 |
| [15] |
NAJIB S, KOWALSKI-CHAUVEL A, DO C, et al. Progastrin a new pro-angiogenic factor in colorectal cancer[J]. Oncogene, 2015, 34(24): 3120. DOI:10.1038/onc.2014.255 |
| [16] |
CICCOTOSTO GD, MCLEISH A, HARDY KJ, et al. Expression, processing, and secretion of gastrin in patients with colorectal carcinoma[J]. Gastroenterology, 1995, 109(4): 1142. DOI:10.1016/0016-5085(95)90572-3 |
| [17] |
VAN SOLINGE WW, NIELSEN FC, FRⅡS-HANSEN L, et al. Expression but incomplete maturation of progastrin in colorectal carcinoma[J]. Gastroenterology, 1993, 104(4): 1099. DOI:10.1016/0016-5085(93)90279-L |
| [18] |
PATERSON AC, MACRAE FA, PIZZEY C, et al. Circulating gastrin concentrations in patients at increased risk of developing colorectal carcinoma[J]. J Gastroenterol Hepatol, 2014, 29(3): 480. DOI:10.1111/jgh.12417 |
| [19] |
ALY A, SHULKES A, BALDWIN GS. Short term infusion of glycine-extended gastrin(17)stimulates both proliferation and formation of aberrant crypt foci in rat colonic mucosa[J]. Int J Cancer, 2001, 94(3): 307. DOI:10.1002/(ISSN)1097-0215 |
| [20] |
STEPAN VM, SAWADA M, TODISCO A, et al. Glycine-extended gastrin exerts growth-promoting effects on human colon cancer cells[J]. Mol Med, 1999, 5(3): 147. |
| [21] |
KERMORGANT S, LEHY T. Glycine-extended gastrin promotes the invasiveness of human colon cancer cells[J]. Biochem Biophys Res Commun, 2001, 285(1): 136. DOI:10.1006/bbrc.2001.5132 |
| [22] |
HOLLANDE F, IMDAHL A, MANTAMADIOTIS T, et al. Glycine-extended gastrin acts as an autocrine growth factor in a nontransformed colon cell line[J]. Gastroenterology, 1997, 113(5): 1576. DOI:10.1053/gast.1997.v113.pm9352860 |
| [23] |
WESTWOOD DA, PATEL O, BALDWIN GS. Gastrin mediates resistance to hypoxia-induced cell death in xenografts of the human colorectal cancer cell line LoVo[J]. Biochim Biophys Acta, 2014, 1843(11): 2471. DOI:10.1016/j.bbamcr.2014.06.016 |
| [24] |
ELLRICHMANN M, RITTER PR, SCHRADER H, et al. Gastrin stimulates the VEGF-A promotor in a human colon cancer cell line[J]. Regul Pept, 2010, 165(2-3): 146. DOI:10.1016/j.regpep.2010.06.004 |
| [25] |
WATSON S, DURRANT L, MORRIS D. Gastrin:growth enhancing effects on human gastric and colonic tumour cells[J]. Br J Cancer, 1989, 59(4): 554. DOI:10.1038/bjc.1989.112 |
| [26] |
MASIA-BALAGUE M, IZQUIERDO I, GARRIDO G, et al. Gastrin-stimulated Gα13 Activation of Rgnef Protein(ArhGEF28) in DLD-1 Colon Carcinoma Cells[J]. J Biol Chem, 2015, 290(24): 15197. DOI:10.1074/jbc.M114.628164 |
| [27] |
SINGH P, OWLIA A, VARRO A, et al. Gastrin gene expression is required for the proliferation and tumorigenicity of human colon cancer cells[J]. Cancer Res, 1996, 56(18): 4111. |
| [28] |
BASUROY R, SRIRAJASKANTHAN R, PRACHALIAS A, et al. Review article:the investigation and management of gastric neuroendocrine tumours[J]. Aliment Pharmacol Ther, 2014, 39(10): 1071. DOI:10.1111/apt.2014.39.issue-10 |
| [29] |
ROSENTRAEGER MJ, GARBRECHT N, ANLAUF M, et al. Syndromic versus non-syndromic sporadic gastrin-producing neuroendocrine tumors of the duodenum:comparison of pathological features and biological behavior[J]. Virchows Arch, 2016, 468(3): 277. DOI:10.1007/s00428-015-1890-9 |
| [30] |
GOETZE JP, EILAND S, SVENDSEN LB, et al. Characterization of gastrins and their receptor in solid human gastric adenocarcinomas[J]. Scand J Gastroenterol, 2013, 48(6): 688. DOI:10.3109/00365521.2013.783101 |
| [31] |
SUN L, TU H, LIU J, et al. A comprehensive evaluation of fasting serum gastrin-17 as a predictor of diseased stomach in Chinese population[J]. Scand J Gastroenterol, 2014, 49(10): 1164. DOI:10.3109/00365521.2014.950693 |
| [32] |
HUANG GJ, ZHANG YL, LE ZQ, et al. The characteristics of gastrin receptor expression in gastric cancer[J]. Chin Germ J Clin Oncol, 2003, 2(3): 145. DOI:10.1007/BF02842286 |
| [33] |
FOX JG, WANG TC, ROGERS AB, et al. Host and microbial constituents influence Helicobacter pylori-induced cancer in a murine model of hypergastrinemia[J]. Gastroenterology, 2003, 124(7): 1879. DOI:10.1016/S0016-5085(03)00406-2 |
| [34] |
ISHIZUKA J, MARTINEZ J, TOWNSEND CM, et al. The effect of gastrin on growth of human stomach cancer cells[J]. Ann Surg, 1992, 215(5): 528. DOI:10.1097/00000658-199205000-00016 |
| [35] |
MISHRA P, SENTHIVINAYAGAM S, RANGASAMY V, et al. Mixed lineage kinase-3/JNK1 axis promotes migration of human gastric cancer cells following gastrin stimulation[J]. Mol Endocrinol, 2010, 24(3): 598. DOI:10.1210/me.2009-0387 |
| [36] |
PATEL O, MARSHALL KM, BRAMANTE G, et al. The C-terminal flanking peptide(CTFP)of progastrin inhibits apoptosis via a PI3-kinase-dependent pathway[J]. Regul Pept, 2010, 165(2-3): 224. DOI:10.1016/j.regpep.2010.08.005 |
| [37] |
XU W, CHEN GS, SHAO Y, et al. Gastrin acting on the cholecystokinin2 receptor induces cyclooxygenase-2 expression through JAK2/STAT3/PI3K/Akt pathway in human gastric cancer cells[J]. Cancer Lett, 2013, 332(1): 11. DOI:10.1016/j.canlet.2012.12.030 |
| [38] |
POVOSKI SP, ZHOU W, LONGNECKER DS, et al. Novel expression of gastrin(CCK-B)receptors in pancreatic carcinomas and dysplastic pancreas from transgenic mice[J]. Am J Surg, 1994, 167(1): 120. DOI:10.1016/0002-9610(94)90062-0 |
| [39] |
SMITH JP, FONKOUA LK, MOODY TW. The role of gastrin and CCK receptors in pancreatic cancer and other malignancies[J]. Int J Biol Sci, 2016, 12(3): 283. DOI:10.7150/ijbs.14952 |
| [40] |
CAPLIN M, KHAN K, GRIMES S, et al. Effect of gastrin and antigastrin antibodies on proliferation of hepatocyte cell lines[J]. Dig Dis Sci, 2001, 46(7): 1356. DOI:10.1023/A:1010634031457 |
| [41] |
CAYROL C, BERTRAND C, KOWALSKI-CHAUVEL A, et al. αv integrin:a new gastrin target in human pancreatic cancer cells[J]. World J Gastroenterol, 2011, 17(40): 4488. DOI:10.3748/wjg.v17.i40.4488 |
| [42] |
HARRIS JC, GILLIAM AD, MCKENZIE AJ, et al. The biological and therapeutic importance of gastrin gene expression in pancreatic adenocarcinomas[J]. Cancer Res, 2004, 64(16): 5624. DOI:10.1158/0008-5472.CAN-04-0106 |
| [43] |
BEALES IL, OGUNWOBI OO. Glycine-extended gastrin inhibits apoptosis in Barrett's oesophageal and oesophageal adenocarcinoma cells through JAK2/STAT3 activation[J]. J Mol Endocrinol, 2009, 42(4): 305. |
| [44] |
XU Y, KAJIH, OKIMURA Y, et al. Paracrine stimulation of cell growth by cholecystokinin/gastrin through cholecystokinin-B receptor on GH3 cells in vitro[J]. Neuroendocrinology, 1996, 64(4): 280. DOI:10.1159/000127129 |
| [45] |
PETROVIC M, BUKUMIRIC Z, ZDRAVKOVIC V, et al. The prognostic significance of the circulating neuroendocrine markers chromogranin A, pro-gastrin-releasing peptide, and neuron-specific enolase in patients with small-cell lung cancer[J]. Med Oncol, 2014, 31(2): 823. DOI:10.1007/s12032-013-0823-1 |
| [46] |
SETHI T, ROZENGURT E. Gastrin stimulates Ca2+ mobilization and clonal growth in small cell lung cancer cells[J]. Cancer Res, 1992, 52(21): 6031. |
| [47] |
RAI R, CHANDRA V, TEWARI M, et al. Cholecystokinin and gastrin receptors targeting in gastrointestinal cancer[J]. Surg Oncol, 2012, 21(4): 281. DOI:10.1016/j.suronc.2012.06.004 |
| [48] |
DUFRESNE M, SEVA A, FOURMY D. Cholecystokinin and gastrin receptors[J]. Physiol Rev, 2006, 86(3): 805. DOI:10.1152/physrev.00014.2005 |
| [49] |
SINGH P, SARKAR S, KANTARA C, et al. Progastrin peptides increase the risk of developing colonic tumors:impact on colonic stem cells[J]. Curr Colorectal Cancer Rep, 2012, 8(4): 277. DOI:10.1007/s11888-012-0144-3 |
| [50] |
ROOSENBURG S, LAVERMAN P, VAN DELFT FL, et al. Radiolabeled CCK/gastrin peptides for imaging and therapy of CCK2 receptor-expressing tumors[J]. Amino Acids, 2011, 41(5): 1049. DOI:10.1007/s00726-010-0501-y |
| [51] |
RAI R, KIM JJ, TEWARI M, et al. Heterogeneous expression of cholecystokinin and gastrin receptor in stomach and pancreatic cancer:an immunohistochemical study[J]. J Cancer Res Ther, 2016, 12(1): 411. DOI:10.4103/0973-1482.168970 |
| [52] |
BALDWIN GS, CHANDLER R, GREGO B, et al. Isolation and partial amino acid sequence of a 78 kDa porcine gastrin-binding protein[J]. Int J Biochem, 1994, 26(4): 529. DOI:10.1016/0020-711X(94)90010-8 |
| [53] |
SINGH P, OWLIA A, ESPEIJO R, et al. Novel gastrin receptors mediate mitogenic effects of gastrin and processing intermediates of gastrin on Swiss 3T3 fibroblasts. Absence of detectable cholecystokinin(CCK)-A and CCK-B receptors[J]. J Biol Chem, 1995, 270(15): 8429. DOI:10.1074/jbc.270.15.8429 |
| [54] |
KOWALSKI-CHAUVEL A, NAJIB S, BERTRANDA C, et al. Cell surface F1-ATPase binds the gastrin precursor, G-gly, and mediates its proliferative effects on colorectal cancer cells and vascular endothelial cells[J]. Regul Peptides, 2010, 164(1): 48. |
| [55] |
SINGH P, WU H, CLARK C, et al. Annexin Ⅱ binds progastrin and gastrin-like peptides, and mediates growth factor effects of autocrine and exogenous gastrins on colon cancer and intestinal epithelial cells[J]. Oncogene, 2007, 26(3): 425. DOI:10.1038/sj.onc.1209798 |
| [56] |
TRIPATHI S, FLOBAK A, CHAWLA K, et al. The gastrin and cholecystokinin receptors mediated signaling network:a scaffold for data analysis and new hypotheses on regulatory mechanisms[J]. BMC Syst Biol, 2015, 9: 40. DOI:10.1186/s12918-015-0181-z |
| [57] |
ROZENGURT E, WALSH JH. Gastrin, CCK, signaling, and cancer[J]. Annu Rev Physiol, 2001, 63: 49. DOI:10.1146/annurev.physiol.63.1.49 |
| [58] |
CAO J, YU JP, LIU CH, et al. Effects of gastrin 17 on β-catenin/Tcf-4 pathway in Colo320WT colon cancer cells[J]. World J Gastroenterol, 2006, 12(46): 7482. DOI:10.3748/wjg.v12.i46.7482 |
| [59] |
KOWALSKI-CHAUVEL A, PRADAYROL L, VAYSSE N, et al. Tyrosine phosphorylation of insulin receptor substrate-1 and activation of the PI-3-kinase pathway by glycine-extended gastrin precursors[J]. Biochem Biophys Res Commun, 1997, 236(3): 687. DOI:10.1006/bbrc.1997.6975 |
| [60] |
HOLLANDE F, CHOQUET A, BLANC EM, et al. Involvement of phosphatidylinositol 3-kinase and mitogen-activated protein kinases in glycine-extended gastrin-induced dissociation and migration of gastric epithelial cells[J]. J Biol Chem, 2001, 276(44): 40402. DOI:10.1074/jbc.M105090200 |
 2017, Vol. 37
2017, Vol. 37