2. 中科院湖州营养中心, 湖州 313000
2. Huzhou R&D Center for Nutrition and Health, Shanghai Institutes for Biological Sciences of Chinese Academy, Huzhou 313000, China
利奈唑胺(linezolid)是第一个用于临床的新型噁唑烷酮类抗菌药物[1],抗菌作用机制为选择性作用于细菌50S核糖体亚单位上与30S亚基的结合点,阻止70S起始复合物的形成,从而抑制细菌蛋白质的合成。利奈唑胺由于其独特的抗菌机制及良好的耐受性[2],对社区和医院各种感染的阳性细菌具有广谱抗菌作用。随着利奈唑胺在临床上的广泛应用,利奈唑胺的耐药菌株和不良反应(包括腹泻、皮疹、头痛[3],乳酸中毒[4],甚至严重的骨髓抑制[5-6]等)开始出现,特别是危重感染患者。由于患者不同的病理生理条件,存在影响药物体内分布和排泄的多种因素(如水肿、体液治疗和腹水等)[7],可能导致药物体内过程发生了一些改变。因此,需要进行利奈唑胺血药浓度的监测,以确保药物的有效治疗[8-9],优化利奈唑胺的临床使用,减少耐药菌株的产生及不良反应的发生[10]。以快速准确的利奈唑胺血药浓度检测为基础,结合患者的药效学特性,制定针对不同类型个体合理的治疗方案以达到最佳的治疗结果,同时最大限度地降低耐药突变频率和长期不良反应,达到利奈唑胺的临床用药合理性[11-12]。
利奈唑胺的检测方法,目前国外文献报道有LC-MS和HPLC。LC-MS检测对仪器要求高,国内难以普及。国内有利奈唑胺HPLC检测的报道[13-14],但采用外标法,且方法的回收率低。虽然此方法特异性强、灵敏度高、精确,但是样本前处理操作步骤烦琐,成本高,再加上设备昂贵、花费大、操作技能要求高等原因,故不适合大批量样品的筛选检测。免疫分析法(如酶联免疫法、胶体金法以及荧光免疫层析法),由于其在抗原抗体的定性定量方面有独特的优势,同时具有操作简便、分析样本大等优点,弥补了理化分析的不足,在小分子药物检测中起着越来越重要的作用。酶联免疫吸附测定法可同时检测多个样品,但是检测时间长,不适用于床旁即时检测。荧光免疫层析技术法是时间分辨荧光预相增强和纳米微球包裹结合的技术,将预增强的荧光离子通过聚苯乙烯微球进行包裹和修饰,将荧光效率提高了上千倍,使得检测灵敏度较其它方法如胶体金方法高2~3个数量级。该方法具有操作简单、快速,无需大型检测仪器设备[15-16],更适用于现场及时检测,是快速检测发展的趋势。
对于小分子免疫法检测,影响免疫分析法检测质量的根本原因是抗体的特异性与亲和性,这些性质又取决于免疫半抗原的分子结构,所以免疫半抗原分子设计与选择是产生特异性抗体和建立小分子药物含量快速检测技术最关键的步骤。本实验通过对利奈唑胺进行定向衍生化,获得具有单一羧基结构的半抗原,与蛋白质载体分子偶联制备了完全抗原,免疫小鼠制备特异性单抗。基于荧光免疫层析法建立了利奈唑胺血药浓度即时定量检测法。
1 实验材料脱乙酰利奈唑胺(深圳振强生物技术有限公司),BALB/c小鼠(上海西普尔必凯实验动物有限公司),弗氏佐剂、HAT、HT、PEG(1500)、N-羟基丁二酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)(Sigma),抗兔IgG抗体(杭州启泰生物技术有限公司),SP2/0细胞(南京军事医学科学院朱进老师惠赠),Quick Start Bradford Protein Assay Kit(美国伯乐公司),Alexa Fluor® 647荧光染料(Thermofisher),FCR-Ⅰ单通道荧光免疫分析仪(湖州申科生物科技有限公司),高效液相色谱仪(安捷伦科技有限公司),Hypersil ODS2色谱柱(英国Hypersil公司)。
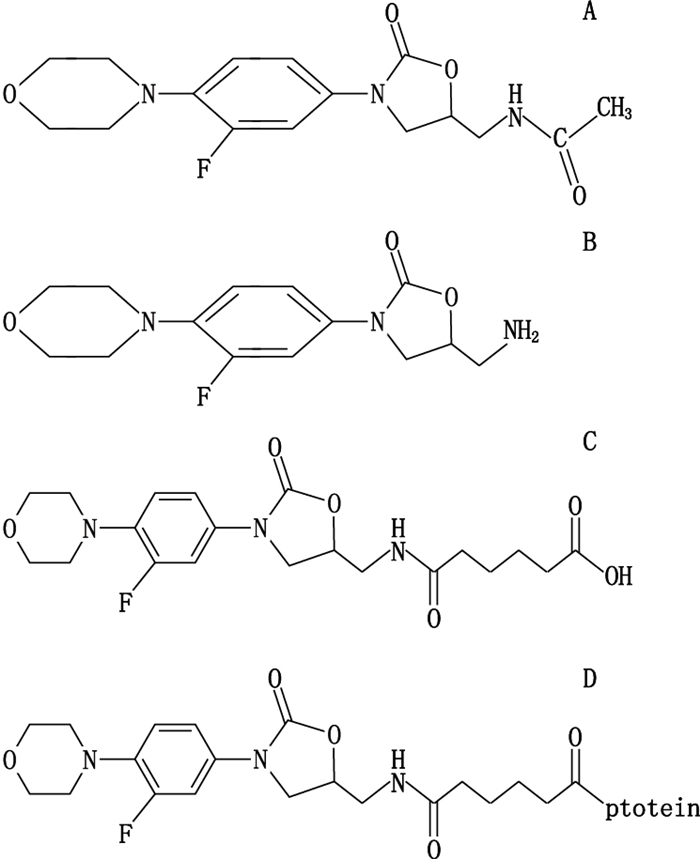
2 实验方法 2.1 利奈唑胺半抗原衍生物的制备在室温条件下,将与利奈唑胺(图 1-A)结构类似的的脱乙酰利奈唑胺化合物(400 mg,2.71 mmol)如图 1-B所示,在二氯甲烷/四氢呋喃(30 mL/15 mL)中溶解,向其中加入用二氯甲烷/四氢呋喃(5 mL/2 mL)溶解的氧杂环庚烷-2,7-二酮。将此混合物在室温条件下搅拌30 min,然后向此混合液中加入1 mol·L-1的氢氧化钠溶液(20 mL),继续搅拌5 min。此反应混合液用二氯甲烷(15 mL × 3)洗涤之后,去除有机相,用浓盐酸将水相pH调到5。将沉淀物过滤收集,用冰水洗,最后真空干燥得6-((3-氟-4-吗啉苯基)-2-氧唑烷基)氨甲基)-6-含氧正己酸(即:利奈唑胺衍生物)如图 1-C所示。
|
A.利奈唑胺(linezolid)B.脱乙酰利奈唑胺(deacetyl linezolid)C.利奈唑胺衍生物(linezolid derivative)D.利奈唑胺人工抗原(linezolid artificial antigen) 图 1 利奈唑胺相关化合物结构式 Figure 1 The structures of linezolid-related compounds |
称取利奈唑胺衍生化合物40 mg,溶解于DMF 2 mL中,形成20 mg·mL-1的终浓度,取其中90 μL与EDC(100 mg·mL-1)8 μL混合,再加入NHS(50 mg·mL-1)12 μL,均匀混合后在搅拌条件下反应15~60 min。
将上述反应混合液离心(1 600 r·min-1)后加入到6 mg·mL-1牛血清蛋白溶液1 mL中(或加入到4.5 mg·mL-1卵清蛋白溶液1 mL中)在室温搅拌条件下反应1~5 h后,用磷酸缓冲液透析4次,12 h换1次液。收集透析液,用美国伯乐(BIO-RAD)公司的Quick Start Bradford Protein Assay Kit测定免疫原和包被原的浓度。得到的利奈唑胺人工抗原(免疫原和包被原)结构式如图 1-D所示,图中protein为牛血清蛋白(bovine serum albumin,BSA)或卵清蛋白(ovalbumin,OVA)。偶联好的完全抗原进行紫外扫描鉴定。
2.3 利奈唑胺单克隆抗体的制备将上述得到的利奈唑胺免疫原稀释成0.2 mg·mL-1,取免疫原500 μL与等体积的弗氏完全佐剂混合后,乳化完全,免疫BALB/c小鼠。免疫程序采用经典免疫程序,4次免疫后的小鼠经腹腔注射约免疫原100 μg再次加强免疫,3 d后,取该小鼠脾脏用于融合。取SP2/0细胞与脾细胞进行融合,HAT和ELISA方法筛选阳性杂交瘤细胞[17]。
取BALB/c小鼠(6~7周龄),于腹腔注射石蜡油0.5 mL,7 d后,腹腔注射1×106阳性杂交瘤细胞0.5 mL。观察小鼠生长情况,8 d左右后及时采集腹水。利用Protein G Resin亲和纯化纯化单克隆抗体。并利用竞争法ELISA检测抗体活性。
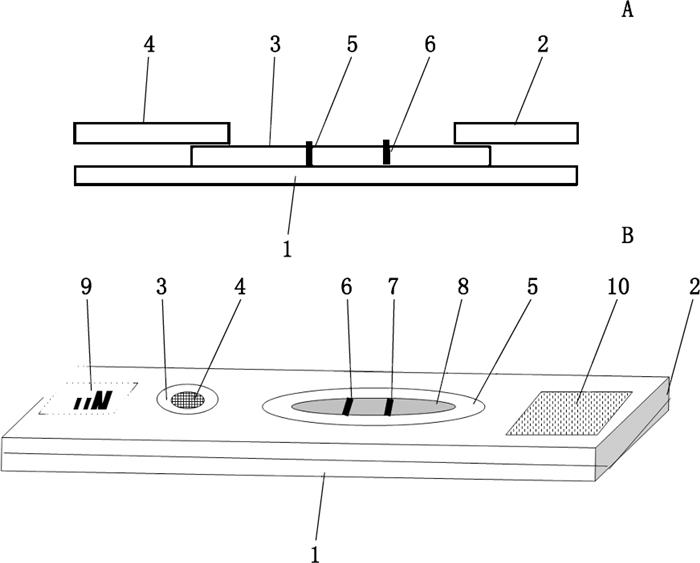
2.4 利奈唑胺荧光免疫层析检测法建立 2.4.1 利奈唑胺荧光免疫层析试纸条制备组装1)用包被缓冲液(磷酸缓冲液)分别将制备得到的利奈唑胺包被原(利奈唑胺-OVA)和兔抗体IgG稀释到适当浓度(0.4~1.0 mg·mL-1。在25±5 ℃的温度下,将稀释后的利奈唑胺-OVA和兔抗体IgG均匀喷于硝酸纤维膜上(分别形成检测线和质控线),在12%~30%的湿度条件下烘干3 h左右,干燥保存备用;2)在黑色PVC基片上分别依次粘贴步骤1)所得到的包被好的硝酸纤维素膜、玻璃纤维纸和吸水纸形成检测卡(图 2-A),按照要求切割成适当宽度[18];3)将步骤2)所得到的试纸条装入卡盒的下盖中,盖上上盖,形成完整的带卡盒检测卡(图 2-B)。
|
A.未装塑料卡的试纸卡(test strip without plastic cover):1.黑色PVC基片(black PVC substrate)2.吸水纸(absorbent paper)3.硝酸纤维素膜[nitrocellulose membrane] 4.玻璃纤维(glass fiber)5.质控线带(C线)[quality control line(C line)] 6.检测线带(T线)[test line(T line)] B.有塑料卡盒的利奈唑胺检测卡(test strip with plastic cover):1.下盖(lower lid)2.上盖(upper lid)3.加样窗口(the sample port)4.玻璃纤维(glass fiber)5.检测窗口(test port)6.质控线带(C线)[quality control line(C line)] 7.检测线带(T线)(test line(T line))8.硝酸纤维素膜(nitrocellulose membrane)9.利奈唑胺标志(LIN)[linezolid label(LIN)] 10.条形码识别区域(barcode recognition area) 图 2 未装塑料卡盒和装塑料卡盒的利奈唑胺检测卡结构 Figure 2 The structure of test strip without plastic cover and with plastic cover |
根据说明书标记抗体方法,将Alexa Fluor® 647分别荧光标记上述得到的单克隆抗体以及抗兔IgG抗体。用含有1%BSA的0.02 mg·mL-1磷酸缓冲液将荧光标记后的利奈唑胺抗体和抗兔IgG抗体稀释配制成检测分析液。4 ℃保存备用。
2.4.3 检测及标准曲线建立使用空白混合人血清作为基质,分别配制0、0.39、0.78、1.56、3.125、6.25、12.5、25和50 μg·mL-1系列利奈唑胺对照品。取稀释1 000倍后的系列对照品溶液100 μL与检测分析液60 μL均匀混合后,取100 μL加入到检测卡的加样窗口,反应10 min后,在FCR系列单通道荧光免疫分析仪上读数,根据样本的T线信号与C线信号比值(T/C值)与对照品浓度建立标准曲线。并写入IC卡内置FCR-Ⅰ单通道荧光免疫分系仪中。
2.5 方法学评价 2.5.1 灵敏度以及线性范围将0 μg·mL-1样品连续检测10次,分别计算其T/C值的平均值(X)、标准偏差(SD)。灵敏度的计算方式为,X-2×SD的T/C值在上述建立的标准曲线里所对应的利奈唑胺浓度。
分别重复检测曲线上各个浓度点,每个重复5次,分别计算其T/C值的平均值(X)、标准偏差(SD)以及精密度(RSD)。高浓度上限和低浓度下限RSD小于15%的范围为检测曲线的线性范围。
2.5.2 精密度分别利用已经建立的利奈唑胺检测体系检测浓度为2.5、20和40 μg·mL-1的利奈唑胺对照品,各重复检测15次,计算检测高、中、低浓度利奈唑胺的精密度(RSD)。
2.5.3 回收率选择线性范围内高、中和低3个区域,每个区域选择2个浓度点(40、38、22、18、4.5和2.5 μg·mL-1)为检测对象进行回收率试验。即:选择在低浓度利奈唑胺(初始浓度C0,C0不得大于5 μg·mL-1)混合人血清阳性样本中添加利奈唑胺标准品,使得加标样本终浓度为(40+C0)、(38+C0)、(22+C0)、(18+C0)、(4.5+C0)和(2.5+C0)μg·mL-1的6个浓度点样本,每个点重复检测3次,分别计算回收率(R)。
R=(实测总浓度Cx-初始浓度C0)/理论加标量)×100%
2.5.4 特异性试验分别将甲氧苄啶、阿奇霉素、奥美拉唑、氟康唑、替考拉宁、万古霉素、盐酸多巴胺、苯丙氨酸、L-酪氨酸、色氨酸、氨苄、头孢氨苄、头孢呱酮和头孢唑林等14种与利奈唑胺结构相似以及联合用药相关药物对照品配制一系列的浓度梯度,各个分别稀释1 000倍后,取100 μL进行检测。根据浓度对应的T/C值,建立每个药物的抑制曲线,计算出相应的IC50值。根据公式:交叉反应率(%)=(利奈唑胺IC50/其他药物IC50)×100%,计算交叉反应率。
2.5.5 临床血样检测与HPLC法比较参考董海燕等[13]的建立的检测利奈唑胺HPLC法,本实验建立了利奈唑胺测HPLC法检。利用这2种方法,分别检测利奈唑胺用药患者的血清样本67例,进行数据比对。
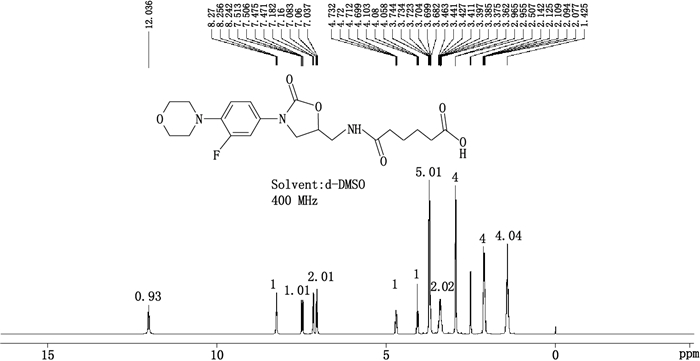
3 试验结果 3.1 利奈唑胺半抗原衍生物的制备以化合物脱乙酰利奈唑胺为原料,通过氨基和羧基共价缩合反应制备得到利奈唑胺衍生物白色固体245 mg,收率:47%)。1H-NMR鉴定图谱如图 3所示,说明利奈唑胺半抗原衍生物合成成功,有单一羧基活性基团存在,利于完全抗原的制备。
|
图 3 利奈唑胺半抗原衍生物1H-NMR鉴定图谱 Figure 3 The 1H-NMR identification of linezolid hapten derivative |
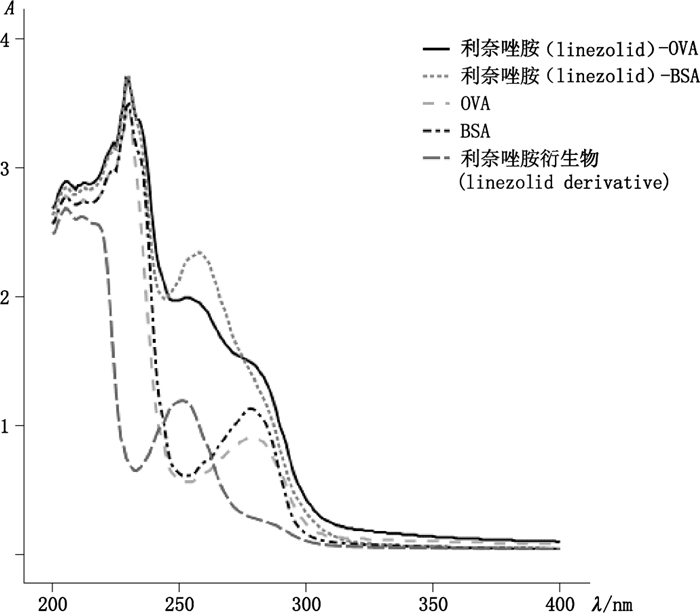
将制备好的完全抗原(免疫原和包被原)进行紫外扫描鉴定,扫描图谱如图 4所示,完全抗原利奈唑胺-BSA和利奈唑胺-OVA紫外扫描图谱波峰不同于利奈唑胺衍生物、OVA和BSA等的扫描图谱。说明完全抗原偶联成功。
|
图 4 利奈唑胺免疫原和包被原紫外扫描图谱 Figure 4 The ultraviolet scanning map of linezolid immunogens and coating antigen |
杂交瘤细胞融合后,经过HAT筛选和ELISA法筛选得到3株分泌利奈唑胺抗体的杂交瘤细胞。ELISA法具体步骤:① 包被利奈唑胺检测抗原于96孔板,过夜包被,并洗涤3次。② 封闭液封闭后,洗涤3次。③ 96孔板第一列加入PBS 50 μL作为对照,第2、3、4、5、6列分别加入50 μL不同浓度(50、10、5、1、0.5 ng·mL-1)利奈唑胺对照品。④ 96孔板从上到下,每行加入50 μL不同稀释梯度的抗体(1~128万倍),37°孵育1 h洗涤3次。⑤ 加入HRP标记二抗,37°孵育1 h后洗涤3次,加入显色液100 μL,15 min后加入终止液50 μL,酶标仪450 nm读数。将通过腹水制备的利奈唑胺单克隆抗体经过纯化后进行ELISA抑制效果检测。检测结果如表 1、2和3所示。1号抗体稀释16万倍时灵敏度可以达到0.5 ng·mL-1,2号抗体稀释4万倍时灵敏度可以达到1 ng·mL-1,3号抗体稀释1万倍时灵敏度可以达到0.5 ng·mL-1。考虑到建立的荧光免疫层析法检测利奈唑胺是微克级别,所以不需要太敏感抗体,所以2号抗体作为下一步建立检测体系的优选抗体。
|
|
表 1 不同利奈唑胺浓度对1号抗体抑制情况 Table 1 Inhibition efficiency of different linezolid concentrations to 1# antibody |
|
|
表 2 不同利奈唑胺浓度对2号抗体抑制情况 Table 2 Inhibition efficiency of different linezolid concentrations to 2# antibody |
|
|
表 3 不同利奈唑胺浓度对3号抗体抑制情况 Table 3 Inhibition efficiency of different linezolid concentrations to 3# antibody |
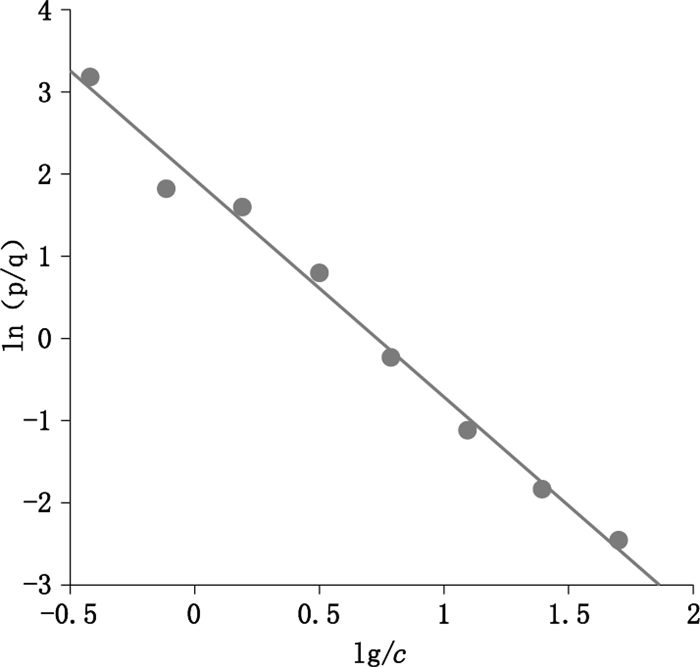
将配置的0、0.39、0.78、1.56、3.125、6.25、12.5、25和50 μg·mL-1系列利奈唑胺对照品进行检测得到的T/C值(检测线与质控线峰面积比值)数据如表 4所示,从0~50 μg·mL-1浓度对应不同的T/C值,每个浓度点之间T/C值区分跨度大。利用Logit-log直线回归法,根据表 4中的数据,绘制标准曲线如图 4所示。令p=OD/OD0,q=1-p,y=ln(p/q),x=lg(浓度)其中:OD为T/C值,OD0为浓度为0的T/C值的均值,回归方程:
|
|
表 4 荧光免疫层析法检测不同浓度利奈唑胺对照品 Table 4 Immunochromatographic assay for different concentrations linezolid refrence substances |
|
图 4 利奈唑胺荧光免疫层析检测标准曲线 Figure 4 Standard curve of linezolid by fluorescence immunochromatographic assay |
y=a+b*x R2=0.998
其中a=1.92,b=-2.66。线性较好,计算得IC50=5.28 μg·mL-1。
3.5 方法学评价 3.5.1 灵敏度以及线性范围将0 μg·mL-1样品通过荧光免疫层析法重复检测10次,数据如表 5所示,其T/C值的平均值X=5.92、SD=0.17,X-2×SD=5.73,将表 5数据中的X-2×SD的T/C值作为y值代入图 4标准曲线对应的方程中的到的浓度值为0.61 μg·mL-1,即分析灵敏度为0.61 μg·mL-1。
|
|
表 5 重复检测0 μg·mL-1利奈唑胺样本结果 Table 5 The results of repeated tests for linezolid at 0 μg·mL-1 |
分别重复检测曲线上接近高低浓度各个浓度点标准品,每个重复10次,检测数据如表 6所示,并计算其T/C值的平均值(X)、标准偏差(SD)以及精密度(RSD)。表 6显示各个浓度的T/C值RSD在0浓度和0.3 μg·mL-1浓度大于10%,即高浓度上限和低浓度下限RSD小于10%,所以线性范围为0.78~50 μg·mL-1。
|
|
表 6 重复检测不同浓度对照品T/C值的RSD Table 6 The RSD of repeated tests for different concentrations of refrence substance T/C value |
利用已经建立的利奈唑胺检测体系检测浓度为2.5、20和40 μg·mL-1的利奈唑胺对照品,各重复检测15次,检测结果如表 7所示,计算的检测高、中、低浓度利奈唑胺的数据的精密度(RSD)均小于10%。
|
|
表 7 重复检测高、中、低浓度利奈唑胺对照品结果 Table 7 The results of repeated tests for linezolid with high、medium and low concentration |
分别检测初始浓度样本,以及加标样本(40+C0)、(38+C0)、(22+C0)、(18+C0)、(4.5+C0)和(1.5+C0)μg·mL-1,每个样本重复检测3次,计算加标样本的回收率。检测计算结果如表 8所示。高、中、低3个区域范围的回收率范围在78.4%~123.4%。
|
|
表 8 高、中、低浓度加标回收试验结果 Table 8 The results of standard added recovery tests of high, medium and low concentration |
将14种与利奈唑胺结构相似以及联合用药相关药物对照品的一系列的浓度梯度进行检测,并分别建立每个相关药物的抑制曲线,计算出相应的IC50值以及交叉反应率。(公式:交叉反应率(%)=(利奈唑胺IC50/其他药物IC50)×100%)结果如表 9所示,甲氧苄啶、盐酸多巴胺阿奇霉素、L-酪氨酸和头孢呱酮与利奈唑胺无任何交叉反应;奥美拉唑、氟康唑、替考拉宁、万古霉素、多巴胺、苯丙氨酸、色氨酸、氨苄、头孢氨苄、和头孢唑林等其余药物与利奈唑胺的交叉反应均小于0.000 1%。说明本利奈唑胺检测体系特异性较好。
|
|
表 9 14种药物分别与利奈唑胺检测体系交叉反应的结果 Table 9 The respective results of cross-reaction of 14 kinds of drugs with linezolid detection system |
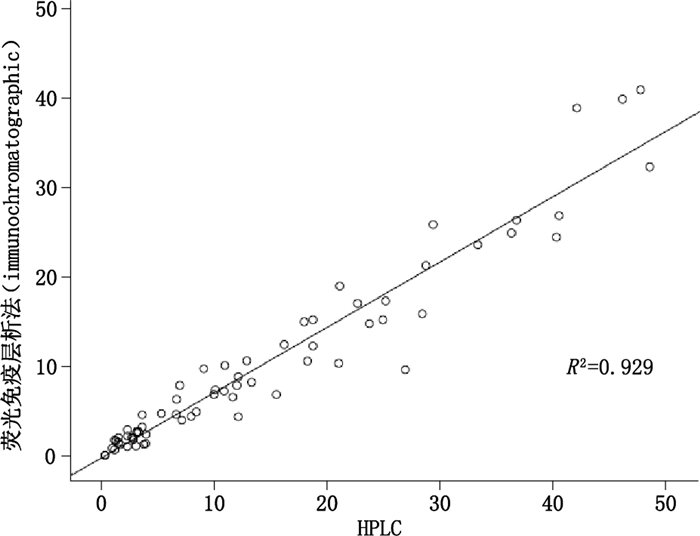
依据本实验建立的利奈唑胺血药浓度HPLC检测法,该方法条件为:色谱柱:Hypersil ODS2柱;流动相:乙腈-0.01%磷酸(27:73);流速:1 ml·min-1;进样量:20 μL;紫外检测波长:254 nm;柱温:30 ℃。利用HPLC法和荧光免疫层析法,分别检测67例利奈唑胺用药患者的血清样本,进行数据比对,进行相关性分析。结果如图 5所示。2种不同的方法检测临床样本相关性较好R2=0.929,大于0.90。
|
图 5 荧光免疫层析法与HPLC法检测临床样本数据比较 Figure 5 The comparison of clinical data between HPLC and immuno-chromatographic assay |
利奈唑胺作为上市新药,在治疗革兰氏阳性菌感染方面有独特的功效,且不良反应相对较少,在临床取得了很好的疗效。但同时也应注意对其引起血小板降低、骨髓抑制、乳酸中毒等相关不良反应的监测,加强用药安全。对于特殊人群的利奈唑胺治疗,有必要进行血药浓度的监测,以确保药物的有效治疗[19],减少耐药菌株的产生及不良反应的发生[20-21]。以快速准确的利奈唑胺血药浓度检测为基础,结合患者的药效学特性,制定针对不同类型个体合理的治疗方案以达到最佳的治疗结果,同时最大限度地降低耐药突变频率以及长期使用利奈唑胺引起的不良反应,达到利奈唑胺的临床用药合理性。
目前基于免疫学原理的小分子快速检测技术质量的关键是小分子半抗原抗体的好坏,然而抗体的质量又取决于高效的小分子抗原结构。本实验通过独特的小分子抗体制备途径,即:将利奈唑胺半抗原定向衍生化成具有单一羧基结构的衍生物,通过与BSA偶联制备高效的完全抗原。经过免疫小鼠,采用杂交瘤技术制备了高特异性的利奈唑胺单克隆抗体。基于荧光免疫层析法成功建立了利奈唑胺血药浓度快速检测技术。荧光免疫法的关键是抗体,本实验获得了3株单克隆抗体,但是可用于建立高效检测技术的抗体只有1株。
本实验建立荧光免疫层析法利奈唑胺检测技术特异性较好,与14种相关药物都无交叉反应;灵敏度0.61 μg·mL-1,检测范围0.7~50 μg·mL-1,精密度小于10%,高中低浓度回收率78.4%~123.4%。通过检测临床样本与HPLC法比较,相关性较好。用本实验制备的试纸卡对利奈唑胺临床样本进行初步的检测,体现出该方法有快速、准确定量、特异性好和实用性等优点。如果将该方法应用于临床利奈唑胺血药浓度的检测,将有效克服了当前利奈唑胺血药浓度检测中操作费时,响应时间长,对操作人员技术要求高等缺陷,作为利奈唑胺治疗特殊人群有效治疗、合理用药优选辅助工具,具有广阔的应用前景。
| [1] |
ZABRANSKY RJ. Linezolid: the first of a new class of antimicrobial agents[J]. Clin Microbiol Newsl, 2002, 24(4): 25. DOI:10.1016/S0196-4399(02)80003-4 |
| [2] |
ITANI KM, BISWAS P, REISMAN A, et al. Clinical efficacy of oral linezolid compared with intravenous vancomycin for the treatment of methicillin-resistant Staphylococcus aureus-complicated skin and soft tissue infections: a retrospective, propensity score-matched, case-control analysis[J]. Clin Ther, 2012, 34(8): 1667. DOI:10.1016/j.clinthera.2012.06.018 |
| [3] |
STEVENS DL, DOTTER B, MADARAS-KLLEY K. A review of linezolid: the first oxazolidinone antibiotic[J]. Expert Rev Antiinfect Ther, 2004, 2(1): 51. DOI:10.1586/14787210.2.1.51 |
| [4] |
MUTSCHLER M, TROJAN S, DEFOSSE JM, et al. Severe sepsis caused by a linezolid-resistant Enterococcus faecium in a 10-year-old girl after multiple trauma[J]. Int J Infect Dis, 2013, 17(6): 466. DOI:10.1016/j.ijid.2013.01.009 |
| [5] |
ATTASSI K, RSHBERGER E, ALAM R. Thrombocytopenia associated with linezolid therapy[J]. Clin Infect Dis, 2002, 34(5): 695. DOI:10.1086/338403 |
| [6] |
CHEN C, GUO DH, CAO X, et al. Risk factors for thrombocytopenia in adult chinese patients receiving linezolid therapy[J]. Curr Ther Res Clin Exp, 2012, 73(6): 195. DOI:10.1016/j.curtheres.2012.07.002 |
| [7] |
GREEN SL, MADDOX JC, HUTTENBACH ED, et al. Linezolid and reversible myelo-suppression[J]. J Am Med Assoc, 2001, 285(10): 1291. |
| [8] |
CATTANEO D, ORLANDO G, COZZI V, et al. Linezolid plasma concentrations and occurrence of drug-related haematological toxicity in patients with gram-positive infections[J]. Int J Antimicrob Agents, 2013, 41(6): 586. DOI:10.1016/j.ijantimicag.2013.02.020 |
| [9] |
TRAUNMüLLER F, MAURIC O, POPOVIC M, et al. Rapid and sensitive determination of the antibiotic linezolid in low plasma volumes by high-performance liquid chromatography[J]. J Chromatogr Sci, 2010, 48(5): 325. DOI:10.1093/chromsci/48.5.325 |
| [10] |
LOVERING AM, LE-FLOCH R, HOVSEPIAN L, et al. Pharmacokinetic evaluation of linezolid inpatients with major thermal injuries[J]. J Antimicrob Chemother, 2009, 63(3): 553. DOI:10.1093/jac/dkn541 |
| [11] |
RAMíREZ E, GóMEZ-GIL R, BOROBIA AM, et al. Improving linezolid use decreases the incidence of resistance among gram-positive micro-organisms[J]. Int J Antimicrob Agents, 2013, 41(2): 174. DOI:10.1016/j.ijantimicag.2012.10.017 |
| [12] |
PEA F, FURLANUT M, COJUTTI P, et al. Therapeutic drug monitoring of linezolid: a retrospective monocentric analysis[J]. Antimicrob Agents Chemother, 2010, 54(11): 4605. DOI:10.1128/AAC.00177-10 |
| [13] |
董海燕, 董亚琳, 王雪, 等. HPLC法测定人血清中利奈唑胺浓度及其临床应用[J]. 药物分析杂志, 2010, 30(2): 199. DONG HY, DONG YL, WANG X, et al. HPLC determination and clinical application of linezolid concentration in human serum[J]. Chin J Pharm Anal, 2010, 30(2): 199. |
| [14] |
张永煌, 张善堂, 张蕾, 等. 重症感染患者血清中利奈唑胺的浓度测定与临床应用评价[J]. 中华医院感染学杂志, 2016, 26(3): 564. ZHANG YH, ZHANG ST, ZHANG L, et al. Concentration determination of linezolid in human serum of patients with severe infections and evaluation of clinical application[J]. Chin J Nosocomiol, 2016, 26(3): 564. |
| [15] |
OH SW, KIM YM, KIM HJ, et al. Point-of-care fluorescence immunoassay for prostate specific antigen[J]. Clin Chim Acta, 2009, 406(1-2): 18. DOI:10.1016/j.cca.2009.04.013 |
| [16] |
LI Z, WANG Y, WANG J, et al. Rapid and sensitive detection of protein biomarker using a portable fluorescence biosensor based on quantum dots and a lateral flow test strip[J]. Anal Chem, 2010, 82(16): 7008. DOI:10.1021/ac101405a |
| [17] |
中国科学院上海生命科学研究院湖州营养与健康产业创新中心. 人胱抑素C的荧光免疫层析检测卡及检测试剂盒和检测体系: 中国, CN204188615U[P]. 2015. 03. 04 SHANGHAI INST BIOL SCIENCES. Fluorescence immunochromatography detection card, detection kit and detection system for human cystatin C: China, CN204188615U[P]. 2015. 03. 04 |
| [18] |
胡佳丽, 于东升, 刘小雷, 等. 荧光免疫层析法快速测定牛奶中头孢氨苄残留量[J]. 中国食品卫生杂志, 2014, 26(4): 362. HU JL, YU DS, LIU XL, et al. Rapid detection of cefalexin residues in milk by fluorescent immunochromatography assay[J]. Chin J Food Hyg, 2014, 26(4): 362. |
| [19] |
DARIO C, GIOVANNA O, VALERIA C, et al. Linezolid plasma concentrations and occurrence of drug-related haematological toxicity in patients with Gram-positive infections[J]. Int J Antimicrob Agents, 2013, 41(6): 586. DOI:10.1016/j.ijantimicag.2013.02.020 |
| [20] |
LOVERING AM, HOVSEPIAN L. Pharmacokinetic evaluation of linezolid inpatients with major thermal injuries[J]. J Antimicrob Chemother, 2009, 63(3): 553. DOI:10.1093/jac/dkn541 |
| [21] |
MORATA L, GÓMEZ-CERQUERA JM, MANZANEDO L, et al. Risk factors associated with high linezolid through plasma concentrations[J]. Expert Opin Pharmacother, 2016, 17(9): 1183. DOI:10.1080/14656566.2016.1182154 |
 2017, Vol. 37
2017, Vol. 37 
