2. 苏州大学, 苏州 215123;
3. 中国药科大学, 南京 211198
2. Soochew University, Suzhou 215123, China;
3. China Pharmaceutical University, Nanjing 211198, China
地塞米松和倍他米松属于甾体类糖皮质激素,两者互为同分异构体[1],具有抗炎抗过敏等作用,临床可用于治疗湿疹,过敏性皮炎等皮肤疾病,但因其适应症、禁忌症和不良反应而具有严格的用药剂量、频率和疗程等[2],不当的长期使用会对患者的身体健康造成损害。近年来,常发现有糖皮质激素类药物被非法添加到一些化妆品、药用软膏制剂中[3-4],以增强产品疗效,但需要严格控制用量,且对检测方法要求较高,以保障结果的准确性。
受苏州某企业生产的委托,对其生产的一款抗菌乳膏进行地塞米松痕量检测方法研究,发现原企业及检测机构的检测方法专属性不强,易导致结果误判。本文对原方法进行解析、改进和优化,建立了专属性强、灵敏度高的超高效液相色谱-串联质谱定性定量分析方法,可精确检出抗菌乳膏中痕量的地塞米松和倍他米松,为严格监控抗菌乳膏类制剂的质量提供了技术参考。
1 仪器和试药 1.1 仪器Acquity UPLC Xevo TQ-S超高效液相色谱串联三重四极杆质谱仪及Masslynx4.1工作站(美国Waters公司);Shim-pack XR-ODSⅢ色谱柱(1.6 μm,50 mm×2.0 mm,岛津技迩公司;填料:十八烷基硅烷键合硅胶);XS205dual电子天平(梅特勒-托利多仪器有限公司);Reaxtop漩涡振荡器(Heidoph公司);PRZMOR低温离心机(赛默飞世尔上海仪器有限公司);Milli-Q纯水仪(美国Millipore公司);Oasis HLB固相萃取小柱(规格:60 mg,3 cc批号:133A35196A,美国Waters公司);萃取装置(SUPELCO公司)。
1.2 试药地塞米松对照品,纯度99.7%,批号:100129-201105;倍他米松对照品,纯度99.3%,批号:100118-201204;均购自中国食品药品检定研究院;泼尼松对照品,纯度99.5%,批号:10305,购自Dr.Ehrenstorfer GmbH;抗菌乳膏供试品(江苏奇力康皮肤药业有限公司委托三批供试品T-1、T-2、T-3和市售一批复方酮康唑软膏T-4);甲醇、乙腈为LC-MS级色谱纯,Fluka公司;氯化钠,亚铁氰化钾,无水乙酸锌均为分析纯;纯化水为Milli-Q纯水仪产生,临用新取。
2 实验方法 2.1 液质联用条件 2.1.1 色谱条件采用Shim-pack XR-ODS Ⅲ(1.6 μm,50 mm×2.0 mm)色谱柱,以乙腈(A)-水(B)为流动相,梯度洗脱,0~1 min,20% A;1~10 min,20% A→30% A;10~10.5 min,30% A→95% A;10.5~12 min,95% A;12~12.01 min,95% A→20% A;12.01~14 min,20% A。流速为0.4 mL·min-1,柱温为40 ℃,样品室温度为10 ℃,进样量为2 μL。
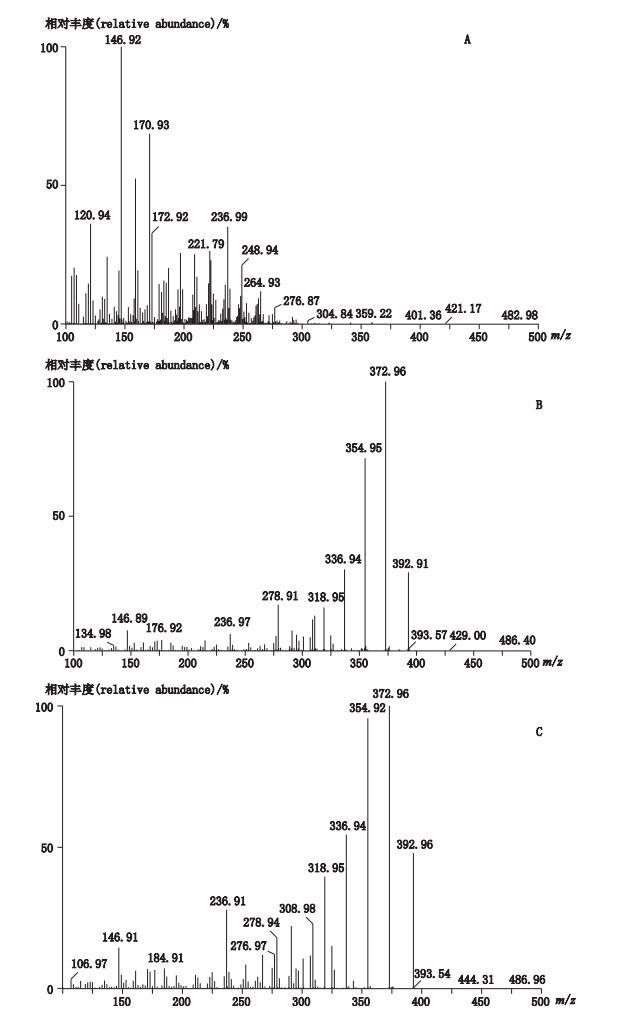
2.1.2 质谱条件电喷雾离子源(ESI源),正离子扫描模式,多反应离子监测(MRM,参数见表 1),毛细管电压3.5 kV,离子源温度120 ℃,脱溶剂温度450 ℃,脱溶剂气流速600 L·h-1,锥孔氮气流速150 L·h-1。图 1为泼尼松、倍他米松、地塞米松二级质谱扫描图。
|
|
表 1 地塞米松、倍他米松、泼尼松MRM数据采集质谱参数 Table 1 The mass spectrometry parameters of dexamethasone, betamethasone and prednisone |
|
A.泼尼松(prednisone)B.倍他米松(betamethasone)C.地塞米松(dexamethasone) 图 1 泼尼松、倍他米松、地塞米松二级质谱扫描图 Figure 1 MS/MS scan spectra of prednisone, dexamethasone and betamethasone |
精密称取地塞米松10.29 mg,倍他米松10.48 mg,置100 mL量瓶中,用甲醇溶解并定容,作为混合对照品母液。精密吸取400 μL母液于10 mL量瓶中,用甲醇溶解并定容,逐级稀释,制备混合对照储备液(地塞米松浓度为0.051 3、0.256、0.513、1.026、2.052 μg·mL-1;倍他米松浓度为0.052、0.260、0.520、1.041、2.081 μg·mL-1)。
2.2.2 内标物储备液精密称取泼尼松10.15 mg,置100 mL量瓶中,用甲醇溶解并定容,使成101.0 μg·mL-1溶液,再吸取100 μL于10 mL量瓶中,用甲醇稀释定容,使成1.010 μg·mL-1的内标储备液。
2.3 供试品处理[5]取供试品约0.2 g,精密称定,于15 mL具塞塑料离心管中,加入泼尼松内标储备液100 μL,饱和氯化钠溶液3 mL,涡旋混合,使样品分散,加入2 mL乙腈,涡旋提取2 min,5 000 r·min-1离心10 min,吸取上清液于50 mL具塞塑料离心管中;再准确加入2 mL乙腈,将下层氯化钠溶液重复提取步骤一次,合并二次提取液,加入40 mL纯化水,混匀,加入10%亚铁氰化钾溶液200 μL和20%乙酸锌溶液200 μL,再次混匀,5 000 r·min-1离心10 min,清液待SPE小柱净化。
Waters Oasis® HLB固相萃取小柱(60 mg,3 cc)接上固相萃取装置,小柱上端紧密连接一20 mL磨口漏斗,将待净化的供试品清液倒入漏斗,经过滤后流经小柱,待供试品清液自然流尽后,用乙腈水溶液(1→10)10 mL清洗小柱,待乙腈水溶液自然流尽后,吹出固相萃取小柱中残留溶液。在小柱底部接一15 mL离心管,用4 mL甲醇冲洗萃取小柱,待甲醇自然流尽后,吹出小柱中残留溶液。取下离心管,甲醇定容至5 mL,经12 000 r·min-1离心10 min,取上清液作为供试品溶液。
2.4 方法学考察 2.4.1 系统适用性试验和专属性试验取空白样品0.2 g,不加内标,按“2.3”项进行样品处理,得空白基质液。另取空白样品0.2 g,加入“2.2.1”项下约1 μg·mL-1的混合对照品储备液100 μL和泼尼松内标储备液100 μL,按“2.3”项进行处理,得供试品溶液。按“2.1”项下液质联用条件进样,记录色谱图(见图 2)。结果表明,空白基质对地塞米松和倍他米松的测定无干扰。地塞米松峰理论板数为25 605;倍他米松峰理论板数23 707;泼尼松理论板数为11 324。地塞米松和倍他米松的保留时间分别为6.88、6.67 min,两者分离度为1.3。四极杆质谱分辨率以地塞米松半峰宽计为0.75,质量准确度以地塞米松计为-0.3 u。
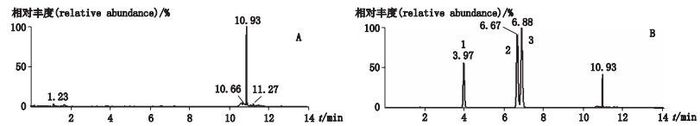
|
1.泼尼松(prednisone)2.倍他米松(betamethasone)3.地塞米松(dexamethasone) A.空白基质提取液(extraction of blank matrix)B.空白基质加药物和内标的提取液(extraction of blank matrix with spiked prednisone,betamethasone and dexamethasone) 图 2 空白基质提取液和空白基质加药物和内标提取液MRM图 Figure 2 MRM chromatograms of extractions of blank matrix and blank matrix with spiked prednisone, betamethasone and dexamethasone |
取空白样品0.2 g,分别加入“2.2.1”项下的混合对照品储备液各100 μL和“2.2.2”项下泼尼松内标储备液100 μL,按“2.3”项下供试品前处理方法操作,甲醇定容至5 mL,得系列标准曲线溶液(地塞米松实际浓度为1.026、5.13、10.26、20.52、41.04 ng·mL-1;倍他米松实际浓度为1.041、5.20、10.41、20.81、41.62 ng·mL-1)。按“2.1”项下液质联用条件进样,记录色谱图。以地塞米松与内标泼尼松质量浓度比值(X)为横坐标、地塞米松定量离子峰面积与内标泼尼松峰面积比值(Y)为纵坐标,用加权(W=1/X)最小二乘法进行回归运算,得地塞米松回归方程:
Y=2.136X-0.031 5 r2=0.997 8(n=3)
以倍他米松与内标泼尼松质量浓度比值(X)为横坐标、倍他米松定量离子峰面积与内标泼尼松峰面积比值(Y)为纵坐标,用加权(W=1/X)最小二乘法进行回归运算,得倍他米松回归方程为:
Y=2.272X-0.037 6 r2=0.998 1(n=3)
结果表明,地塞米松和倍他米松在1~41 ng·mL-1浓度范围内呈良好的线性关系。
2.4.3 方法回收率和精密度取空白样品0.2 g,加入“2.2.1”项下浓度约为0.05、1.0、2.0 μg·mL-1的地塞米松和倍他米松混合对照品储备液100 μL,及“2.2.2”项下泼尼松内标储备液100 μL,按“2.3”项下供试品处理方法进行样品处理,制成低、中、高3个浓度分别约为1、20、40 ng·mL-1的质控样品,每一浓度平行处理3份,按“2.1”项下液质联用条件进样,记录色谱图。以实测浓度与质控样品标示浓度之比计算方法回收率,结果见表 2。由表 2可知,地塞米松和倍他米松的方法回收率均在100%~108%之间。
|
|
表 2 地塞米松与倍他米松方法回收率(n=3) Table 2 Recovery results of the method for dexamethasone and betamethasone |
取上述低、中、高3个浓度质控样品各1份,每一份连续进样6次,按随行标曲计算地塞米松和倍他米松实测浓度,计算日内精密度;将上述样品连续测定3 d,按随行标曲计算地塞米松和倍他米松实测浓度,计算日间精密度。结果(见表 3)表明该方法日内精密度和日间精密度良好。
|
|
表 3 日内精密度和日间精密度 Table 3 Intraday and interday precision data for the determination of dexamethasone and betamethasone. |
取空白样品0.2 g,内标溶液以100 μL甲醇替代,按“2.3”项下供试品处理方法处理,得到空白基质溶液。在空白基质溶液中分别加入“2.2.1”项下的地塞米松和倍他米松浓度约为0.05、1、2 μg·mL-1混合对照品储备液各100 μL及“2.2.2”项下泼尼松内标储备液100 μL,甲醇定容至5 mL,制成低、中、高3个浓度分别约为1、20、40 ng·mL-1的空白基质加标样品,每一浓度制备3份;另配制与基质加标样品浓度相等的低、中、高加标混合对照品溶液,按“2.1”项下液质联用条件进样分析。以基质加标样品中地塞米松、倍他米松及泼尼松定量离子峰面积与相应浓度的混合对照品溶液中对应成分的峰面积之比,分别计算三者的基质效应,结果见表 4,泼尼松的基质效应略强于地塞米松和倍他米松。
|
|
表 4 地塞米松、倍他米松和泼尼松的基质效应(n=3) Table 4 Matrix effect of dexamethasone, betamethasone and prednisone |
取“2.4.3”方法回收率项下低、中、高3个浓度的质控样品(n=3)和“2.4.4”基质效应项下对应的低、中、高3个浓度的基质加标样品(n=3),按照“2.1”项下液质联用条件进样分析,记录色谱图。以质控样品中药物的峰面积与相应浓度基质加标样品溶液中对应成分的峰面积之比,分别计算地塞米松、倍他米松和泼尼松的提取回收率,结果见表 5,地塞米松、倍他米松和泼尼松的提取率基本一致,约为81%~86%。
|
|
表 5 地塞米松、倍他米松和泼尼松提取回收率(n=3) Table 5 Extraction recoveries of dexamethasone, betamethasone and Prednisone |
取“2.4.3”方法回收率项下高、中、低浓度质控样品,分别于样品室10 ℃放置0、24 h,2~10 ℃放置20 d后按“2.1”项下液质联用条件进样分析。以随行加标曲线计算浓度,结果表明供试品中地塞米松和倍他米松在两种条件下的稳定性均良好(结果见表 6)。
|
|
表 6 地塞米松和倍他米松稳定性试验结果(n=3) Table 6 Stability results of the determination for dexamethasone and betamethasone |
取空白样品0.2 g,精密称定,加入地塞米松和倍他米松浓度均约为0.025 μg·mL-1的混合对照储备液100 μL,及泼尼松内标储备液100 μL,按“2.3”项下供试品处理方法处理,制成终浓度约为0.5 ng·mL-1的供试品溶液,进样分析,记录地塞米松和倍他米松的信噪比。结果表明,地塞米松S/N=20,倍他米松S/N=16(按peak to peak计算)。地塞米松和倍他米松定量限在12.5 μg·kg-1附近。
2.4.8 检出限取空白样品0.2 g,精密称定,加入地塞米松和倍他米松浓度均约为0.01 μg·mL-1的混合对照储备液100 μL,及泼尼松内标储备液100 μL,按“2.3”项下供试品处理方法处理,制成终浓度为0.2 ng·mL-1的供试品溶液,进样分析,记录地塞米松和倍他米松的信噪比。结果表明,地塞米松S/N=5,倍他米松S/N=6。地塞米松和倍他米松检出限为5 μg·kg-1。
2.5 样品检测取3批厂家委托及1批市售的抗菌乳膏制剂,按上述方法进行检测分析,用随行工作曲线计算地塞米松和倍他米松的含量,结果见表 7和图 3。4批抗菌乳膏制剂均检出倍他米松,其中2批检出地塞米松,但均低于定量限。
|
|
表 7 抗菌乳膏制剂检测结果 Table 7 Determination results of sample creams of antimicrobial agent |
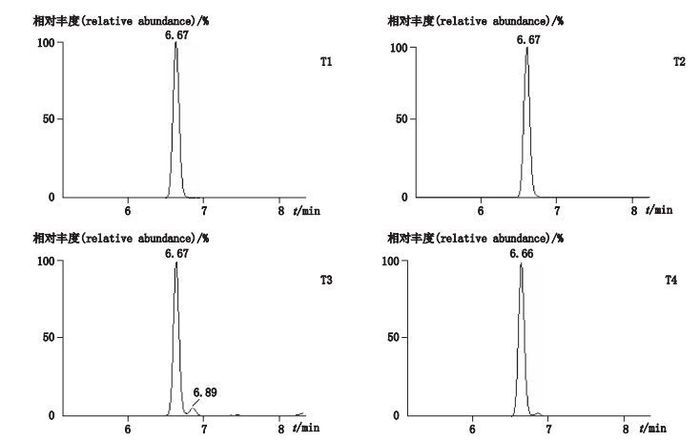
|
图 3 4批抗菌乳膏制剂检测结果MRM图 Figure 3 MRM chromatograms of four sample creams of antimicrobial agent |
按照企业提供标准对该抗菌乳膏进行质谱检测,首次进样为阳性检出,之后进样呈未检出。经研究发现,当乳膏制剂仅以甲醇提取时,其富含的表面活性剂易残留在提取液中,进入质谱系统,抑制被测物离子,出现强烈的基质抑制效应,掩盖被测物信号,造成假阴性结果。本文采用饱和氯化钠溶液分散乳膏基质,用乙腈从分散液中提取药物,并选用10%亚铁氰化钾溶液和20%乙酸锌溶液作为澄清剂,对乳膏基质中的大分子杂质先进行物理絮凝、沉淀,提取液再经过Waters Oasis® HLB固相萃取小柱富集净化[9],可有效去除乳膏基质,提高被测物浓度,并大幅度减小基质抑制效应,提高了方法灵敏度,并且避免了假阴性结果。
3.2 梯度洗脱区分地塞米松和倍他米松地塞米松和倍他米松为差向异构体[7],两者仅16位碳的手性结构不同,理化性质相似,但药理药效存在差别,等度洗脱难以区分。某检测机构对该抗菌乳膏的检测结果判定为检出地塞米松,本文利用梯度洗脱对地塞米松和倍他米松进行物理分离,并通过与对照品比较,结果判定为检出倍他米松。在质谱分析中,由于地塞米松和倍他米松的母离子均为[M+H]+m/z 393.0,子离子均为[M+H-HF]+m/z 373.0和[M+H-HF-H2O]+m/z 355.0,两者的特征离子对完全一样,因此只能通过其保留时间来对二者进行区分。
3.3 内标法和内标物的选择由于乳膏制剂样品前处理步骤较为复杂,且目标物检出量属于痕量范围,用外标法测定结果重复性较差。内标法可基本消除提取过程中被测物损失影响,同时规避质谱检测过程中仪器响应波动的影响[10-11],保证实验结果的准确性和重复性。本次实验结果显示内标物泼尼松的基质抑制效应略强于倍他米松和地塞米松,但提取率与倍他米松和地塞米松基本一致,可以采用泼尼松为内标物,工作曲线内标法进行样品测定,结果准确可靠。
3.4 实验结果分析企业委托及市售抗菌乳膏制剂中均检出倍他米松,厂家委托的一批产品和市售乳膏检出地塞米松,但两者含量均很低,常规用法下远低于临床有效剂量,推断该厂家的抗菌乳膏制剂未蓄意非法添加激素类药物,可能与生产环节中的交叉污染有关。建议生产企业加强原辅料质量监控,生产工艺流程监控。该方法的建立能够提供技术支持,并为抗菌乳膏剂非法添加激素类药物的质谱检测提供技术参考。
| [1] |
杨腊虎, 许鸣镝, 施亚琴, 等. 地塞米松同分异构体的结构分析[A]. 色谱分析在药物分析中的应用专题学术研讨会论文集. 北京: 药物分析杂志. 2004年, 153 YANG LH, XU MD, SHI YQ, et al. Determination of Dexamethasone Isomer by Thermal Analysis IR, X-ray, MS, NMR[A]. Symposium on application of chromatographic analysis to pharmaceutical analysis[C]. Beijing: Chin J Pharm Anal. 2004, 153 |
| [2] |
吴志华, 郭红卫. 糖皮质激素作用机制进展及在皮肤科中的应用[J]. 皮肤病与性病, 2011, 33(6): 321. WU ZH, GUO HW. Progress on mechanism of glucocorticoids and its application in dermatitis[J]. Chin J Derm Venereol, 2011, 33(6): 321. |
| [3] |
罗辉泰, 黄晓兰, 吴惠勤, 等. 固相萃取/液相色谱-串联质谱法同时测定面膜类化妆品中非法添加的53种糖皮质激素[J]. 分析测试学报, 2016, 35(2): 119. LUO HT, HUANG XL, WU HQ, et al. Simultaneous determination of 53 kinds of glucocorticoids illegally added in facial mask cosmetics by solid-phase extraction with liquid chromatography-tandem mass spectrometry[J]. Chin J Instrum Anal, 2016, 35(2): 119. |
| [4] |
潘军. HPLC法筛查中药软膏制剂中非法添加的17种糖皮质激素[J]. 中成药, 2016, 36(11): 2323. PAN J. Rapid screening of adulteration of 17 kinds of glucocorticoids in herbal ointments by HPLC[J]. Chin Tradit Pate Med, 2016, 36(11): 2323. |
| [5] |
GBT 24800. 2-2009化妆品中四十一种糖皮质激素的测定液相色谱/串联质谱法和薄层层析法[S]. 2009GBT 24800. 2-2009 Determination of 41 glucocorticoids in cosmetics by LC-MS/MS and TLC method[S]. 2009 |
| [6] |
姚梦侃, 马秉亮, 马越鸣. 生物样品液质联用分析中的基质效应研究概况[J]. 药物分析杂志, 2010, 30(12): 2436. YAO MK, MA BL, MA YM. Overview of the matrix effect in quantitative liquid chromatography/mass spectrometry analysis of biological samples[J]. Chin J Pharm Anal, 2010, 30(12): 2436. |
| [7] |
王立琦, 贺利民, 曾振灵, 等. 液相色谱-串联质谱检测兽药残留中的基质效应研究进展[J]. 质谱学报, 2011, 32(6): 321. WANG LQ, HE LM, ZENG ZL, et al. Progress on matrix effect of Veterinary drug residues analysis by high-performance liquid chromatography-tandem mass spectrometry[J]. J Chin Mass Spec Soc, 2011, 32(6): 321. |
| [8] |
陈晨, 李霞, 董琦鑫, 等. 4种前处理方法对LC-MS/MS测定人血浆中卤米松基质效应的影响[J]. 中国临床药学杂志, 2013, 22(4): 216. CHEN C, LI X, DONG QX, et al. Influence of four pretreatment methods on matrix effect of halometasone in human plasma by LC-MS/MS[J]. Chin J Clin Pharm, 2013, 22(4): 216. |
| [9] |
王伟萍, 张明玥, 蔺娟, 等. 超高效液相色谱-串联质谱法同时测定化妆品中21种糖皮质激素[J]. 药物分析杂志, 2013, 33(5): 837. WANG WP, ZHANG MY, LIN J, et al. UPLC-MS/MS determination of 21 glucocorticoids in cosmetics[J]. Chin J Pharm Anal, 2013, 33(5): 837. |
| [10] |
盛龙生, 苏焕华, 郭丹滨. 色谱质谱联用技术[M]. 北京: 化学工业出版社, 2010: 104. SHENG LS, SU HH, GUO DB. Technology of Liquid Chromatography-Tandem Mass Spectrometry[M]. Beijing: Chemical Industry Press, 2010: 104. |
| [11] |
李存, 吴银良, 杨挺. 同位素稀释高效液相色谱串联质谱法测定猪肝中地塞米松和倍他米松残留量[J]. 分析化学, 2010, 38(2): 271. LI C, WU YL, YANG T. Simultaneous determination of dexamethasone and betamethasone in Swine liver by high performance liquid chromatography-tandem mass spectrometry with isotope dilution[J]. Chin J Anal Chem, 2010, 38(2): 271. |
 2017, Vol. 37
2017, Vol. 37 
