2. 安徽省食品药品检验研究院, 合肥 230051
2. Anhui Institute for Food and Drug Control, Hefei 230051, China
蛇胆汁是一味名贵的中药材,主要成分为胆酸类成分[1-2],具有清热、解毒、镇咳、化痰、抗炎等作用[3-6]。2015年版中国药典四部[7]记载,蛇胆汁为眼镜蛇科、游蛇科或蝰科动物多种蛇的胆汁。目前,蛇胆汁药材及其相关制剂多以牛磺胆酸钠作为质量控制指标,定量分析方法大多采用高效液相色谱法[8-12],由于牛磺胆酸钠中不含共轭基团,仅有末端吸收,采用紫外检测器检测,色谱图中峰响应较低。也有研究者采用HPLC-ELSD法对牛黄胆酸钠进行含量测定[13]。本实验建立了HPLC-CAD法测定蛇胆汁中牛磺胆酸钠的含量并进行了方法学验证,与UV、ELSD进行比较,结果显示,CAD的灵敏度高于UV与ELSD。
1 仪器与试药 1.1 仪器Ultimate 3000液相色谱仪(美国Dionex公司)配备Corona Ultra电雾式检测器及Chromeleon7.1色谱工作站,蒸发光检测器(美国Dionex公司ELSD6000),紫外检测器(美国Dionex公司DAD),分析天平(Mettler Toledo XP26),超声仪(Elmasonic S),Millipore Simplicity-185型超纯水仪(美国Millipore公司)。ZORBAX SB C18色谱柱(填料:十八烷基硅烷键合硅胶;4.6 mm×250 mm,5 μm)。
1.2 试药牛磺胆酸钠对照品(中国食品药品检定研究院,批号:110815-201308,含量为88.9%);蛇胆汁样品12批分别为眼镜蛇科:眼镜蛇、金环蛇、银环蛇、眼镜王蛇;游蛇科:三索线蛇、乌梢蛇、灰鼠蛇、滑鼠蛇、王锦蛇;蝰蛇科:蕲蛇、蝮蛇、竹叶青(江西余江县安仁养蛇场,采集地:广州)。乙腈(质谱级),甲醇(色谱级),水为实验室专用超纯水机制备的超纯水,其他试剂均为分析纯。
2 方法和结果 2.1 溶液制备 2.1.1 对照品溶液取牛磺胆酸钠对照品适量,精密称定,加甲醇制成每1 mL含0.2 mg的溶液,即得。
2.1.2 供试品溶液取蛇胆汁样品约0.1 g,精密称定,置10 mL量瓶中,加流动相8 mL,超声(300 W,120 Hz)处理5 min,放冷,加流动相稀释至刻度,摇匀,滤过,取续滤液,即得。
2.1.3 阴性供试品溶液按2015年版中国药典四部[7]制备工艺配制缺失蛇胆汁的阴性样品,按“2.1.2”项下方法制备供试品溶液,即得。
2.2 色谱条件与系统适用性试验ZORBAX SB-C18色谱柱(4.6mm×250 mm,5 μm);流动相:乙腈-0.1%三氟乙酸水(30:70);等度洗脱,流速:1.0 mL·min-1;柱温:35 ℃,紫外检测器:检测波长为203 nm;蒸发光检测器:漂移管温度105 ℃、气体流速2.5 L·min-1;电雾式检测器:雾化温度为35 ℃、气源为N2、压力4.206×105Pa。在此条件下,对照品溶液色谱主峰位置上,供试品溶液具有保留时间相同的色谱峰,阴性供试品溶液则无此峰,表明样品中其他成分对牛磺胆酸钠的测定无干扰。色谱图见图 1。
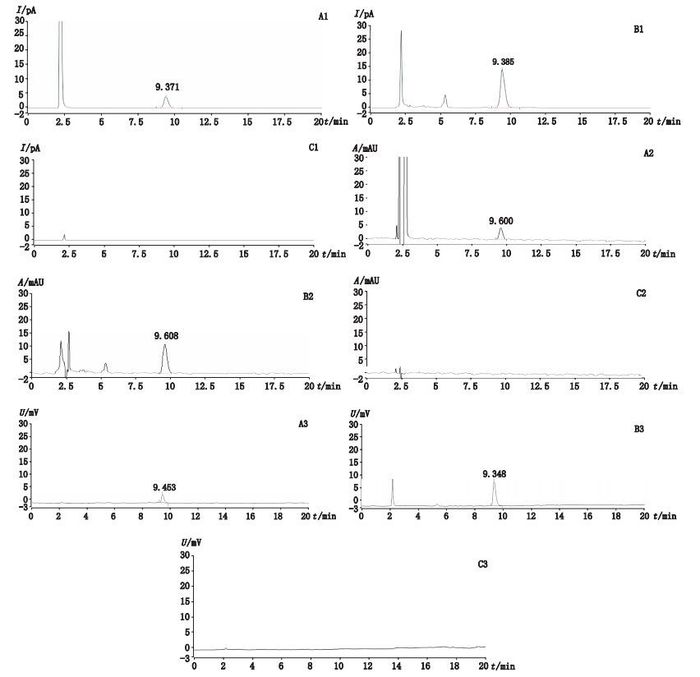
|
图 1 HPLC-CAD对照品溶液(A1)、供试品溶液(B1)以及阴性供试品溶液(C1),HPLC-UV对照品溶液(A2)、供试品溶液(B2)以及阴性供试品溶液(C2),HPLC-ELSD对照品溶液(A3)、供试品溶液(B3)以及阴性供试品溶液(C3)色谱图 Figure 1 HPLC-CAD Chromatograms of reference solution(A1), sample solution(B1) and negative solution(C1), HPLC-UV Chromatograms of reference solution(A2), sample solution(B2) and negative solution(C2), HPLC-ELSD Chromatograms of reference solution(A3), sample solution(B3) and negative solution(C3) |
精密称取牛磺胆酸钠对照品,分别用乙腈-0.1%三氟乙酸水(30:70)制成0.174 2、0.871、1.742、2.613、3.484 mg·mL-1的溶液,精密量取上述5种浓度溶液各10 μL,分别注入液相色谱仪,采用CAD进行分析。以色谱峰峰面积Y与对应浓度X进行线性回归,回归方程为:
Y=1.620X+0.152 4 r=0.999 5
结果表明,使用CAD牛磺胆酸钠在0.174 2~3.484 μg范围内质量浓度与峰面积呈线性关系,且线性关系良好。
2.3.2 检测下限与定量下限的测定取“2.1.1”项下对照品储备液,逐级稀释,分别采用UV、ELSD、CAD进样10 μL,测定峰面积,以信噪比3倍为最低检测线,信噪比10倍为最低定量限,测量结果见表 1。
|
|
表 1 检测限与定量限测定结果 Table 1 Determination results of LOD and LOQ |
精密量取同一对照品溶液8 μL,连续进样6次依法测定,结果RSD为0.86%(n=5),表明仪器精密度良好。
2.3.4 稳定性试验取同一供试品溶液,于配制后0、3、6、12、24 h时分别量取10 μL,注入液相色谱仪,测定峰面积RSD为0.81%(n=5),表明样品在24 h内稳定。
2.3.5 重复性试验称取蛇胆汁样品,照“2.1.2”项下方法共制备6份供试品溶液,分别取10 μL注入液相色谱仪,测定含量。结果蛇胆汁平均含量为23.374 1 mg·g-1,RSD为1.7%(n=6),表明该方法重复性良好。
2.3.6 回收率试验精密称取蛇胆汁样品约0.05 g,6份,加入牛磺胆酸钠(质量浓度为0.233 7 g·L-1)对照品5 mL,再加流动相定容至刻度,摇匀,滤过,取续滤液,即得。各取10 μL注入液相色谱仪,测定含量,计算加样回收率,测定结果见表 2。
|
|
表 2 回收率试验结果(n=6) Table 2 Results of recovery |
取不同批次蛇胆汁,按“2.1.2”项下方法制备供试品溶液,分别精密吸取供试品溶液10 μL,注入液相色谱仪,测定峰面积,计算含量,结果见表 3。
|
|
表 3 样品含量测定结果(mg·g-1) Table 3 Determination results of sample content |
牛磺胆酸钠为蛇胆汁的主要成分,目前对牛磺胆酸钠的含量测定大多采用UV检测器,在实际试验过程中具有峰响应低,噪音大,基线不平等难以解决的影响因素[14]。ELSD检测器是通用型检测器,受光折射、散射和耐热性的影响。由表 1可以看出ELSD检测器灵敏度低于CAD,CAD是一种新型通用检测器,它完全不依赖于化合物的分子结构,能对大多数化合物提供一致响应性,同时能达到较高的灵敏度和低检测极限,其重现性、稳定性很好,对于紫外末端吸收的物质进行含量测定具有一定的优越性。
3.2 流动相基于CAD雾化检测器的原理[15],洗脱液经雾化后形成颗粒,经过漂移管干燥后与带电氮气碰撞,使得目标化合物带上正电荷,最后,通过静电计测量电荷的量,所以应避免采用缓冲盐作为流动相,尽可能使用低浓度挥发性酸,本实验通过比较乙腈-0.5%醋酸水(30:70)与乙腈-0.1%三氟乙酸水(30:70)不同流动相,结果显示,采用乙腈-0.1%三氟乙酸水(30:70)系统的色谱峰峰型好,色谱峰灵敏度高,且所选用流动相基线噪音小,分离效果好,因此选用乙腈-0.1%三氟乙酸水(30:70)作为流动相。
3.3 氮气CAD气源选择是高纯氮气,氮气主要起到雾化,带电以及输送的作用,在实验过程中控制氮气压力在3.447×105~4.826×105 Pa之间,重复性良好。
3.4 样品含量本研究测定的蛇胆汁药材分别为眼镜蛇科动物,游蛇科动物以及蝰科动物多种蛇的胆汁,本实验中测得眼镜蛇科牛磺胆酸钠含量范围:5.69~28.85 mg;游蛇科含量范围:23.37~29.65 mg;蝰科含量范围:6.54~24.00 mg。结果表明,游蛇科蛇胆汁中牛磺胆酸钠含量相对较高,眼镜蛇科与游蛇科之所以含量差距大,可能因为不同蛇胆大小不一,胆囊相对大的含量一般高于胆囊小的,因此建议企业投料生产时采用游蛇科动物胆汁或者选取胆囊相对较大的蛇胆汁。
| [1] |
游元元, 万德光. 动物胆汁药用研究进展[J]. 贵阳中医学院学报, 2007, 27(4): 58. YOU YY, WAN DG. Research progress of medicinal animal bile[J]. J Guiyang Coll Tradit Chin Med, 2007, 27(4): 58. |
| [2] |
刘永贵, 袁琪. 蛇胆的成分分析及临床应用[J]. 湖北中医杂志, 2017, 39(3): 54. LIU YG, YUAN Q. Composition analysis and clinical application of snake gall[J]. J Hubei Tradit Chin Med, 2017, 39(3): 54. |
| [3] |
孙慧玲, 李昌勤. 蛇胆的药理作用及应用[J]. 西北药学杂志, 2004, 19(6): 285. SUN HL, LI CQ. The pharmacological effects and application of snake gall[J]. Northwest Pharm J, 2004, 19(6): 285. |
| [4] |
王奕, 王修性. 蛇胆酒的主要成分及其药理作用[J]. 中国药业, 2004, 13(10): 76. WANG Y, WANG XX. The main ingredients and pharmacological effects of snake gall alcohol[J]. China Pharm, 2004, 13(10): 76. DOI:10.3969/j.issn.1006-4931.2004.10.061 |
| [5] |
黄敬辉, 仇洁, 黄坚伟. 热压处理后蛇胆的药理作用研究[J]. 中药材, 1998, 19(1): 29. HUANG JH, QIU J, HUANG JW. Pharmacologic studies on procrssed snake gall[J]. J Chin Med Mater, 1998, 19(1): 29. |
| [6] |
尚雪原, 张世玲, 焦波, 等. 枸杞蛇胆酒的药理作用研究[J]. 中草药, 1996, 27(1): 32. SHANG XY, ZHANG SL, JIAO B, et al. The pharmacological action research Chinese wolfberry snake gall wine[J]. Chin Tradit Herb Drugs, 1996, 27(1): 32. |
| [7] |
中国药典2015年版. 四部[S]. 2015: 423 ChP 2015. Vol Ⅳ[S]. 2015: 423 |
| [8] |
岑淑姬. 高效液相色谱法测定蛇胆陈皮散中牛磺胆酸钠含量[J]. 中国药业, 2007, 16(19): 30. CEN SJ. Determination of sodium taurocholate in Shedanchenpi powder by HPLC[J]. China Pharm, 2007, 16(19): 30. DOI:10.3969/j.issn.1006-4931.2007.19.024 |
| [9] |
余良忠, 虞金宝, 吕武清. HPLC测定蛇胆川贝胶囊中牛磺胆酸钠的含量[J]. 中成药, 2006, 29(8): 1240. YU LZ, YU JB, LÜ WQ. Determination of sodium taurocholate in shedanchuanbei capsules by HPLC[J]. Chin Tradit Pat Med, 2006, 29(8): 1240. |
| [10] |
欧国灯, 莫结丽, 阮桂平, 等. HPLC法测定牛黄蛇胆川贝胶囊中牛磺胆酸钠的含量[J]. 中药材, 2002, 25(7): 506. OU GD, MO JL, RUAN GP, et al. Determination of sodium taurocholate in Niuhuangshedanchuanbei capsules by HPLC[J]. J Chin Med Mater, 2002, 25(7): 506. |
| [11] |
钟然, 魏献春. HPLC法测定蛇胆中牛磺胆酸钠的含量[J]. 中药材, 2000, 23(9): 550. ZHONG R, WEI XC. Determination of sodium taurocholate in snake bile by HPLC[J]. J Chin Med Mater, 2000, 23(9): 550. |
| [12] |
刘卓妍, 董元伟, 李信炯, 等. 高效液相法测定蛇胆及蛇胆川贝液中牛磺胆酸的含量[J]. 中成药, 1994, 17(2): 13. LIU ZY, DONG YW, LI XJ, et al. Determination of sodium taurocholate in snake gall and Shedan Chuanbei solution by HPLC[J]. Chin Tradit Pat Med, 1994, 17(2): 13. |
| [13] |
黄玉华, 丘明明. HPLC-ELSD法测定蛇胆川贝液中牛磺胆酸钠的含量[J]. 中国药师, 2010, 13(11): 1632. HUANG YH, QIU MM. Determination of sodium taurocholate in Shedan Chuanbei solution by HPLC-ELSD[J]. China Pharm, 2010, 13(11): 1632. DOI:10.3969/j.issn.1008-049X.2010.11.040 |
| [14] |
郑天骄, 石岩, 张文娟, 等. 蛇胆汁及相关制剂质量控制方法研究进展[J]. 亚太传统医药, 2016, 12(10): 36. ZHENG TJ, SHI Y, ZHANG WJ, et al. Research progress of quality control methods of snake bile and related preparations[J]. Asia-Pacific Tradit Med, 2016, 12(10): 36. |
| [15] |
李晗, 龚伟, 张慧, 等. HPLC-电喷雾检测器法测定长春瑞滨热敏脂质体中溶血磷脂含量[J]. 中国新药杂志, 2014, 23(13): 1493. LI H, GONG W, ZHANG H, et al. Determination of lysolipid in vinorelbine liposome for injection by HPLC-charged aerosol detector[J]. Chin J New Drugs, 2014, 23(13): 1493. |
 2017, Vol. 37
2017, Vol. 37 
