2. 江西中医药大学, 南昌 330004
2. Jiangxi Hanhe Biotechnology Co.Ltd., Nanchang 330004, China
黄嘌呤氧化酶(xanthine oxidase,XOD)是一种含Mo、[2Fe-2S]和FAD+活性中心的黄素酶,可催化嘌呤类物质生成尿酸,是体内尿酸生成的关键酶。长期尿酸浓度过高可诱发高尿酸血症和痛风。XOD是目前痛风及高尿酸血症防治的重要靶点,抑制其活性可有效减少尿酸的生成[1],但现有黄嘌呤氧化酶抑制剂(xanthine oxidase inhibitor,XODI)药物别嘌呤醇及非布索坦等虽疗效尚可,然易引发皮疹、肾功能衰退、心血管疾病等毒副作用[2]。来源于天然产物的XODI疗效显著,毒副作用低,安全性高[3-5],已成为当前研究热点。
目前XODI体外筛选方法主要有紫外分光光度法[6]、HPLC法[7]、质谱法[8],都是通过检测尿酸的生成量间接测定化合物的活性。这些筛选方法往往所需样品用量大且易引起假性结果[7],存在较大不足。本课题组前期研究表明车前子提取物在体内具有显著降低血清尿酸水平作用,其机理与抑制XOD活性密切相关,但其物质基础不明确,有待进一步研究。
电化学生物传感器是以酶、细胞、组织为敏感元件,以电极为转换器、以电势或电流为特征检测信号的传感器,在筛选XODI时具有简单、快速灵敏等特点[9]。本研究以XOD为靶点,运用电化学生物传感法对课题组前期从车前子中分离得到的23个化合物进行XODI的初步筛选,以期筛选出高效低毒的黄嘌呤氧化酶抑制剂,为车前子抗痛风药物的开发应用提供参考依据。
1 实验部分 1.1 仪器与试剂Autolab多通道电化学工作站(瑞士万通有限公司);FEI Nova Nano SEM 450场发射电镜(美国);红外干燥箱(上海锦屏仪器仪表有限公司);实验采用三电极体系:玻碳电极(GCE,直径3 mm)为工作电极,Ag|AgCl|KCl(AE,3 mol·L-1)为参比电极,铂丝为对电极。
黄嘌呤(xanthine,XAN)、XOD(EC 1.17.3.2,I型,12.1 U·mg-1)均购于南京建成生物有限公司;别嘌呤醇(AP),购于Sigma公司;双壁碳纳米管(DWNTs,纯度大于97%)购于深圳纳米港责任有限公司;磷酸缓冲溶液(PBS,1/15 mol·L-1,pH=5.3);其他试剂为分析纯,实验用水均为二次蒸馏水。
筛选所用化合物为毛蕊花糖苷、异毛蕊花糖苷、去咖啡酰基毛蕊花糖苷、肉豆蔻酸、二(2-乙基己基)-苯-1,2-羧酸酯、胡萝卜苷、亚油酸、油酸、α-亚麻酸、γ-亚麻酸、去氢催吐萝芙木醇、布卢门醇A、色原酮、羟基酪醇、环(苯丙-缬)二肽、新橄榄树脂素、(+)-古柯愈创木基甘油-β-阿魏酸乙酯、阿魏酸、木犀草素、金圣草黄素、吲哚-3-甲醛、圣草酚及(E)-3,4-二羟基苯亚甲基丙酮,由本实验室自制,其结构均经NMR、MS、UV等波谱技术鉴定,结果将另文发表。
1.2 实验方法 1.2.1 DWNTs的处理及溶液配制DWNTs于浓硫酸和浓硝酸(体积比3:1)混合液100 mL中超声10 h,过滤并用水洗至pH呈中性,过滤干燥即得。称取10 mg处理的DWNTs,加水定容至10 mL,超声分散得到1 mg·mL-1的DWNTs溶液。化合物浓度均为3 mg·mL-1。
1.2.2 DWNTs/GCE、XOD/DWNTs/GCE电极的构建GCE电极依次用直径0.5和0.03 μm的三氧化二铝在麂皮上抛光,分别在双蒸水和无水乙醇中超声清洗10 min,打磨好的电极在PBS中以100 mV·s-1扫速于-0.6~0.8 V范围内扫描至稳定,电极表面用高纯氮气吹干。GCE电极表面滴加DWNTs水溶液4 μL并置于红外灯下干燥,得DWNTs/GCE电极;再滴加2 μL XOD溶液至电极表面,红外灯下干燥得XOD/DWNTs/GCE电极,电极不用时于4 ℃冰箱中保存。DWNTs/GCE电极与XOD/DWNTs/GCE电极的电镜扫描图如图 1(放大倍数为40 000)。

|
图 1 DWNTs/GCE电极(A)与XOD/DWNTs/GCE电极(B)的电镜扫描图 Figure 1 SEM images of DWNTs/GCE(A)and XOD/DWNTs/GCE(B) |
图 1-A为DWNTs/GCE电极,在电镜下可见电极表面分布均匀的碳纳米管。表明碳纳米管在强酸超声处理后,分散性得到改善,可均匀分散在溶剂中,增强修饰电极的导电性,从而促进电子在电极上的转移。图 1-B为XOD/DWNTs/GCE电极,可见在碳纳米管层上附着的酶分子层。
1.3 电化学生物传感筛选原理文献[9]的电化学生物传感筛选原理为XOD催化XAN氧化产生尿酸,利用电极在化合物溶液中产生尿酸的电催化信号响应进行抑制剂筛选。本方法与其有较大不同,即:XOD在电极上与XAN发生作用,黄嘌呤的电子转移到Mo活性中心,再经[2Fe-2S]传送至FAD+,使FAD+还原成FADH,然后FADH在电极上失去电子产生灵敏的电化学信号;当有XOD抑制剂存在时,此过程中的电子转移将受到阻抑,FADH在电极上的电化学传感信号将降低,藉此可进行XOD抑制剂筛选[10]。
1.4 抑制剂筛选及抑制率计算方法实验所用PBS溶液均通氮气除氧15 min,实验在氮气保护中进行。XOD/DWNTs/GCE电极在空白PBS溶液中采用循环伏安法活化至背景电流稳定,然后在含28 μg·mL-1 XAN溶液中富集5 min,用循环伏安法检测响应电流;另取一空白PBS溶液,加一定量待测成分,先富集10 min,加入XAN使其质量浓度为28 μg·mL-1,富集5 min后检测。循环伏安法电位设置范围-0.6~0.8 V,扫描速率100 mV·s-1。所有实验均重复3次,根据610 mV处的峰电流响应变化观测抑制剂对XOD的抑制活性,其抑制率计算公式:
以黄嘌呤氧化酶为识别元件,应用电化学生物传感法筛选车前子中分离得到的23个化合物。每个样品均取一较高浓度进行初筛,发现其中7个对XOD具有不同程度抑制活性成分,分别为木犀草素、毛蕊花糖苷、金圣草黄素、吲哚-3-甲醛、圣草酚、(E)-3,4-二羟基苯亚甲基丙酮、二(2-乙基己基)-苯-1,2-羧酸酯,其中木犀草素、毛蕊花糖苷、金圣草黄素对黄嘌呤氧化酶的抑制效果较强,抑制率均达60%以上,结果见图 2。吲哚-3-甲醛、圣草酚、(E)-3,4-二羟基苯亚甲基丙酮、二(2-乙基己基)-苯-1,2-羧酸酯的抑制效果较弱,最大抑制率均于50%以下,结果见图 3。其余16个化合物无抑制作用,见图 4。
|
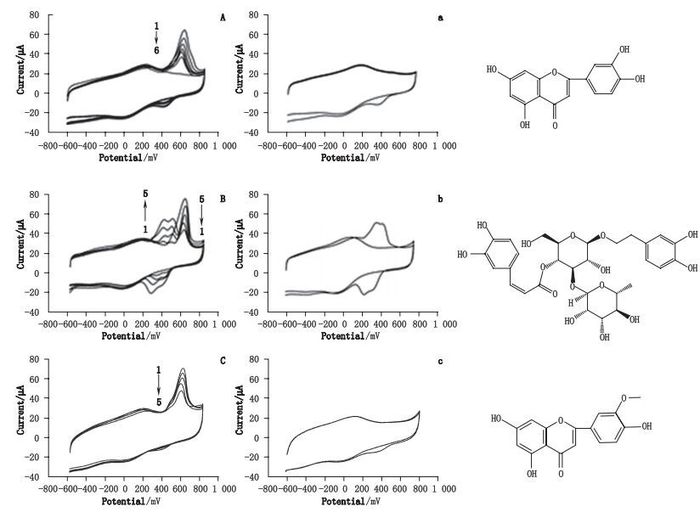
图 2 不同浓度木犀草素(A)、毛蕊花糖苷(B)、金圣草黄素(C)对相同浓度XAN的循环伏安图及其无XAN的响应图(a、b、c) Figure 2 The inhibition effect of different concentrations of luteolin(A), acteoside(B), chrysoderol(C)toward xanthine, and the CV of luteolin(a), acteoside(b), chrysoderol(c)without XAN |

|
图 3 不同浓度吲哚-3-甲醛(A),圣草酚(B),(E)-3,4-二羟基苯亚甲基丙酮(C),二(2-乙基己基)-苯-1,2-羧酸酯(D)对相同浓度XAN的循环伏安图及其无XAN的响应图(a、b、c、d) Figure 3 The inhibition effect of different concentrations of 1H-indolo-3-carbaldehyde(A), eriodictyol(B), 4-(3, 4-dihydroxyphenyl)-3-buten-2-one(C)and bis(2-ethythexyl)-benzene-1, 2-dicarboxylate(D)toward xanthine, and the CV of 1H-indolo-3-carbaldehyde(a), eriodictyol(b), 4-(3, 4-dihydroxyphenyl)-3-buten-2-one(c)and bis(2-ethythexyl)-benzene-1, 2-dicarboxylate(d)without XAN |
图 2-A为XOD/DWNTs/GCE电极在木犀草素(浓度分别为0、1.8、3.0、4.2、5.4、7.2 μg·mL-1)存在时对XAN(28.0 μg·mL-1)的响应,可见其在250~450 mV电位出现单个还原峰,且该峰随着木犀草素浓度的增加而增加,说明木犀草素是电活性成分。而610 mV处的峰电流随着其浓度增加而降低,表现出很好的抑制活性,可得出木犀草素的抑制公式:Y=30.11 lnX+4.05(r2=0.998),可算得其IC50值为4.6 μg·mL-1,与文献[11]接近。
图 2-B为XOD/DWNTs/GCE电极在毛蕊花糖苷(浓度分别为0、3.6、7.2、10.8、14.4 μg·mL-1)存在时对XAN(28.0 μg·mL-1)的响应,可见毛蕊花糖苷也是电活性成分,但也不干扰阻抑信号。610 mV处的峰电流随着其浓度增加而降低,说明毛蕊花糖苷可对XOD催化反应产生阻抑,其抑制公式:Y=46.39 lnX-44.59(r2=0.987),其IC50计算值为7.7 μg·mL-1,筛选结果与文献[12]接近。
图 2-C为XOD/DWNTs/GCE电极在金圣草黄素(浓度分别为0、6、15、36、48、60 μg·mL-1)存在时对XAN(28.0 μg·mL-1)的响应,可知金圣草黄素的抑制率效果较好,抑制公式:Y=18.23 lnX-22.37(r2=0.986),其IC50计算值为53.0 μg·mL-1,本结果较文献[13]基于尿酸产物法所测的值偏大(1.68 μg·mL-1),存在一定的误差,这可能是因为紫外筛选方法可能存在较大干扰所致,但具体原因有待进一步研究。
图 3-A~D分别为吲哚-3-甲醛、圣草酚、(E)-3,4-二羟基苯亚甲基丙酮及二(2-乙基己基)-苯-1,2-羧酸酯在不同浓度时对XAN(28.0 μg·mL-1)的响应的循环伏安图及分子结构式,为直观反映催化电流信号变化,将无电活性和无抑制作用的化合物按照浓度的增加依次向右平移。其中吲哚-3-甲醛在浓度为36 μg·mL-1时抑制率达30.2%;圣草酚浓度为30 μg·mL-1时抑制率达22.7 %,抑制率与文献较接近[14];(E)-3,4-二羟基苯亚甲基丙酮浓度为30 μg·mL-1时抑制率达21.5 %;二(2-乙基己基)-苯-1,2-羧酸酯18 μg·mL-1时抑制率达10.3%。吲哚-3-甲醛、(E)-3,4-二羟基苯亚甲基丙酮及二(2-乙基己基)-苯-1,2-羧酸酯首次发现具有XOD抑制作用。
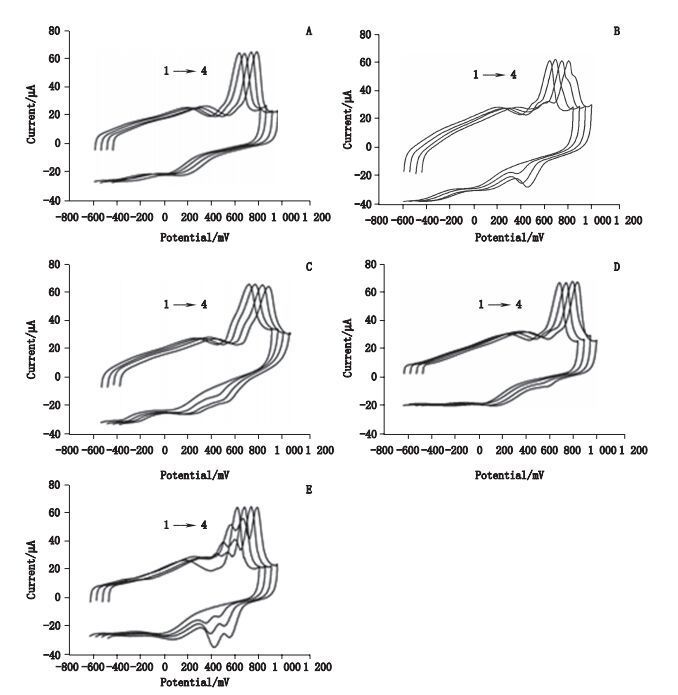
图 4-A为亚油酸在不同浓度(3、12、30 μg·mL-1)时对XAN(28.0 μg·mL-1)的响应图,油酸、α-亚麻酸、γ-亚麻酸、肉豆蔻酸、胡萝卜苷、去氢催吐萝芙木醇、布卢门醇A、色原酮、羟基酪醇、去咖啡酰基毛蕊花糖苷及环(苯丙-缬)二肽图形均与其类似,只在610 mV处存在一尖锐峰,可见这些化合物不是电活性物质,且不抑制电极对XAN的响应。图 4-B~E分别为新橄榄树脂素、(+)-古柯愈创木基甘油-β-阿魏酸乙酯、阿魏酸及异毛蕊花糖苷,可见在不同的电位范围处均存在明显峰电流,且随着成分浓度的增加而增加。而610 mV处峰电流并没有下降的趋势,说明这些成分对XOD皆无抑制作用。
|
图 4 油酸(A)、新橄榄树脂素(B)、(+)-古柯愈创木基甘油-β-阿魏酸乙酯(C)、阿魏酸(D)及异毛蕊花糖苷(E)无XOD抑制活性化合物循环伏安图 Figure 4 The electrocatalytic behavior of oleic acid(A)、(+)-(7R, 7R, 8′S, 8′S)-neo-olivil(B), (+)-erythro-guaiacylglycerol-β-ferulic acid(C)、fercidulic acid(D)and isoacteoside(E)without XOD inhibitory activity |
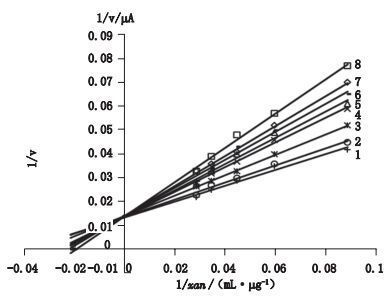
木犀草素、毛蕊花糖苷、金圣草黄素三者抑制率均大于50 %,分别取其半数抑制浓度4.6、7.7、53.0 μg·mL-1于PBS中,吲哚-3-甲醛、圣草酚、(E)-3,4-二羟基苯亚甲基丙酮、二(2-乙基己基)-苯-1,2-羧酸酯抑制效果较弱。分别取其最大抑制率浓度,依次向其中加入XAN(质量浓度分别为:11.2、16.8、21.6、28.0、32.4 μg·mL-1)。用Lineweaver-Burk双倒数法,以峰电流值代替反应速率ν(μA),以其倒数ν-1对XAN的质量浓度C(μg·mL-1)的倒数C-1作图,如图 5,图中1~8分别为无XODI、木犀草素、毛蕊花糖苷、金圣草黄素、吲哚-3-甲醛、圣草酚、(E)-3,4-二羟基苯亚甲基丙酮及二(2-乙基己基)-苯-1,2-羧酸酯。可知各直线均交于纵轴的一点,即当抑制剂浓度一定时,XAN浓度增大,反应速率趋于最大值,即XAN的增加可解除抑制作用,电极反应符合酶催化反应动力学特点。直线与横坐标的截距为-1/ Km′,从图中可知,方程斜率随着抑制强度的增加而增加,Km′也随之增大,符合竞争性抑制类型特点。在抑制剂存在的情况下,表观米氏常数Km′=Km(1+[I]/Ki),由此可得出抑制剂抑制常数,各化合物对XOD的抑制效果见表 1。
|
图 5 各化合物对XOD抑制动力学Lineweaver-Burk双倒数图 Figure 5 Lineweaver-burk plots of inhibition kinetics of seven compounds on XOD |
|
|
表 1 化合物对XOD的抑制效果 Table 1 Inhibitory activity of compounds on XOD |
本实验从车前子的23个化合物中筛选得到7个XODI成分,其中3个黄酮类,1个苯丙素类,1个生物碱类,1个聚酮类和1个苯甲酸类化合物,得到的3个黄酮类成分体外均对XOD有不同程度的抑制作用,木犀草素的抑制作用最强,金圣草黄素次之,圣草酚抑制作用最弱。有文献[15]报道,黄酮类化合物A环7位-OH取代,B环3′,4′-邻二羟基及C环存在C2-C3双键的情况下对XOD的抑制效果较强,结果中木犀草素抑制效果大于金圣草黄素及圣草酚,与报道结论一致。金圣草黄素和圣草酚结构与木犀草素相似,但金圣草黄素B环3′位被-OCH3取代,圣草酚C环无C2-C3双键,结果显示金圣草黄素抑制效果强于圣草酚,可推测C环C2-C3双键的贡献大于B环3′,4′-邻二羟基。车前子中毛蕊花糖苷对XOD具有强烈的抑制活性,且在车前子中的含量高[16],本课题组前期已证实毛蕊花糖苷可通过抑制肝脏XOD活性从而降低尿酸水平,推测毛蕊花糖苷可能为车前子体内降尿酸的主要物质基础。吲哚-3-甲醛(a)、圣草酚(b)、(E)-3,4-二羟基苯亚甲基丙酮(c)、二(2-乙基己基)-苯-1,2-羧酸酯为新发现的XODI,虽然抑制强度较弱,但如对其进行结构修饰,可提高其与XOD分子结合能力进而提高抑制效果。另外,这些活性成分具有多种化合物结构类型,虽然动力学研究表明这些活性成分都具有竞争性抑制作用特点,但同样提示其与XOD可能有不同作用位点或区域。如二(2-乙基己基)-苯-1,2-羧酸酯有可能主要通过疏水基团与XOD疏水区域发生结合,而吲哚-3-甲醛分子中的N、O原子有可能与Mo活性中心发生作用,但具体抑制机制有待于进一步研究。
此外,从本文的筛选可以看出,电化学生物传感方法不仅可显示有电活性的抑制剂对XOD的抑制强度,还可以直观观测抑制率随抑制剂浓度增加而增大的特性,因此可排除假阳性与假阴性结果。
本研究采用电化学生物传感法筛选出7种XODI成分,为车前子的抗痛风药用开发提供了理论依据与物质基础。电化学生物传感法具有简单、快捷、高选择性、高灵敏度、化合物需求量低等优势,在天然产物中XOD抑制剂的筛选中具有广阔应用前景。
| [1] |
周建国, 马敏, 胡猛, 等. 黄嘌呤氧化酶抑制剂治疗慢性心衰39例[J]. 临床军医杂志, 2014, 42(9): 964. ZHOU JG, MA M, HU M, et al. 39 cases of chronic heart failure treatment of xanthine oxidase inhibitors[J]. Clin J Med Off, 2014, 42(9): 964. |
| [2] |
CASTREJON I, TOLEDANO E, ROSARIO MP, et al. Safety of allopurinol compared with other urate-lowering drugs in patients with gout: a systematic review and meta-analysis[J]. Rheumatol Intern, 2014, 35(7): 1127. |
| [3] |
WANG X, ZHAO M, SU G, et al. Antihyperuricemic activities of an ethanolic and aqueous extract of Walnut(Juglans regia L.), shell and a new aldehyde xanthine oxidase inhibitor[J]. In J Food Sci Technol, 2015, 51(2): 453. |
| [4] |
CHEN WJ, WU Y, ZHAO X, et al. Screening the anti-gout traditional herbs from TCM using an in vitro method[J]. Chinese Chem Lett, 2016, 27(11): 1701. DOI:10.1016/j.cclet.2016.05.022 |
| [5] |
王雪洁, 林志健, 张冰, 等. 菊苣小分子化合物对黄嘌呤氧化酶抑制作用的分子对接研究[J]. 中国中药杂志, 2015, 40(19): 3818. WANG XJ, LIN ZJ, ZHANG B, et al. Molecular docking analysis of xanthine oxidase inhibition by constituents of chicory[J]. China J Chin Mater Med, 2015, 40(19): 3818. |
| [6] |
UMAMAHESWARI M, ASOKKUMAR K, SIVASHANMUGAM AT, et al. In vitro xanthine oxidase inhibitory activity of the fractions of Erythrinastricta Roxb.[J]. J Ethnopharmacol, 2009, 124(3): 646. DOI:10.1016/j.jep.2009.05.018 |
| [7] |
LIN CM, CHEN CS, CHEN CT, et al. Molecular modeling of flavonoids that inhibits xanthine oxidase[J]. Biochem Biophys Res Commun, 2002, 294(1): 167. DOI:10.1016/S0006-291X(02)00442-4 |
| [8] |
孙永丽, 赵焕新, 白虹. HPLC法体外筛选黄嘌呤氧化酶抑制剂[J]. 药物分析杂志, 2014, 34(8): 1391. SUN YL, ZHAO HX, BAI H. In vitro screening of potential xanthine oxidase inhibitors by high-performance liquid chromatography[J]. Chin J Pharm Anal, 2014, 34(8): 1391. |
| [9] |
周娟, 刘敏, 丁虹. 丝印电极法体外筛选黄嘌呤氧化酶抑制剂方法研究[J]. 化学学报, 2008, 66(8): 995. ZHOU J, LIU M, DING H. Screening method for xanthine oxidase inhibitor screen printed electrode[J]. Acta Chim Sin, 2008, 66(8): 995. |
| [10] |
王娟, 许兵兵, 曾金祥, 等. 构建电子转移通道阻抑法筛选车前子中黄嘌呤氧化酶抑制剂成分[J]. 药物分析杂志, 2016, 36(10): 1816. WANG J, XU BB, ZENG JX, et al. Development of an electron transfer channel blocking method for screening of xanthine oxidase inhibitors from Plantago asiatica L[J]. Chin J Pharm Anal, 2016, 36(10): 1816. |
| [11] |
闫家凯. 木犀草素对黄嘌呤氧化酶、α-葡萄糖苷酶抑制机理的探讨[D]. 南昌: 南昌大学, 2014 YIN JK. Study on the Inhibition Mechanism of Luteolin on Xanthine Oxidase and α-Glucosidase[D]. Nanchang: Nanchang University, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10403-1014056281.htm |
| [12] |
尚雁君, 李医明, 蒋山好. 玄参中苯丙素苷acetoside对小鼠高尿酸血症的影响[J]. 解放军药学学报, 2006, 22(1): 30. SHANG YJ, LI YM, JIANG SH, et al. The effect of phenypropanoid glycosides acteoside of Scrophularia ningpoensis on mouse hyperuricemia[J]. Pharm J Chin PLA, 2006, 22(1): 30. |
| [13] |
The anti-hyperuricemia and xanthine oxidase inhibition effects of chrysoeriol, a component from Apium graveolens L. seeds[C]//中国药学大会暨中国药师周. 2012
|
| [14] |
黎莉. 七种卷柏属药用植物抑制黄嘌呤氧化酶、脂氧化酶和环氧化酶的活性作用研究[D]. 武汉: 湖北中医学院, 2008 LI L. The Active Effect of Seven Species of Selaginella Inhibition of Xanthine Oxidase, Lipoxygenase and Cyclooxygenase in Medicinal Plants[D]. Wuhan: Hubei College Of Traditional Chinese Medicine.2008 http://d.wanfangdata.com.cn/Thesis/Y1301129 |
| [15] |
COS P, YING L, CALOMME M, et al. Structure activity relationship and classification of flavonoids as inhibitors of xanthine oxidase and superoxide scavengers[J]. J Nat Prod, 1998, 61(1): 71. DOI:10.1021/np970237h |
| [16] |
王隶书, 王友联, 李明洋, 等. HPLC测定市售车前子中毛蕊花糖苷的含量[J]. 中国药师, 2011, 14(11): 1581. WANG LS, WANG YL, LI MY, et al. Determination of verbascoside in commercial semen plantaginis by HPLC[J]. China Pharm, 2011, 14(11): 1581. DOI:10.3969/j.issn.1008-049X.2011.11.007 |
 2017, Vol. 37
2017, Vol. 37 
